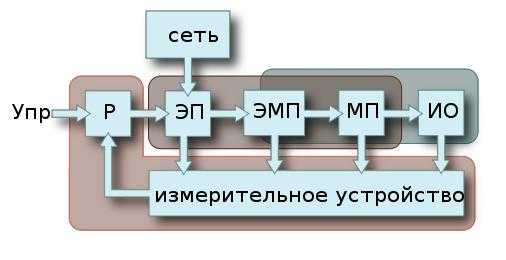
Строение атомов и элементарные частицы. Частицы имеющие одинаковое электронное строение
Строение атома теллура (Te), схема и примеры
Общие сведения о строении атома теллура
Относится к элементам p-семейства. Металлоид. Обозначение – Te. Порядковый номер – 52. Относительная атомная масса – 127,60 а.е.м.
Электронное строение атома теллура
Атом теллура состоит из положительно заряженного ядра (+52), внутри которого есть 52 протона и 76 нейтронов, а вокруг, по пяти орбитам движутся 52 электрона.
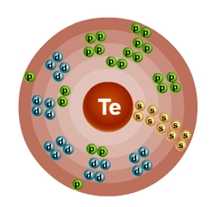
Рис.1. Схематическое строение атома теллура.
Распределение электронов по орбиталям выглядит следующим образом:
+52Te)2)8)18)18)6;
1s22s22p63s23p63d104s24p64d105s25p4.
Внешний энергетический уровень атома теллура содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома теллура можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
|
s |
5 |
0 |
0 |
-1/2 |
|
p |
5 |
1 |
-1 |
+1/2 |
|
p |
5 |
1 |
0 |
+1/2 |
|
p |
5 |
1 |
+1 |
+1/2 |
|
p |
5 |
1 |
-1 |
-1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Электронное строение атома - Основы электроники
Любое вещество состоит из очень маленьких частиц, называемых атомами. Атом—это наименьшая частица химического элемента, сохраняющая все его характерные свойства. Чтобы представить себе размеры атома, достаточно сказать что если бы их удалось уложить вплотную один к другому, то один миллион атомов занял бы расстояние всего в 0,1 мм.
Дальнейшее развитие науки о строении вещества показало, что атом также имеет сложное строение и состоит из электронов и протонов. Так возникла электронная теория строения вещества.
В глубокой древности было обнаружено, что существуют два рода электричества: положительное и отрицательное. Количество электричества, содержащееся в теле, стали называть зарядом. В зависимости от рода электричества, которым обладает тело, заряд может быть положительным или отрицательным.
Было также установлено опытным путем, что одноименные заряды отталкиваются, а разноименные притягиваются.
Рассмотрим электронное строение атома. Атомы состоят из еще более мелких частиц, чем они сами, называемых электронами.
ОПРЕДЕЛЕНИЕ:Электрон — это мельчайшая частица вещества, имеющая наименьший отрицательный электрический заряд.
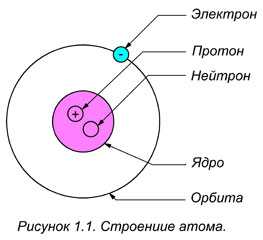
Электроны вращаются вокруг центрального ядра, состоящего из одного или более протонов и нейтронов, по концентрическим орбитам. Электроны являются отрицательно заряженными частицами, протоны — положительными, а нейтроны — нейтральными (рисунок 1.1).
ОПРЕДЕЛЕНИЕ: Протон — мельчайшая частица вещества, имеющая наименьший положительный электрический заряд.
Существование электронов и протонов не вызывает никакого сомнения. Ученые не только определили массу, заряд и размеры электронов и протонов, но даже заставили их работать в различных электрических и радиотехнических приборах.
Было также установлено, что масса электрона зависит от скорости его движения и что электрон не только поступательно движется в пространстве, но и вращается вокруг своей оси.
Наиболее простым по своему строению является атом водорода (рис. 1.1). Он состоит из ядра-протона и вращающегося с огромной скоростью вокруг ядра электрона, образующего внешнюю оболочку (орбиту) атома. Более сложные атомы имеют несколько оболочек, по которым вращаются электроны.
Эти оболочки последовательно от ядра заполняются электронами (рисунок 1.2).
Теперь разберем строение электронных оболочек атомов. Самая внешняя оболочка называется валентной, а число электронов, содержащееся в ней, называется валентностью. Чем дальше находится от ядра валентная оболочка, следовательно, тем меньшую силу притяжения испытывает каждый валентный электрон со стороны ядра. Тем самым у атома увеличивается возможность присоединять к себе электроны в том случае, если валентная оболочка не заполнена и расположена далеко от ядра, либо терять их.Электроны внешней оболочки могут получать энергию. Если электроны находящиеся в валентной оболочке получат необходимый уровень энергии от внешних сил, они могут оторваться от нее и покинуть атом, то есть стать свободными электронами. Свободные электроны способны произвольно перемещаться от одного атома к атому. Те материалы, в которых содержится большое число свободных электронов, называются проводниками.
Изоляторы, есть противоположность проводникам. Они препятствуют протеканию электрического тока. Изоляторы стабильны потому, что валентные электроны одних атомов заполняют валентные оболочки других атомов, присоединяясь к ним. Это препятствует образованию свободных электронов. Промежуточное положение между изоляторами и проводниками занимают полупроводники, но о них мы поговорим позжеРассмотрим свойства атома. Атом, который имеет одинаковое число электронов и протонов, электрически нейтрален. Атом, получающий один или более электронов, становится отрицательно заряженным и имеет название отрицательный ион. Если атом теряет один или более электронов, то он становится положительным ионом, то есть заряжается положительно.
ПОНРАВИЛАСЬ СТАТЬЯ? ПОДЕЛИСЬ С ДРУЗЬЯМИ В СОЦИАЛЬНЫХ СЕТЯХ!
Похожие материалы:
Добавить комментарий
www.sxemotehnika.ru
Ответ Какие два атома имеют одинаковое число s электронов в основном состояни
С этим файлом связано 19 файл(ов). Среди них: Dinamika.pdf, Sborn_zadach_po_fizike_10-11.pdf, himiya-a2-praktika.pdf, rus-C-problema.pdf, Деление с остатком.doc, Декартова система координат.doc, Orfografia_i_punktuatsia.pdf, Kratkiy_grammaticheskiy_spravochnik.pdf, Vokrug_sveta_5_2014_vk_com_mirzhurnalov.pdf и ещё 9 файл(а).Показать все связанные файлыwww.ctege.info Задания А1 по химии 1. Одинаковое число электронов содержат частицы 1) 2) 3) 4) Ответ: 1. 2. Какие два атома имеют одинаковое число s−электронов в основном состояни 1) 2) 3) 4) Ответ: 4.3. Электронную конфигурацию инертного газа имеет ион 1) 2) 3) 4) Ответ: 2.4. Элемент, электронная конфигурация атома которого , образует водородное соединение 1) 2) 3) 4) Ответ: 4.
www.ctege.info 5. Атому аргона в основном состоянии соответствует электронная конфигурация частицы 1) 2) 3) 4) Ответ: 1.6. Электронная конфигурация соответствует частице 1) 2) 3) 4) Ответ: 2.7. Три неспаренных электрона на внешнем уровне в основном состоянии содержит атом 1) титана 2) кремния 3) магния 4) фосфора Ответ: 4.8. Восьмиэлектронную внешнюю оболочку имеет частица 1) 2) 3) 4) Ответ: 2.
www.ctege.info 9. Восьмиэлектронную внешнюю оболочку имеет частица 1) 2) 3) 4) Ответ: 2. 10. Число электронов в ионе меди равно 1) 64 2) 66 3) 29 4) 27 Ответ: 4.11. Электронная конфигурация соответствует иону 1) 2) 3) 4) Ответ: 2.12. Какое соединение содержит оба элемента с электронной конфигурацией 1) 2) 3) 4) Ответ: 3.
www.ctege.info 13. Элемент, электронная конфигурация атома которого , образует водородное соединение 1) 2) 3) 4) Ответ: 2.14. Восьмиэлектронную внешнюю оболочку имеет ион 1) 2) 3) 4) Ответ: 2.15. Одинаковую электронную конфигурацию имеют частицы 1) N3- и Аl3+2) Са2+и Mg2+3) F- и Ar0 4) Cl0и S+4 Ответ: 1.16. Электронная конфигурация 1s22s22p63s23p6 соответствует частице 1) N3-2) Ca2+3) F-4) Al3+ Ответ: 2.
www.ctege.info 17. Одинаковую электронную конфигурацию имеют ионы 1) Cl- и Br-2) Al3+и F-3) O2- и Ca2+4) Mg2+и S2- Ответ: 2.18. Одинаковую электронную конфигурацию имеют ионы 1) Al3+и K+2) Na+и O2–3) Mg2+и Ca2+4) Na+и Cl– Ответ: 2.19. Электронная формула отражает строение частиц 1) 2) 3) 4) Ответ: 3.20. Сходную конфигурацию внешнего энергетического уровня имеют атомы фтора и 1) кислорода 2) лития 3) брома 4) неона Ответ: 3.
перейти в каталог файловuhimik.ru
Частицы строение - Справочник химика 21
Рассмотрим строение коллоидной частицы на примере золя иодида серебра. Последний получается при взаимодействии растворов нитрата серебра и иодида калия, при избытке одного из растворов. В случае избытка иодида калия получаются частицы, строение которых в общей форме можно представить следующим образом [c.311] С помощью электронного микроскопа в отличие от ультрамикроскопа удается рассмотреть изображение и форму коллоидных частиц. Это позволило, иапример, изучить форму и строение вирусов, которые имеют размер 1—100 нм, наблюдать макромолекулы, например молекулы белков, динамику формирования коллоидных частиц, строение гелей и т. д. Одним из существенных ограничений электронной микроскопии при исследовании коллоидных растворов является необходимость получения объекта в твердом состоянии в очень тонком слое. [c.395]Вопрос о внутреннем строении атомов и молекул интересовал уже М. В. Ломоносова. Во тьме должны обращаться физики, а особливо химики, не зная внутреннего нечувствительных частиц строения , — писал он, ставя перед наукой будущего те задачи, которые разрешаются в настоящее время химической физикой. [c.71]
Во тьме должны обращаться физики, а особливо химики, не зная внутреннего нечувствительных частиц строения. [c.31]
Какая из двух частиц, строение которых обсуждено выше, представляется Вам более стабильной [c.682]
Атомно-молекулярное учение помогает составить правильное представление о веществах и их превращениях. Во тьме должны находиться физики и особливо химики, не зная внутреннего частиц строения ,— писал М. В. Ломоносов. [c.11]
Существуют молекулы или частицы, строение которых не может быть описано с позиций двухцентровой связи, в которых обобществленные электроны находятся на орбиталях, делокализованных на трех и более атомах Например, [c.256]
Сделан обзор и систематизированы основные проблемы современной коллоидной химии, а именно образование и свойства частиц, строение и свойства поверхностных (межфазных) слоев, контактные взаимодействия частиц и связанные с ними вопросы устойчивости и структурообразования, структурообразование и реологические свойства дисперсных систем. Намечены некоторые пути дальнейшей разработки этих проблем. [c.363]
В классической теории химического строения явно или не явно предполагалось, что понятия и постулаты о единице сродства и валентности отображают реальные закономерности в строении молекул и позволяют определить, может ли реально существовать или быть синтезирована химическая частица того или другого строения. Именно предполагалось, что все частицы, строение которых можно изобразить формулами строения классической теории, удовлетворяющими постулатам о единице сродства и валентности, могут существовать в природе или могут-быть синтезированы, т. е. являются в принципе более или менее устойчивыми образованиями, способными существовать как единое целое. Все остальные частицы, строение которых можно изобразить только формулами, не отвечающими постулатам о единице сродства и валентности, не могут существовать в природе или быть синтезированы. [c.36]
Великий русский ученый М. В. Ломоносов (1711— 1765) писал Во тьме должны обращаться физики и особливо химики, не зная внутреннего частиц строения . Он явился одним из создателей учения о строении вещества. [c.8]
Атомы. Все вещества образуются из атомов -чрезвычайно малых химически неделимых частиц. Строение и процессы расщепления атомов составляют предмет изучения другой науки - ядерной физики. Однако химические свойства атомов определяются строением его внешней электронной оболочки и некоторыми его характеристиками. Атом состоит из ядра и окружающего это ядро электронного облака. Ядро атома включает протоны (частицы с единичным положительным зарядом) и почти одинаковой с ними массы электронейтральные нейтроны. Вокруг состоящего из протонов и нейтронов ядра движутся отрицательно заряженные электроны. Наиболее простым по своей структуре является атом водорода его ядро состоит из одного протона, вокруг которого вращается один электрон. Положительный заряд протона и отрицательный заряд электрона имеют одинаковую величину, и атом водорода является нейтральной частицей. [c.11]
Во тьме должны обращаться физики, а особливо химики, не зная внутреннего нечувствительных частиц строения. Но ежели когда-нибудь ске таинство откроется, то подлинно химия тому первая предводительница будет, первая откроет завесу внутреннего сего святилища натуры . [c.70]
В каких случаях взаимодействуют между собой вещества Этот ключевой вопрос химической науки неизменно вставал с момента ее возникновения. Изучение причин взаимного союза частиц еще М. В. Ломоносов считал главной задачей химии. Действительно, знание того, почему одни вещества активно реагируют между собой, а другие при тех же условиях не образуют никаких соединений, открыло путь к целеустремленному проведению химических процессов. М. В. Ломоносов утверждал, что путь к этому лежит через изучение строения нечувствительных частиц ( элементов — атомов, корпускул — молекул. — Я. Б.), составляющих природные тела. Во тьме должны обращаться физики, а особливо химики, не зная внутреннего нечувствительных частиц строения . [c.144]
Положить в основу химии механику, обрабатывать полученные при изучении тел результаты математически — вот единственно правильный путь превращения химии из ремесла в науку. Развивая впоследствии мысли о роли физики в изучении химии, Ломоносов составил программу новой науки — физической химии — и читал курс ее студентам. Это был первый в истории науки курс физической химии Как и в физике, Ломоносов объяснял химические явления свойствами и изменениями частичек, из которых построены тела. Но Ломоносов прекрасно понимал, что если для физики важно знать, как тела складываются из частичек и как ведут себя эти частички при различных внешних воздействиях — нагревании, освещении и т. п., — го для химии не менее важно знать, как устроены сами частички и что с ними происходит при химических превращениях. Он говорил в одном из своих последующих сочинений, что во тьме должны обращаться физики особливо химики, не зная внутреннего... частиц строения . Ломоносов был уверен, что ежели когда-нибудь сие таинство откроется, то подлинно Химия тому первая предводительница будет первая откроет завесу внутреннего сего святилища натуры . [c.65]
М. В. Ломоносов писал еще в 1760 г. Во тьме должны обращаться физики, а особливо химики, не зная внутреннего нечувствительного частиц строения . Этим он указывал, что химики должны знать взаимное расположение атомов в молекулах, иначе говоря—формулы строения или структурные формулы изучаемых веществ. [c.15]
В своих работах М. В. Ломоносов формулирует общие принципы изучения веществ и их превращений на основе атомистики. Главной задачей химика он считает изучение свойств нечувствительных частичек, из которых состоят все тела и от которых зависят качества этих тел . Во тме должны обращаться физики, —писал он, —а особливо химики, не зная внутреннего нечувствительных частиц строения [3, стр. 254]. Химия, — пишет он далее, —наука изменений, происходящих в смешанном теле, поскольку оно смешанное [3, стр 45]. [c.16]
Первый член уравнения (П. 89) дает величину дисперсионного взаимодействия А и В в разреженном газе. Второй член учитывает влияние среды он сложным образом зависит от взаимного расположения частиц, строения сольватной оболочки и функции распределения молекул растворителя. Для того чтобы сказанное не выглядело голословно, мы довольно подробно, хотя может быть и недостаточно строго, исследуем структуру второго члена [c.70]
Постулат VI. Если в экспериментально изученных частицах, строение которых надежно установлено в рамках понятий классической теории, атомы некоторых элементов встречаются с определенной валентностью и образуют между собой связи определенных кратностей, то, как правило, могут существовать любые химические частицы, для которых можно написать формулы химического строения, содержащие атомы указанных элементов установленной для них валентности (в других уже изученных частицах и рядах частиц) и связи между ними установленной кратности (в других уже изученных частицах и рядах частиц). [c.51]
Так впервые со всей четкостью Менделеев поставил вопрос о необходимости изучения неорганических полимеров. Менделеев отмечал, что полимерными являются кремнезем, кремнегель, окислы алюминия, железа, хрома, свинца и некоторые другие соединения. Подробно рассматривая соединения кремния, он подчеркивал, что ... и в безводном кремнеземе уд. веса 2,2 и 2,6 находится не 8102, а сложная частица строение кремнезема есть поли- [c.13]
Ломоносов в Рассуждении о твердости и жидкости тел говорит о строении частиц или молекул Во тьме должны обращаться физики, а особливо химики, не зная внутреннего нечувствительного частиц строения . [c.496]
Содержание данного тома делится на три части. Часть А посвящена основам строения вещества (атомно-молекулярное учение, элементарные частицы, строение атомного ядра) в части Б рассмотрены основы физической химии часть В объединяет данные по соединениям и реакциям неорганической хнмии. [c.6]
Относительно малая активность углерода и кремния при обычной температуре — следствие их полимерного строения и большой энергии связи между атомами. Более высокая реак-ционноспоообность кремния, чем углерода, обусловлена устойчивостью образую-щихся соединений, а также другими причинами (размер частиц, строение поверхности, содержание примесей). При обычной температуре углерод и кремний не изменяются (не реагируют) на воздухе. При более высокой температуре образуются диоксиды. Вода при повышенной температуре восстанавливается ими до Нг [c.555]
В отличие от других электростатических теорий химической связи здесь центральный ион рассматривается не просто как заряженная частица, строение его внешней электронной оболочки детализируется на основе квантовой механик1г. Модель Бете основана на идее, что в комплексе электроны центрального атома испытывают влияние электрического поля, создаваемого лигандами ( кристаллического поля ). Это приводит к расщеплению уровней энергии внешних электронов центрального иона (эффект Штарка, см. 14). Расщепление терма мало влияет на полную энергию комплексного соединения, но оказывает существен1юе влияние на многие его свойства магнитные, оптические, структурные, термодинамические и кинетические. Эффект расщепления терма зависит не только от числа лигандов, но и от их расположения, т. е. от симметрии поля. [c.237]
Основываясь на данных рентгеноструктурного и электронно-графического анализов, Ю. М. Бутт с сотрудниками 1119[ считает, что в объеме цементного камня раздельно существуют два вида кристаллических каркасов — гидросиликатнЫи"11 гидроалюминатный. Кроме них в структуре распределено большое количество индивидуальных кристаллов гидратов и их агрегатов, которые удерживаются механическими силами сцепления. Механизм срастания структурноподобных гидратов друг с другом описан ими следующим образом. В узком зазоре между сблизившимися (в результате броуновского движения) кристаллами возрастает концентрация вовлеченного раствора, а затем начинается процесс его кристаллизации. Вновь образующийся кристаллик на поверхности кристалла, возникшего ранее, растет в направлении, параллельном поверхности другого, достигает ее и срастается. Выделяющееся при этом тепло расходуется на восполнение убыли концентрации путем перехода в растворенное состояние части поверхностных слоев срастающихся кристаллов. Вследствие переотложения вещества зарастает зазор между сблизившимися частицами. Строение кристаллической решётки шва аналогично строению решеток срастающихся кристаллов, и его прочность может превышать прочность самих кристаллов. Интересно, что несколько ранее М. И. Стрелков [104] предполагал, что сращивание кристаллов протекает после окончания их роста, срастание кристаллогидратов происходит (после их сближения силами диспергационного давления) при помощи пересыщенного в узком зазоре между поверхностями кристаллов раствора подобно залечиванию дефектов в крупных кристаллах. [c.39]
Существуют молекулн шш частицы, строение которых не может быть описано о поашшй двухцентровой связи, упомянутой выше. [c.38]
Большинство философов XVII и XVIII вв. присоединилось к учению Гассенди о молекулах как основных структурных единицах вещества. Ломоносов рассматривал движение молекул (он их называл нечувствительными , т. е. невидимыми части-цами) как причину или проявление теплоты. Выяснение внутреннего строения молекул было сформулировано им как основная задача физики и химии. Он писал Во тьме должны обращаться физики и особливо химики, не зная внутреннего нечувствительных частиц строения . [c.5]
Но если в растворе избыток одного из указанных ионов, то микрокристаллы Ag l достигают только коллоидной степени дисперсности (от 10 до 10 см). Они адсорбируют из раствора находящиеся в избытке ионы С1 или соответственно ионы Ag . В этом случае образуются частицы, строение которых может быть схематически представлено следующим образом [c.90]
Непосредственным выводом из данной работы Митчерлиха было то, что объемный метод не может служить однозначным критерием для определения атомного веса элементов или молекулярного веса соединений. Таким образом, Митчерлих, допуская только одну дискретную частицу строения газообразных веществ — атом, вполне естественно пришел к доказательству несостоятельности гипотезы об одинаковом числе частиц в одинаковом объеме газа. Он, как и другие химики, рассматривал это как несостоятельность гипотезы Авогадро. Но Митчерлих одновременно признавал существавание каких-то определенных простых соотношений между числом атомов и объемом газообразных веществ. На это указывали работы Гей-Люссака и Дюма по определению плотности пара органических веществ. Если ни Дюма, ни Митчерлих не сумели сделать правильных выводов из своих исследований, то они во всяком случае сыграли положительную роль уже тем, что привлекли внимание химиков к тому факту, что существуют. какие-то закономерности между объемами газообразных веществ и их молекулярными формулами. [c.88]
Коагуляция гидрофобных золей электролитами. Находящийся в коллоидной системе в качестве третьего компонента ионный стабилизатор (растворимый в воде электролит) своим присутствием препятствует процессу коагуляции, т. е. сообщает золю определенную устойчивость. Стабилизующее действие ионогенной группы имеет двоякий характер и связано с возникновением двойного электрического слоя вокруг ядра коллоидной частицы. Противоионы, образующие наружный диффузный слой, сильно гидратированы, что обеспечивает их связь с дисперсионной средой. Те же противоионы с другой стороны связаны электростатическими силами с ионами, прочно адсорбированными ядром. Таким образом, ионный стабилизатор создает непрерывный переход от нерастворимого ядра к дисперсионной среде. Внешняя сильно гидратированная ионная атмосфера вокруг частицы является важньий фактором устойчивости змей, препятствуя слипанию коллоидных частиц. Строение диффузного слоя обусловливает возникновение электрокинетического потенциала, проявляющегося при перемещении частиц. Все остовы мицелл (гранулы), находящиеся в золе данного вещества, имеют заряд одного и того же знака (например, все гранулы в золе АзаЗ [c.306]
С другой стороны, отыскание всевозможных случаев химического сочетания паев в частицах,— случаев, удовлетворяющих требованию одной только атомности элементов,— составляет чисто схематическую задачу, разрешаемую, например (для менее сложных частиц, по крайней мере), довольно просто том, что, приняв за исходную точку известный, действительно существующий углеводород со всеми его изомерными видоизменениями, можно для каллдого из этих видоизменений брать всевозможные случаи замещения водорода сначала — элементарными паями, потом — различными безуглеродными остатками и наконец — радикалами более и более сложными. Само собою разумеется, что, употребляя такой искусственный прием, необходимо каждый раз вникать в химическое строение, изображаемое полученной формулой, для того чтобы избегнуть ошибок и но принять эа выражение действительно различных случаев строения формул, происшедших различными замещениями, но в суидности представляющих частицы строения тожественного.— При помощи соответственных реакций остается далее искать действительного получения частиц, формулы строения которых найдены заранее и которые еще неизвестны. Без сомнения, окажется не мало веществ, кажущихся возможными с точки зрения атомности и строения, но неспособных существовать в действительности (ср. 46 и 49), и это несуществование, при достаточном количестве собранных фактов, конечно, сделается источником новых обобщений, правильностей и законов. Такова, кажется, одна из важных задач химии, представляющаяся ей в недалеком будущем. [c.442]
И только с 1862 г. химики входят постепеиио, оставляя типические и унитарные представления, в круг новых идей и начинают проникать, благодаря гению Бут,лерова, во внутреннее нечувствительных частиц строение . Бутлеров говорит, что каждый химический атом, входящий в состав тела, принимает участие в об разовании последнего и действует определенным количеством принадлеягащей ему силой сродства. Я называю химическим строением распределение действия этой силы, вследствие которого химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу. Химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением . Бутлерову приходилось защищать высказанный им принцип химического строения от умаления его заслуг, как то позволил себе Лотар Мейер. Как и многим русским ученым, ому не всегда за границей отдавали долнизложение теории строения вполне стройное, без тех противоречий, в которые тогда впадал Вюрц и особенно Кекуле. [c.496]
chem21.info
Строение атомов и элементарные ч
Э.Резерфорд (1871 - 1937), исследуя законы рассеяния α-частиц, которыми он бомбардировал атомы различных элементов, обнаружил в атомах тяжелые ядра с диаметром порядка 10Ф (1Ф = 10-13 см = 10-15 м = 1 фм (фемтометр)).Далее оказалось, что ядро по сравнению с самим атомом настолько мало, что вероятность попадания заряженной частицы в ядро составляет примерно 1:100 000. Это открытие позволило Резерфорду в 1911 году предложить планетарную модель атома, на основе которой в 1913 году Н.Бор (1885 - 1962) положил начало квантовой теории атома. Согласно Бору, самый легкий атом водорода состоит из тяжелого положительно заряженного ядра (протона), вокруг которого вращается легкий отрицательно заряженный электрон.
Четких границ ядра атомов не имеют. Диаметр ядра Н равен 1.45 Ф, диаметр же атома Н около 100 000 Ф. Диаметр ядра атома U равен 9 Ф. Таким образом, размеры ядра атомов в периодической системе элементов от H до U увеличиваются примерно в 6 раз.
В настоящее время, изучение микрообъектов и микрособытий стало возможным благодаря сочетанию теоретических успехов квантовой механики и тончайших физических экспериментов. Законы квантовой механики позволили выяснить строение атомов, понять устройство их ядер и свойства, составляющих атомы, элементарных частиц.
В настоящее время известно несколько сотен элементарных частиц. Они разделяются между собой по:
а) массе на тяжелые – барионы, средние – мезоны и легкие – лептоны с фотонами;
б) отношению к принципу Паули на подчиняющиеся – фермионы и частицы с целым или нулевым спином – бозоны;
в) участию в сильных взимодействиях – адроны и в слабых взаимодействиях – фотоны, электроны, мюоны, тау-лептоны, нейтрино.
Строение атомных ядер
Ядра атомов сложены элементарными частицами – протонами (+) и нейтронами (0). Масса протона mp = (1.672614±0.0000086)*10-24 г, что в 1836 раз больше массы электрона. Число протонов в ядре, равное атомному номеру элемента Z, определяет его положение в периодической системе элементов. Нейтрон имеет массу, равную примерно 1,75*10-24 г, т.е. в 1840 раз большую, чем у электрона. Заряд нейтрона равен нулю. Нейтрон устойчив только в составе стабильных атомных ядер. Свободный нейтрон – нестабильная частица, распадающаяся по схеме n→p+e-+νe. В веществе, вследствие поглощения нейтронов ядрами атомов, свободные нейтроны существуют всего лишь единицы–сотни микросекунд.
Ядерное вещество имеет огромную плотность, оцененную Я.И.Френкелем в 1014 г/см3, т.е. 1 см3ядерного вещества весит от 100 до 600 млн. тонн. Ядра атомов несут положительный заряд. Наивысшая плотность заряда у ядра атома H – протона, чем больше масса ядра, тем меньший заряд оно имеет.
Ядерные силы, связывающие нуклоны (протоны и нейтроны) в ядре остаются не до конца разгаданными, известно, что они в тысячи раз превышают силы электростатического взаимодействия протона и нейтрона. Особенностью ядерных сил является то, что они действуют на очень малых расстояниях, и на удалении 4 Ф их роль становится несущественной. Япоснкий физик Х. Юкава впервые объяснил природу ядерных сил особой формой излучения нуклонов, выражающейся в непрерывном обмене последних мезонами - частицами с массой примерно в 300 раз превышающей массу электронов. В 1947 году мезоны были установлены в составе космического излучения и в настоящее время экспериментально подтверждена важная роль мезонов в ядерном взаимодействии.
Структура атомных ядер остается одной из сложнейших проблем своременной физики. Существует несколько моделей атомных ядер (модель «жидкой капли», модель ферми-газа, оптическая, коллективная, оболочечная), однако все они используются как более или менее близкие к реальности гипотезы. Согласно широко распространенной оболочечной модели, каждый нуклон в ядре находится в определенном квантовом состоянии и располагается на отвечающем этому состоянию уровне, который может заполняться определенным числом нуклонов. Ядра, в которых полностью заполнены уровни с числом протонов или нейтронов 2, 8, 20, 28, 40, 50, 82, 126, называются магическими. Они отличаются от соседних ядер повышенной устойчивостью, большей распространенностью и другими свойствами.
По соотношению в ядрах числа протонов и нейтронов принято называть изотопами атомы с одним и тем же числом протонов, но с разным числом нейтронов. В изотопах Z постоянно, N и A - переменны.
Изобары – атомы с разным числом протонов, но с одинаковым массовыми числами. В изобарах А постоянно, Z и N - переменны.
Изотоны – атомы с разным числом протонов и разными значениями массового числа, но с одинаковым числом нейтронов. В изотонах N постоянно, Z и A – переменны.
Атомы с одинаковым составом ядра могут находиться в различных энергетических состояниях. Их называют изомерами. Изомеры имеют разные физические свойства, например период плураспада радиоактивных ядер и энергию связи нуклонов.
Основные свойства атомов и ионов
Орбитальные радиусы – радиусы максимумов радиальной плотности электронов внешней орбитали. Они отражают размеры атомов или ионов в свободном состоянии, т.е. вне химической связи. Эффективным ионным или атомным радиусом называют размер атома или иона в соединении. Они определяются через длину связи – расстояние между центрами атомов или ионов, определяемое рентгеновскими методами. Существующие системы эффективных ионных радиусов рассчитаны относительно величины радиуса иона кислорода, составляющей от 0,132 до 0,14 нм. Для элементарных ионов одного и того же элемента установлено, что радиус катиона меньше радиуса атома, а последний, в свою очередь меньше радиуса аниона.
В зависимости от положения в Периодической системе установлены основные закономерности изменения радиусов атомов:
1) радиусы увеличиваются в группах с ростом атомного номера в связи с увеличением числа электронных оболочек;
2) радиусы уменьшаются в периодах с увеличением заряда ядра;
3) наиболее близкие по радиусу элементы располагаются по диагонали друг от друга;
4) для лантаноидов и актиноидов радиусы уменьшаются с ростом порядкового номера в результате увеличения заряда ядра и заполнения электронами f-подуровня («лантаноидное сжатие»), вследствие этого, радиусы элементов, располагающихся в периодической системе после лантаноидов, Hf, Ta, W, практически не отличаются от аналогичных элементов предшествующего периода: Zr, Nb, Mo.
Валентность (степень окисления) – мера заряда иона или количество электронов отданных или присоединенных атомом при образовании иона.
Потенциал ионизации – энергия, необходимая для удаления электрона из атома. С ростом атомного номера потенциалы ионизации увеличиваются в периоде и уменьшаются в группе. Обратной величиной к потенциалу ионизации является сродство к электрону.
Электроотрицательность – способность атома или иона при вступлении в соединения притягивать электроны. Электроотрицательность является функцией от потенциала ионизации и сродства к электрону. Её величина зависит от заряда ядра атома, его валентности в данном соединении и строения электронных оболочек.
В периоде электроотрицательность минимальна для щелочных металлов и увеличивается к галогенам. Для литофильных катионов она уменьшается в группе с увеличением ионного радиуса. Для халькофильных элементов электроотрицательность выше, чем у литофильных из той же группы Периодической системы.
Элементы с резко различной электроотрицательностью образуют соединения с ионным типом связи. Близкие и высокие значения электроотрицательности приводят к образованию ковалентной связи, а близкие и малые – металлической.
Ионный потенциал Картледжа (Z), равный отношению валентности (W) к ионному радиусу (R): Z=W/R, отражает свойства катионогенности или анионогенности элементов. Минимальными значениями потенциала Картледжа обладают наиболее сильные катионы (щелочные, щелочноземельные металлы), максимальные значения Z характерны для галогенов и элементов, образующих кислородные анионы. Промежуточные значения этого параметра характерны для амфотерных элементов.
Величина ионного потенциала Картледжа позволяет судить о подвижности элементов – способности образовывать ионы и мигрировать в водных растворах. Элементы с низкими и высокими значениями Z являются наиболее подвижными, а с промежуточными – инертными.
Классификация элементов по типам строения их атомов
Если индивидуальность химического элемента определяется зарядом ядра его атомов, то его химические свойства определяются числом и расположением его внешних электронов. Электроны располагаются вокруг ядра на строго определенных расстояниях согласно их энергетическим уровням. Определенное число электронов образует серии, создающие вокруг ядра «электронные оболочки».
Число электронов в каждой серии, по Паули, 2n2, где n – номер серии.
Например, в серии n = 1, куда входят водород и гелий, может быть только 1 или 2 электрона, во второй серии 2 х 22 = 8 электронов, т.е. при последовательном заполнении серии электронами от 1 до 8 должны существовать 8 элементов, что наглядно подтверждается естественным рядом элементов от Li до Ne, в третьей серии 2 х 32 = 18 элементов и 2 х 42 = 32 - в четвертой (от Cs до Rn). Спектральные исследования указывают на различие в энергии связи электронов данной электронной серии (уровня), поэтому электроны распределяются на подгруппы, обозначаемые буквами s, p, d, f, причем в подгруппе s может быть не более 2, p - не более 6, d - не более 10 и f - 14 электронов.
В зависимости от своего электронного строения все химические элементы могут быть разделены на элементы-восстановители, отдающие электроны и образующие катионы, и элементы-окислители, приобретающие электроны и образующие анионы.
С точки зрения строения атомов элементы подразделяются таким образом.
1. Инертные газы, не участвующие в химических процессах, обладающих внешней 8-электронной оболочкой (у гелия 2-электронная).
II, Атомы, образующие ионы с 8-электронной оболочкой (К, Al, Sc, Mg, Ti, Ce, Th, U, F, O, Cl, S и др.).
III. Атомы, образующие ионы с 18-электронной оболочкой (Ag, Ga, Sn, Hg, Cd, In, Zn и др.).
IV. Атомы переходных элементов, занимающих промежуточное положение между двумя предыдущими группами (Mn, Fe, Co, Ni, Re, Pd, Pt и др.).
У гомологов, т.е. у элементов с одинаковым типом строения внешних электронных оболочек, но различными зарядами ядра, иначе говоря, у элементов одной и той же группы и подгруппы периодической системы, наблюдаются следующие закономерные изменения их химических свойств.
У элементов, образующих ионы, с 8-электронной внешней оболочкой, химическая активность возрастает, потенциалы ионизации уменьшаются, переход из металлического состояния в окисное сопровождается закономерным возрастанием выделяющейся при этом энергии, например, от лития к натрию, калию, рубидию и цезию.
Объясняется это тем, что у более тяжелых гомологов с более сложно построенной электронной оболочкой внешний электрон более удален от притягивающего его положительно заряженного ядра и промежуточные слои электронов играют экранирующую роль - чем больше электронов между ядром и валентным электроном, тем слабее его связь с ядром, тем легче он отрывается, тем больше энергия реакции окисления.
Совершенно иначе обстоит дело у элементов с 18-электронной оболочкой. Отдавая свои внешние валентные электроны при образовании химических соединений, они не достигают столь желательной 8-электронной оболочки; у этих элементов (Cu, Ag, Au, Zn, Cd, Hg и др.) химическая активность не возрастает, а понижается. (Нахождение в самородном состоянии в ряду Cu-Ag-Au возрастает с порядковым номером элемента).
У элементов, присоединяющих электроны с образованием анионов с 8-электронными оболочками (F, Cl, Br, J, S, Se, Te), химическая активность (в отличие от Li, Na, K, Rb, Cs) убывает с увеличением порядкового номера из-за экранирующего действия электронных слоев, располагающихся между ядром, притягивающим присоединяющийся электрон (хотя имеющиеся электроны и компенсируют полностью его заряд). Поэтому интенсивность реакции соединения с водородом убывает от фтора к йоду и от серы к теллуру.
Что же касается окислительных реакций в том же ряду, то фтор окислов практически не образует (F2O очень нестойкое соединение), кислородные кислоты хлора (HClO3 и HClO4 и др.) значительно менее стойки, чем соответствующие соединения иода. Кислородные соли хлора в минеральном мире неизвестны, а кислородные соединения йода представлены лаутаритом Ca(JO3)2, беллинджеритом 3Cu(JO3)2 2h3O, шварцем-бергитом Pb(JO 43 0)2×6PbO×PbCl2.
Устойчивость высших окислов в гомологических рядах V, Nb, Ta; Cr, Mo, W; Mn, Tc?, Re увеличивается с порядковым номером (или, что то же самое, с увеличением атомного веса). Так, ванадий в эндогенных минералах и горных породах присутствует только в виде трехвалентного соединения и только в зоне гипергенеза встречается в виде четырех- и пятивалентных соединений; хром обычно встречается только в виде трехвалентных соединений и очень редки в природе минералы шестивалентного хрома (крокоит PbCrO4).
Соединения шестивалентного молибдена типичны для зоны окисления, но и в эндогенных условиях он встречается, хотя и редко, в виде молибдошеелита Сa(Mo,W)O4 или даже повелита CaMoO4. Наконец, вольфрам и в эндогенных, и в экзогенных условиях встречается в виде шестивалентного (вольфрамит и шеелит) и очень редко в виде четырехвалентного (тунгстенит WS2). Если марганец в природе известен в виде двух-, трех- и четырехвалентных соединений, то рений, видимо, существует в виде четырех-шести- и семивалентных соединений.
Для некоторых гомологических рядов элементов, образующих ионы с 18-электронной оболочкой, наблюдается обратная зависимость: галлий встречается в виде трехвалентных соединений, а таллий почти исключительно в виде одновалентных; олово - в основном в виде четырехвалентных соединений, а свинец - в виде двухвалентных и только очень редко в зоне окисления в виде четырехвалентного свинца (платнерита). Устойчивость пятивалентных соединений убывает от мышьяка к сурьме и висмуту.
Необходимо коснуться и некоторых аномальных особенностей в химических свойствах элементов.
В ряду таллий-свинец-висмут валентности элементов (Tl+, Pb2+, Bi3+) не отвечают номеру периодической системы на две единицы, иначе говоря, в валентностях этих элементов участвуют только электроны подгруппы р серии Р, а два электрона подгруппы s в реакциях не участвуют, образуя слои из двух электронов, как бы (в грубых чертах) имитируя гелиевую электронную оболочку. Однако эта имитация гелиевой оболочки все-таки сказывается на химических свойствах таллия, свинца и висмута. Она проявляется и в том, что одновалентный таллий сходен по своим свойствам со щелочными металлами (растворимая гидроокись) и в полевых шпатах, слюдах и карналлите таллий изоморфно замещает калий).
Свинец по многим своим свойствам сходен с кальцием. Трудная растворимость сульфата, изоморфизм свинца с барием, стронцием и кальцием - все это делает Pb2+ сходным с Са2+.
Наконец, трехвалентный висмут по характеру своей гидроокиси и фосфата имеет очень отдаленное свойство с некоторыми свойствами скандия.
Вторая аномалия в химических свойствах элементов заключается в том, что некоторые свойства лития, бериллия, бора сходны с таковыми магния, алюминия и кремния, т.е. элементов, имеющих на единицу большую валентность. Это проявляется, например, в том, что литий подобно магнию, образует трудно растворимые фтористую, углекислую и фосфорнокислую соли.
Бериллий, подобно алюминию, образует студенистую гидроокись Ве(ОН)2, сходную с Al(ОН)3, и подобно последней растворяется в едких щелочах, образуя, например, К2ВеО2, сходный с алюминатом К3AlО3. Бериллий образует очень стойкие фторо-бериллаты типа Na2BeF4подобно алюминию Na3AlF6. В ряде силикатов бериллий играет роль, сходную с алюминием. Бор в отличие от всех остальных элементов своей группы периодической системы образует очень слабую борную кислоту, по ряду свойств сходную с кремниевой кислотой. Подобно кремневой кислоте, образующей поликремневые кислоты: авогардит KBF4 встречается, как и гиератит K2SiF6, в возгонах вулканов. Бороводород ВН3 очень напоминает собой кремневодород Sih5, а элементарный бор - элементарный кремний.
Такая кажущаяся "сдвинутость" элементов в периодической системе на одно место вправо обусловлена тем, что литий, бериллий и бор обладают сравнительно очень простым строением своего атома и два s-электрона серии К хотя и не участвуют в валентности, но влияют на свойства этих легких элементов как один дополнительно отданный электрон или же заряд ядра, скомпенсированный только двумя электронами, оказывает влияние на химические свойства ионов Li+, Be2+, B3+, как бы придавая им один дополнительный положительный заряд и тем самым делая их сходными с Mg2+, Al3+, Si4+. Наконец, что касается частных аномалий, то обращает на себя внимание нахождение молибдена в эндогенных рудах и горных породах в виде сульфида (молибденита), в то время как его ближайшие аналоги хром и вольфрам в этих же условиях представлены кислородными соединениями, в основном хромитом и вольфрамитом.
В противоположность молибдену олово имеет явно выраженную склонность к образованию кислородного соединения - касситерита SnО2, хотя свинец и стоящие справа и слева олова индий и сурьма являются типичными сульфидными элементами (для германия в более или менее равной степени характерна его форма нахождения в виде как сернистых, так и окисных соединений).
biofile.ru
Видеоматериалы
Опыт пилотных регионов, где соцнормы на электроэнергию уже введены, показывает: граждане платить стали меньше
Подробнее...С начала года из ветхого и аварийного жилья в республике были переселены десятки семей
Подробнее...Более 10-ти миллионов рублей направлено на капитальный ремонт многоквартирных домов в Лескенском районе
Подробнее...Актуальные темы
ОТЧЕТ о деятельности министерства энергетики, ЖКХ и тарифной политики Кабардино-Балкарской Республики в сфере государственного регулирования и контроля цен и тарифов в 2012 году и об основных задачах на 2013 год
Подробнее...Предложения организаций, осуществляющих регулируемую деятельность о размере подлежащих государственному регулированию цен (тарифов) на 2013 год
Подробнее...
КОНТАКТЫ
360051, КБР, г. Нальчик
ул. Горького, 4
тел: 8 (8662) 40-93-82
факс: 8 (8662) 47-31-81
e-mail:
Этот адрес электронной почты защищен от спам-ботов. У вас должен быть включен JavaScript для просмотра.