Ткани организма, как проводники электричества второго рода. Жидкости и ткани организма как проводники электричества второго рода
Электрическая проводимость растворов. Жидкости и ткани организма, как проводники электричества второго рода.
Под прохождением электрического тока через вещество подразумевают направленное движение (перенос) электрических зарядов. В зависимости от природы их носителя различают проводники первого рода и проводники второго рода.
В проводниках первого рода перенос электрического заряда осуществляется за счет направленного движения электронов. К ним относятся главным образом сплавы металлов, металлы и их расплавы.
В проводниках второго рода перенос электрического заряда осуществляется за счет направленного движения ионов. К ним относятся все электролиты. Причем в большинстве случаев используются растворы или расплавы данных соединений, так как именно в таких системах за счет действия растворителя или высокой температуры образуются в достаточных количествах свободные ионы, способные перемещаться под действием внешнего электрического поля.
Способность вещества проводить электрический ток количественно характеризуется электропроводностью L, которую можно предсказать как величину, обратную сопротивлению проводника R:
где ρ – удельное сопротивление; - удельная электрическая проводимость; S – площадь сечения проводника; l – длина проводника.
Электрическая проводимость в растворах электролита зависит от числа ионов в объёме раствора между электродами и скорости их движения.
Для оценки проводимости растворов и влияния на неё различных факторов применяют две величины: удельную (Χ) и молярную (λ) электрическую проводимость.
Удельной электрической проводимостью (Χ) называют электропроводность раствора, находящегося между параллельными электродами площадью 1 см2, расположенными на расстоянии 1 см (измеряется в См·см-1 или См·м-1).Удельная электрическая проводимость раствора электролита зависит от природы электролита, концентрации раствора и температуры.
Молярная электрическая проводимость – мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при данной концентрации.
Молярная электрическая проводимость равна электрической проводимости такого объёма (V,см3) раствора, в котором содержится 1 моль растворённого электролита, причём электроды расположены на расстоянии 1 см друг от друга.
Из определения удельной и молярной электрических проводимостей следует, что они связаны соотношением:
где С – концентрация, моль/дм3; λ – молярная электрическая проводимость, См·см2/моль; Χ – удельная электрическая проводимость, См/см.
Молярная электрическая проводимость слабых электролитов меньше, чем сильных; так как даже при низких концентрациях степень диссоциации слабых электролитов мала (α‹1). Следовательно, несмотря на то, что в объёме раствора, заключённого между электродами, содержится 1 моль электролита, переносчиков электрического тока – ионов в данном объёме меньше, чем в растворе сильного электролита. Повышение молярной электрической проводимости слабых электролитов при разбавлении растворов связано с увеличением степени диссоциации.
Для слабых электролитов отношение молярной электропроводности раствора при данном разбавлении (λ) к молярной электропроводности при бесконечно большом разбавлении (λº) характеризует истинную степень электролитической диссоциации. Степень диссоциации электролита в растворе заданной концентрации можно рассчитать, измерив молярную электрическую проводимость этого раствора и зная λº.
У слабых электролитов с разбавлением раствора увеличивается степень электролитической диссоциации и молярная электропроводность; константа же диссоциации при неизменной температуре остаётся постоянной величиной (закон разбавления Оствальда). Константа диссоциации Кдис, α, λ и концентрация (разбавление) подобных растворов связаны между собою следующими уравнениями:
Кдис =
Кдис =
или
Кдис = ,
где V=1/C – разбавление раствора, л/г-экв.
Для сильных электролитов, диссоциирующих полностью (α=1),
Уменьшение молярной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций у сильных электролитов связано только с уменьшением скоростей движения ионов. Сильные электролиты не подчиняются закону разбавления.
Биоткани — это проводники II рода.
При наличии разницы электрического напряжения на двух токах металлического проводника электрический ток пойдет в нем от точки, имеющей большой потенциал, к точке с меньшим потенциалом (ток течет). Если эта разница напряжения между точками будет поддерживаться некоторое время, то ток получит одно направление в течение всего этого времени, т.е. по проводнику установится течение постоянного тока. Он будет иметь и постоянную силу в случае, когда разница потенциалов, т.е. электродвижущая сила (напряжение), не будет изменяться.
При прохождении постоянного тока через тело человека возникает постоянное электрическое иоле, т.е. человеческий организм становится сложным электрическим проводником. Организм в целом, а также его различные ткани представляют собой сложный электролитический раствор. Величина электропроводности зависит от содержания в тканях жидкости.
Жидкие среды организма: кровь, лимфа, моча, спинномозговая жидкость — обладают наибольшей электропроводностью.
К хорошим проводникам также относятся внутренние органы и мышечная ткань, а к плохим - кость, жировая ткань. Большим сопротивлением проводимости обладает кожа, особенно ее роговой слой. В коже ток проходит в основном через протоки потовых и сальных желез, межклеточные пространства эпидермиса.
Ионное произведение воды.
Вода – слабый электролит, она диссоциирует в незначительной степени (при температуре 298 K на ионы распадается 1 молекула из 5,5х108). Однако образующиеся при диссоциации воды ионы играют исключительно важную роль в биологических процессах. Поэтому необходимо уметь количественно выражать меру диссоциации воды. Выражение для константы равновесия диссоциации воды:
При температуре 298 К эта величина равна 1,8 х 10-16 моль/л. Так как диссоциации воды мала, её концентрацию можно считать постоянной и рассчитать по формуле:
[Н2О] = m /Mr
где: m – масса 1л воды, Mr – её молярная масса. Подставив числовые значения этих величин в уравнение 1.2, получаем: 1000 г/л / 18 г/моль = 55,5 моль/л. Умножив обе части уравнения 1.1 на концентрацию воды, получаем:
Кравн.[Н2О] = [Н+][ОН-]
и, подставляя числовые значения, получаем:
К w = 1,8 х 10-16 моль/л х 55,5 моль/л = 10-14 моль2/л2,
где К w – ионное произведение воды. С ростом температуры увеличивается число диссоциациировавших молекул воды и, следовательно, увеличивается ионное произведение воды.
Если [Н+] = [ОН-], то раствор имеет нейтральную реакцию, если преобладают ионы Н+, то раствор кислый, если ОН- – щелочной.
В 1909 г. Зёренсен предложил использовать для выражения концентрации протонов водородный показатель – рН, равный десятичному логарифму концентрации протонов, взятому с противоположным знаком:
pH = -lg [Н+]
Так как ионное произведение воды для данной температуры – величина постоянная, увеличение концентрации одного из ионов влечёт снижение концентрации другого. Зная рН, легко вычислить рОН: рОН = 14 – рН и наоборот.
pH может принимать значения от 1 до 14. Среду со значением рН от 0 до 3 называют сильно кислой, 3-6 – кислой, 7 – нейтральной, 8-10 – слабо щелочной, 11-14 – сильно щелочной.
Биологическое значение постоянства рН состоит в том, что ферменты, контролирующие скорости протекания химических реакций в организме, будучи белками, очень чувствительны к колебаниям рН. Даже незначительный сдвиг реакции среды от оптимума для данного фермента приводит к существенному снижению его биологической активности, а, следовательно, к серьёзным метаболическим нарушениям. Вот почему значения водородного показателя среды поддерживается в узких рамках.
Надо отметить, что сами значения рН в разных частях организма могут существенно отличаться. Так, рН желудочного сока составляет 1,5-2,3; слюны – 6,8; мочи – 5,0-6,5; дуоденального содержимого – 7,6-7,8; крови – 7,36-7,42.
Поддержание оптимального значения реакции среды в различных частях организма достигается благодаря согласованной работе буферных систем и органов выделения.
9. Методы определения рН растворов. Индикаторы.
pH можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
1. Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы - органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах - либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы. Их преимуществом является дешевизна, быстрота и наглядность исследования.
Таблица 1
student2.ru
Ткани организма, как проводники электричества второго рода
Под прохождением электрического тока через вещество подразумевают направленное движение (перенос) электрических зарядов. В зависимости от природы их носителя различают проводники первого рода и проводники второго рода.
В проводниках первого рода перенос электрического заряда осуществляется за счет направленного движения электронов. К ним относятся главным образом сплавы металлов, металлы и их расплавы.
В проводниках второго рода перенос электрического заряда осуществляется за счет направленного движения ионов. К ним относятся все электролиты. Причем в большинстве случаев используются растворы или расплавы данных соединений, так как именно в таких системах за счет действия растворителя или высокой температуры образуются в достаточных количествах свободные ионы, способные перемещаться под действием внешнего электрического поля.
Способность вещества проводить электрический ток количественно характеризуется электропроводностью L, которую можно предсказать как величину, обратную сопротивлению проводника R:
где ρ – удельное сопротивление; - удельная электрическая проводимость; S – площадь сечения проводника; l – длина проводника.
Электрическая проводимость в растворах электролита зависит от числа ионов в объёме раствора между электродами и скорости их движения.
Для оценки проводимости растворов и влияния на неё различных факторов применяют две величины: удельную (Χ) и молярную (λ) электрическую проводимость.
Удельной электрической проводимостью (Χ) называют электропроводность раствора, находящегося между параллельными электродами площадью 1 см2, расположенными на расстоянии 1 см (измеряется в См×см-1 или См×м-1).Удельная электрическая проводимость раствора электролита зависит от природы электролита, концентрации раствора и температуры.
Молярная электрическая проводимость – мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при данной концентрации.
Молярная электрическая проводимость равна электрической проводимости такого объёма (V,см3) раствора, в котором содержится 1 моль растворённого электролита, причём электроды расположены на расстоянии 1 см друг от друга.
Из определения удельной и молярной электрических проводимостей следует, что они связаны соотношением:
где С – концентрация, моль/дм3; λ – молярная электрическая проводимость, См×см2/моль; Χ – удельная электрическая проводимость, См/см.
Молярная электрическая проводимость слабых электролитов меньше, чем сильных; так как даже при низких концентрациях степень диссоциации слабых электролитов мала (α‹1). Следовательно, несмотря на то, что в объёме раствора, заключённого между электродами, содержится 1 моль электролита, переносчиков электрического тока – ионов в данном объёме меньше, чем в растворе сильного электролита. Повышение молярной электрической проводимости слабых электролитов при разбавлении растворов связано с увеличением степени диссоциации.
Для слабых электролитов отношение молярной электропроводности раствора при данном разбавлении (λ) к молярной электропроводности при бесконечно большом разбавлении (λº) характеризует истинную степень электролитической диссоциации. Степень диссоциации электролита в растворе заданной концентрации можно рассчитать, измерив молярную электрическую проводимость этого раствора и зная λº.
У слабых электролитов с разбавлением раствора увеличивается степень электролитической диссоциации и молярная электропроводность; константа же диссоциации при неизменной температуре остаётся постоянной величиной (закон разбавления Оствальда). Константа диссоциации Кдис, α, λ и концентрация (разбавление) подобных растворов связаны между собою следующими уравнениями:
Кдис =
Кдис =
или
Кдис = ,
где V=1/C – разбавление раствора, л/г-экв.
Для сильных электролитов, диссоциирующих полностью (α=1),
Уменьшение молярной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций у сильных электролитов связано только с уменьшением скоростей движения ионов. Сильные электролиты не подчиняются закону разбавления.
Биоткани — это проводники II рода.
При прохождении постоянного тока через тело человека возникает постоянное электрическое поле, т.е. человеческий организм становится сложным электрическим проводником. Организм в целом, а также его различные ткани представляют собой сложный электролитический раствор. Величина электропроводности зависит от содержания в тканях жидкости.
Жидкие среды организма: кровь, лимфа, моча, спинномозговая жидкость - обладают наибольшей электропроводностью.
К хорошим проводникам также относятся внутренние органы и мышечная ткань, а к плохим - кость, жировая ткань. Большим сопротивлением проводимости обладает кожа, особенно ее роговой слой. В коже ток проходит в основном через протоки потовых и сальных желез, межклеточные пространства эпидермиса.
Ионное произведение воды
Вода – слабый электролит, она диссоциирует в незначительной степени (при температуре 298 K на ионы распадается 1 молекула из 5,5×108). Однако образующиеся при диссоциации воды ионы играют исключительно важную роль в биологических процессах. Поэтому необходимо уметь количественно выражать меру диссоциации воды. Выражение для константы равновесия диссоциации воды:
(1.1)
При температуре 298 К эта величина равна 1,8×10-16 моль/л. Так как диссоциации воды мала, её концентрацию можно считать постоянной и рассчитать по формуле:
[Н2О] = m /Mr (1.2)
где: m – масса 1л воды, Mr – её молярная масса. Подставив числовые значения этих величин в уравнение 1.2, получаем: 1000 г/л / 18 г/моль = 55,5 моль/л. Умножив обе части уравнения 1.1 на концентрацию воды, получаем:
Кравн×[Н2О] = [Н+][ОН-] (1.3)
и, подставляя числовые значения в уравнение 1.3, получаем:
К =1,8×10-16 моль/л×55,5 моль/л = 10-14 моль2/л2,
где Кw – ионное произведение воды. С ростом температуры увеличивается число диссоциациировавших молекул воды и, следовательно, увеличивается ионное произведение воды.
Если [Н+] = [ОН-], то раствор имеет нейтральную реакцию, если преобладают ионы Н+, то раствор кислый, если ОН- – щелочной.
В 1909 г. Зёренсен предложил использовать для выражения концентрации протонов водородный показатель – рН, равный десятичному логарифму концентрации протонов, взятому с противоположным знаком:
pH = -lg [Н+]
Так как ионное произведение воды для данной температуры – величина постоянная, увеличение концентрации одного из ионов влечёт снижение концентрации другого.
Зная рН, легко вычислить рОН: рОН = 14 – рН и наоборот.
pH может принимать значения от 1 до 14. Среду со значением рН от 0 до 3 называют сильно кислой, 3-6 – кислой, 7 – нейтральной, 8-10 – слабо щелочной, 11-14 – сильно щелочной.
Биологическое значение постоянства рН состоит в том, что ферменты, контролирующие скорости протекания химических реакций в организме, будучи белками, очень чувствительны к колебаниям рН. Даже незначительный сдвиг реакции среды от оптимума для данного фермента приводит к существенному снижению его биологической активности, а, следовательно, к серьёзным метаболическим нарушениям. Вот почему значения водородного показателя среды поддерживается в узких рамках.
Надо отметить, что сами значения рН в разных частях организма могут существенно отличаться. Так, рН желудочного сока составляет 1,5-2,3; слюны – 6,8; мочи – 5,0-6,5; дуоденального содержимого – 7,6-7,8; крови – 7,36-7,42.
Поддержание оптимального значения реакции среды в различных частях организма достигается благодаря согласованной работе буферных систем и органов выделения.
student2.ru
Ткани организма, как проводники электричества второго рода
Под прохождением электрического тока через вещество подразумевают направленное движение (перенос) электрических зарядов. В зависимости от природы их носителя различают проводники первого рода и проводники второго рода.
В проводниках первого рода перенос электрического заряда осуществляется за счет направленного движения электронов. К ним относятся главным образом сплавы металлов, металлы и их расплавы.
В проводниках второго рода перенос электрического заряда осуществляется за счет направленного движения ионов. К ним относятся все электролиты. Причем в большинстве случаев используются растворы или расплавы данных соединений, так как именно в таких системах за счет действия растворителя или высокой температуры образуются в достаточных количествах свободные ионы, способные перемещаться под действием внешнего электрического поля.
Способность вещества проводить электрический ток количественно характеризуется электропроводностью L, которую можно предсказать как величину, обратную сопротивлению проводника R:
где ρ – удельное сопротивление; - удельная электрическая проводимость; S – площадь сечения проводника; l – длина проводника.
Электрическая проводимость в растворах электролита зависит от числа ионов в объёме раствора между электродами и скорости их движения.
Для оценки проводимости растворов и влияния на неё различных факторов применяют две величины: удельную (Χ) и молярную (λ) электрическую проводимость.
Удельной электрической проводимостью (Χ) называют электропроводность раствора, находящегося между параллельными электродами площадью 1 см2, расположенными на расстоянии 1 см (измеряется в См×см-1 или См×м-1).Удельная электрическая проводимость раствора электролита зависит от природы электролита, концентрации раствора и температуры.
Молярная электрическая проводимость – мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при данной концентрации.
Молярная электрическая проводимость равна электрической проводимости такого объёма (V,см3) раствора, в котором содержится 1 моль растворённого электролита, причём электроды расположены на расстоянии 1 см друг от друга.
Из определения удельной и молярной электрических проводимостей следует, что они связаны соотношением:
где С – концентрация, моль/дм3; λ – молярная электрическая проводимость, См×см2/моль; Χ – удельная электрическая проводимость, См/см.
Молярная электрическая проводимость слабых электролитов меньше, чем сильных; так как даже при низких концентрациях степень диссоциации слабых электролитов мала (α‹1). Следовательно, несмотря на то, что в объёме раствора, заключённого между электродами, содержится 1 моль электролита, переносчиков электрического тока – ионов в данном объёме меньше, чем в растворе сильного электролита. Повышение молярной электрической проводимости слабых электролитов при разбавлении растворов связано с увеличением степени диссоциации.
Для слабых электролитов отношение молярной электропроводности раствора при данном разбавлении (λ) к молярной электропроводности при бесконечно большом разбавлении (λº) характеризует истинную степень электролитической диссоциации. Степень диссоциации электролита в растворе заданной концентрации можно рассчитать, измерив молярную электрическую проводимость этого раствора и зная λº.
У слабых электролитов с разбавлением раствора увеличивается степень электролитической диссоциации и молярная электропроводность; константа же диссоциации при неизменной температуре остаётся постоянной величиной (закон разбавления Оствальда). Константа диссоциации Кдис, α, λ и концентрация (разбавление) подобных растворов связаны между собою следующими уравнениями:
Кдис =
Кдис =
или
Кдис = ,
где V=1/C – разбавление раствора, л/г-экв.
Для сильных электролитов, диссоциирующих полностью (α=1),
Уменьшение молярной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций у сильных электролитов связано только с уменьшением скоростей движения ионов. Сильные электролиты не подчиняются закону разбавления.
Биоткани — это проводники II рода.
При прохождении постоянного тока через тело человека возникает постоянное электрическое поле, т.е. человеческий организм становится сложным электрическим проводником. Организм в целом, а также его различные ткани представляют собой сложный электролитический раствор. Величина электропроводности зависит от содержания в тканях жидкости.
Жидкие среды организма: кровь, лимфа, моча, спинномозговая жидкость - обладают наибольшей электропроводностью.
К хорошим проводникам также относятся внутренние органы и мышечная ткань, а к плохим - кость, жировая ткань. Большим сопротивлением проводимости обладает кожа, особенно ее роговой слой. В коже ток проходит в основном через протоки потовых и сальных желез, межклеточные пространства эпидермиса.
student2.ru
Ткани организма, как проводники электричества второго рода
Под прохождением электрического тока через вещество подразумевают направленное движение (перенос) электрических зарядов. В зависимости от природы их носителя различают проводники первого рода и проводники второго рода.
В проводниках первого рода переносэлектрического заряда осуществляется за счет направленного движения электронов.К ним относятся главным образом сплавы металлов, металлы и их расплавы.
В проводниках второго родаперенос электрического заряда осуществляется за счет направленного движения ионов . К ним относятся все электролиты. Причем в большинстве случаев используются растворы или расплавы данных соединений, так как именно в таких системах за счет действия растворителя или высокой температуры образуются в достаточных количествах свободные ионы, способные перемещаться под действием внешнего электрического поля.
Способность вещества проводить электрический ток количественно характеризуется электропроводностью L, которую можно предсказать как величину, обратную сопротивлению проводника R:
где ρ – удельное сопротивление; - удельная электрическая проводимость; S – площадь сечения проводника; l – длина проводника.
Электрическая проводимость в растворах электролита зависит от числа ионов в объёме раствора между электродами и скорости их движения.
Для оценки проводимости растворов и влияния на неё различных факторов применяют две величины: удельную (Χ) и молярную (λ) электрическую проводимость.
Удельной электрической проводимостью (Χ)называют электропроводность раствора, находящегося между параллельными электродами площадью 1 см2, расположенными на расстоянии 1 см (измеряется в См×см-1 или См×м-1).Удельная электрическая проводимость раствора электролита зависит от природы электролита, концентрации раствора и температуры.
Молярная электрическая проводимость– мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при данной концентрации.
Молярная электрическая проводимость равна электрической проводимости такого объёма (V,см3) раствора, в котором содержится 1 моль растворённого электролита, причём электроды расположены на расстоянии 1 см друг от друга.
Из определения удельной и молярной электрических проводимостей следует, что они связаны соотношением:
где С – концентрация, моль/дм3; λ – молярная электрическая проводимость, См×см2/моль; Χ – удельная электрическая проводимость, См/см.
Молярная электрическая проводимость слабых электролитов меньше, чем сильных; так как даже при низких концентрациях степень диссоциации слабых электролитов мала (α‹1). Следовательно, несмотря на то, что в объёме раствора, заключённого между электродами, содержится 1 моль электролита, переносчиков электрического тока – ионов в данном объёме меньше, чем в растворе сильного электролита. Повышение молярной электрической проводимости слабых электролитов при разбавлении растворов связано с увеличением степени диссоциации.
Для слабых электролитов отношение молярной электропроводности раствора при данном разбавлении (λ) к молярной электропроводности при бесконечно большом разбавлении (λº) характеризует истинную степень электролитической диссоциации. Степень диссоциации электролита в растворе заданной концентрации можно рассчитать, измерив молярную электрическую проводимость этого раствора и зная λº.
У слабых электролитов с разбавлением раствора увеличивается степень электролитической диссоциации и молярная электропроводность; константа же диссоциации при неизменной температуре остаётся постоянной величиной (закон разбавления Оствальда). Константа диссоциации Кдис, α, λ и концентрация (разбавление) подобных растворов связаны между собою следующими уравнениями:
Кдис =
Кдис =
или
Кдис = ,
где V=1/C – разбавление раствора, л/г-экв.
Для сильных электролитов, диссоциирующих полностью (α=1),
Уменьшение молярной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций у сильных электролитов связано только с уменьшением скоростей движения ионов. Сильные электролиты не подчиняются закону разбавления.
Биоткани — это проводники II рода.
При прохождении постоянного тока через тело человека возникает постоянное электрическое поле, т.е. человеческий организм становится сложным электрическим проводником. Организм в целом, а также его различные ткани представляют собой сложный электролитический раствор. Величина электропроводности зависит от содержания в тканях жидкости.
Жидкие среды организма: кровь, лимфа, моча, спинномозговая жидкость - обладают наибольшей электропроводностью.
К хорошим проводникам также относятся внутренние органы и мышечная ткань, а к плохим - кость, жировая ткань. Большим сопротивлением проводимости обладает кожа, особенно ее роговой слой. В коже ток проходит в основном через протоки потовых и сальных желез, межклеточные пространства эпидермиса.
Ионное произведение воды
Вода – слабый электролит, она диссоциирует в незначительной степени (при температуре 298 K на ионы распадается 1 молекула из 5,5×108). Однако образующиеся при диссоциации воды ионы играют исключительно важную роль в биологических процессах. Поэтому необходимо уметь количественно выражать меру диссоциации воды. Выражение для константы равновесия диссоциации воды:
(1.1)
При температуре 298 К эта величина равна 1,8×10-16 моль/л. Так как диссоциации воды мала, её концентрацию можно считать постоянной и рассчитать по формуле:
[Н2О] = m /Mr (1.2)
где: m – масса 1л воды, Mr – её молярная масса. Подставив числовые значения этих величин в уравнение 1.2, получаем: 1000 г/л / 18 г/моль = 55,5 моль/л. Умножив обе части уравнения 1.1 на концентрацию воды, получаем:
Кравн×[Н2О] = [Н+][ОН-] (1.3)
и, подставляя числовые значения в уравнение 1.3, получаем:
К =1,8×10-16 моль/л×55,5 моль/л = 10-14 моль2/л2,
где Кw – ионное произведение воды. С ростом температуры увеличивается число диссоциациировавших молекул воды и, следовательно, увеличивается ионное произведение воды.
Если [Н+] = [ОН-], то раствор имеет нейтральную реакцию, если преобладают ионы Н+, то раствор кислый, если ОН- – щелочной.
В 1909 г. Зёренсен предложил использовать для выражения концентрации протонов водородный показатель – рН, равный десятичному логарифму концентрации протонов, взятому с противоположным знаком:
pH = -lg [Н+]
Так как ионное произведение воды для данной температуры – величина постоянная, увеличение концентрации одного из ионов влечёт снижение концентрации другого.
Зная рН, легко вычислить рОН: рОН = 14 – рН и наоборот.
pH может принимать значения от 1 до 14. Среду со значением рН от 0 до 3 называют сильно кислой, 3-6 – кислой, 7 – нейтральной, 8-10 – слабо щелочной, 11-14 – сильно щелочной.
Биологическое значение постоянства рН состоит в том, что ферменты, контролирующие скорости протекания химических реакций в организме, будучи белками, очень чувствительны к колебаниям рН. Даже незначительный сдвиг реакции среды от оптимума для данного фермента приводит к существенному снижению его биологической активности, а, следовательно, к серьёзным метаболическим нарушениям. Вот почему значения водородного показателя среды поддерживается в узких рамках.
Надо отметить, что сами значения рН в разных частях организма могут существенно отличаться. Так, рН желудочного сока составляет 1,5-2,3; слюны – 6,8; мочи – 5,0-6,5; дуоденального содержимого – 7,6-7,8; крови – 7,36-7,42.
Поддержание оптимального значения реакции среды в различных частях организма достигается благодаря согласованной работе буферных систем и органов выделения.
studlib.info
Ткани организма, как проводники электричества второго рода
Под прохождением электрического тока через вещество подразумевают направленное движение (перенос) электрических зарядов. В зависимости от природы их носителя различают проводники первого рода и проводники второго рода.
В проводниках первого рода переносэлектрического заряда осуществляется за счет направленного движения электронов.К ним относятся главным образом сплавы металлов, металлы и их расплавы.
В проводниках второго родаперенос электрического заряда осуществляется за счет направленного движения ионов . К ним относятся все электролиты. Причем в большинстве случаев используются растворы или расплавы данных соединений, так как именно в таких системах за счет действия растворителя или высокой температуры образуются в достаточных количествах свободные ионы, способные перемещаться под действием внешнего электрического поля.
Способность вещества проводить электрический ток количественно характеризуется электропроводностью L, которую можно предсказать как величину, обратную сопротивлению проводника R:
где ρ – удельное сопротивление; - удельная электрическая проводимость; S – площадь сечения проводника; l – длина проводника.
Электрическая проводимость в растворах электролита зависит от числа ионов в объёме раствора между электродами и скорости их движения.
Для оценки проводимости растворов и влияния на неё различных факторов применяют две величины: удельную (Χ) и молярную (λ) электрическую проводимость.
Удельной электрической проводимостью (Χ)называют электропроводность раствора, находящегося между параллельными электродами площадью 1 см2, расположенными на расстоянии 1 см (измеряется в См×см-1 или См×м-1).Удельная электрическая проводимость раствора электролита зависит от природы электролита, концентрации раствора и температуры.
Молярная электрическая проводимость– мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при данной концентрации.
Молярная электрическая проводимость равна электрической проводимости такого объёма (V,см3) раствора, в котором содержится 1 моль растворённого электролита, причём электроды расположены на расстоянии 1 см друг от друга.
Из определения удельной и молярной электрических проводимостей следует, что они связаны соотношением:
где С – концентрация, моль/дм3; λ – молярная электрическая проводимость, См×см2/моль; Χ – удельная электрическая проводимость, См/см.
Молярная электрическая проводимость слабых электролитов меньше, чем сильных; так как даже при низких концентрациях степень диссоциации слабых электролитов мала (α‹1). Следовательно, несмотря на то, что в объёме раствора, заключённого между электродами, содержится 1 моль электролита, переносчиков электрического тока – ионов в данном объёме меньше, чем в растворе сильного электролита. Повышение молярной электрической проводимости слабых электролитов при разбавлении растворов связано с увеличением степени диссоциации.
Для слабых электролитов отношение молярной электропроводности раствора при данном разбавлении (λ) к молярной электропроводности при бесконечно большом разбавлении (λº) характеризует истинную степень электролитической диссоциации. Степень диссоциации электролита в растворе заданной концентрации можно рассчитать, измерив молярную электрическую проводимость этого раствора и зная λº.
У слабых электролитов с разбавлением раствора увеличивается степень электролитической диссоциации и молярная электропроводность; константа же диссоциации при неизменной температуре остаётся постоянной величиной (закон разбавления Оствальда). Константа диссоциации Кдис, α, λ и концентрация (разбавление) подобных растворов связаны между собою следующими уравнениями:
Кдис =
Кдис =
или
Кдис = ,
где V=1/C – разбавление раствора, л/г-экв.
Для сильных электролитов, диссоциирующих полностью (α=1),
Уменьшение молярной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций у сильных электролитов связано только с уменьшением скоростей движения ионов. Сильные электролиты не подчиняются закону разбавления.
Биоткани — это проводники II рода.
При прохождении постоянного тока через тело человека возникает постоянное электрическое поле, т.е. человеческий организм становится сложным электрическим проводником. Организм в целом, а также его различные ткани представляют собой сложный электролитический раствор. Величина электропроводности зависит от содержания в тканях жидкости.
Жидкие среды организма: кровь, лимфа, моча, спинномозговая жидкость - обладают наибольшей электропроводностью.
К хорошим проводникам также относятся внутренние органы и мышечная ткань, а к плохим - кость, жировая ткань. Большим сопротивлением проводимости обладает кожа, особенно ее роговой слой. В коже ток проходит в основном через протоки потовых и сальных желез, межклеточные пространства эпидермиса.
Ионное произведение воды
Вода – слабый электролит, она диссоциирует в незначительной степени (при температуре 298 K на ионы распадается 1 молекула из 5,5×108). Однако образующиеся при диссоциации воды ионы играют исключительно важную роль в биологических процессах. Поэтому необходимо уметь количественно выражать меру диссоциации воды. Выражение для константы равновесия диссоциации воды:
(1.1)
При температуре 298 К эта величина равна 1,8×10-16 моль/л. Так как диссоциации воды мала, её концентрацию можно считать постоянной и рассчитать по формуле:
[Н2О] = m /Mr (1.2)
где: m – масса 1л воды, Mr – её молярная масса. Подставив числовые значения этих величин в уравнение 1.2, получаем: 1000 г/л / 18 г/моль = 55,5 моль/л. Умножив обе части уравнения 1.1 на концентрацию воды, получаем:
Кравн×[Н2О] = [Н+][ОН-] (1.3)
и, подставляя числовые значения в уравнение 1.3, получаем:
К =1,8×10-16 моль/л×55,5 моль/л = 10-14 моль2/л2,
где Кw – ионное произведение воды. С ростом температуры увеличивается число диссоциациировавших молекул воды и, следовательно, увеличивается ионное произведение воды.
Если [Н+] = [ОН-], то раствор имеет нейтральную реакцию, если преобладают ионы Н+, то раствор кислый, если ОН- – щелочной.
В 1909 г. Зёренсен предложил использовать для выражения концентрации протонов водородный показатель – рН, равный десятичному логарифму концентрации протонов, взятому с противоположным знаком:
pH = -lg [Н+]
Так как ионное произведение воды для данной температуры – величина постоянная, увеличение концентрации одного из ионов влечёт снижение концентрации другого.
Зная рН, легко вычислить рОН: рОН = 14 – рН и наоборот.
pH может принимать значения от 1 до 14. Среду со значением рН от 0 до 3 называют сильно кислой, 3-6 – кислой, 7 – нейтральной, 8-10 – слабо щелочной, 11-14 – сильно щелочной.
Биологическое значение постоянства рН состоит в том, что ферменты, контролирующие скорости протекания химических реакций в организме, будучи белками, очень чувствительны к колебаниям рН. Даже незначительный сдвиг реакции среды от оптимума для данного фермента приводит к существенному снижению его биологической активности, а, следовательно, к серьёзным метаболическим нарушениям. Вот почему значения водородного показателя среды поддерживается в узких рамках.
Надо отметить, что сами значения рН в разных частях организма могут существенно отличаться. Так, рН желудочного сока составляет 1,5-2,3; слюны – 6,8; мочи – 5,0-6,5; дуоденального содержимого – 7,6-7,8; крови – 7,36-7,42.
Поддержание оптимального значения реакции среды в различных частях организма достигается благодаря согласованной работе буферных систем и органов выделения.
studlib.info
Ткани организма, как проводники электричества второго рода
Под прохождением электрического тока через вещество подразумевают направленное движение (перенос) электрических зарядов. В зависимости от природы их носителя различают проводники первого рода и проводники второго рода.
В проводниках первого рода перенос электрического заряда осуществляется за счет направленного движения электронов. К ним относятся главным образом сплавы металлов, металлы и их расплавы.
В проводниках второго рода перенос электрического заряда осуществляется за счет направленного движения ионов. К ним относятся все электролиты. Причем в большинстве случаев используются растворы или расплавы данных соединений, так как именно в таких системах за счет действия растворителя или высокой температуры образуются в достаточных количествах свободные ионы, способные перемещаться под действием внешнего электрического поля.
Способность вещества проводить электрический ток количественно характеризуется электропроводностью L, которую можно предсказать как величину, обратную сопротивлению проводника R:
где ρ – удельное сопротивление; - удельная электрическая проводимость; S – площадь сечения проводника; l – длина проводника.
Электрическая проводимость в растворах электролита зависит от числа ионов в объёме раствора между электродами и скорости их движения.
Для оценки проводимости растворов и влияния на неё различных факторов применяют две величины: удельную (Χ) и молярную (λ) электрическую проводимость.
Удельной электрической проводимостью (Χ) называют электропроводность раствора, находящегося между параллельными электродами площадью 1 см2, расположенными на расстоянии 1 см (измеряется в См×см-1 или См×м-1).Удельная электрическая проводимость раствора электролита зависит от природы электролита, концентрации раствора и температуры.
Молярная электрическая проводимость – мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при данной концентрации.
Молярная электрическая проводимость равна электрической проводимости такого объёма (V,см3) раствора, в котором содержится 1 моль растворённого электролита, причём электроды расположены на расстоянии 1 см друг от друга.
Из определения удельной и молярной электрических проводимостей следует, что они связаны соотношением:
где С – концентрация, моль/дм3; λ – молярная электрическая проводимость, См×см2/моль; Χ – удельная электрическая проводимость, См/см.
Молярная электрическая проводимость слабых электролитов меньше, чем сильных; так как даже при низких концентрациях степень диссоциации слабых электролитов мала (α‹1). Следовательно, несмотря на то, что в объёме раствора, заключённого между электродами, содержится 1 моль электролита, переносчиков электрического тока – ионов в данном объёме меньше, чем в растворе сильного электролита. Повышение молярной электрической проводимости слабых электролитов при разбавлении растворов связано с увеличением степени диссоциации.
Для слабых электролитов отношение молярной электропроводности раствора при данном разбавлении (λ) к молярной электропроводности при бесконечно большом разбавлении (λº) характеризует истинную степень электролитической диссоциации. Степень диссоциации электролита в растворе заданной концентрации можно рассчитать, измерив молярную электрическую проводимость этого раствора и зная λº.
У слабых электролитов с разбавлением раствора увеличивается степень электролитической диссоциации и молярная электропроводность; константа же диссоциации при неизменной температуре остаётся постоянной величиной (закон разбавления Оствальда). Константа диссоциации Кдис, α, λ и концентрация (разбавление) подобных растворов связаны между собою следующими уравнениями:
Кдис =
Кдис =
или
Кдис = ,
где V=1/C – разбавление раствора, л/г-экв.
Для сильных электролитов, диссоциирующих полностью (α=1),
Уменьшение молярной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций у сильных электролитов связано только с уменьшением скоростей движения ионов. Сильные электролиты не подчиняются закону разбавления.
Биоткани — это проводники II рода.
При прохождении постоянного тока через тело человека возникает постоянное электрическое поле, т.е. человеческий организм становится сложным электрическим проводником. Организм в целом, а также его различные ткани представляют собой сложный электролитический раствор. Величина электропроводности зависит от содержания в тканях жидкости.
Жидкие среды организма: кровь, лимфа, моча, спинномозговая жидкость - обладают наибольшей электропроводностью.
К хорошим проводникам также относятся внутренние органы и мышечная ткань, а к плохим - кость, жировая ткань. Большим сопротивлением проводимости обладает кожа, особенно ее роговой слой. В коже ток проходит в основном через протоки потовых и сальных желез, межклеточные пространства эпидермиса.
Ионное произведение воды
Вода – слабый электролит, она диссоциирует в незначительной степени (при температуре 298 K на ионы распадается 1 молекула из 5,5×108). Однако образующиеся при диссоциации воды ионы играют исключительно важную роль в биологических процессах. Поэтому необходимо уметь количественно выражать меру диссоциации воды. Выражение для константы равновесия диссоциации воды:
(1.1)
При температуре 298 К эта величина равна 1,8×10-16 моль/л. Так как диссоциации воды мала, её концентрацию можно считать постоянной и рассчитать по формуле:
[Н2О] = m /Mr (1.2)
где: m – масса 1л воды, Mr – её молярная масса. Подставив числовые значения этих величин в уравнение 1.2, получаем: 1000 г/л / 18 г/моль = 55,5 моль/л. Умножив обе части уравнения 1.1 на концентрацию воды, получаем:
Кравн×[Н2О] = [Н+][ОН-] (1.3)
и, подставляя числовые значения в уравнение 1.3, получаем:
К =1,8×10-16 моль/л×55,5 моль/л = 10-14 моль2/л2,
где Кw – ионное произведение воды. С ростом температуры увеличивается число диссоциациировавших молекул воды и, следовательно, увеличивается ионное произведение воды.
Если [Н+] = [ОН-], то раствор имеет нейтральную реакцию, если преобладают ионы Н+, то раствор кислый, если ОН- – щелочной.
В 1909 г. Зёренсен предложил использовать для выражения концентрации протонов водородный показатель – рН, равный десятичному логарифму концентрации протонов, взятому с противоположным знаком:
pH = -lg [Н+]
Так как ионное произведение воды для данной температуры – величина постоянная, увеличение концентрации одного из ионов влечёт снижение концентрации другого.
Зная рН, легко вычислить рОН: рОН = 14 – рН и наоборот.
pH может принимать значения от 1 до 14. Среду со значением рН от 0 до 3 называют сильно кислой, 3-6 – кислой, 7 – нейтральной, 8-10 – слабо щелочной, 11-14 – сильно щелочной.
Биологическое значение постоянства рН состоит в том, что ферменты, контролирующие скорости протекания химических реакций в организме, будучи белками, очень чувствительны к колебаниям рН. Даже незначительный сдвиг реакции среды от оптимума для данного фермента приводит к существенному снижению его биологической активности, а, следовательно, к серьёзным метаболическим нарушениям. Вот почему значения водородного показателя среды поддерживается в узких рамках.
Надо отметить, что сами значения рН в разных частях организма могут существенно отличаться. Так, рН желудочного сока составляет 1,5-2,3; слюны – 6,8; мочи – 5,0-6,5; дуоденального содержимого – 7,6-7,8; крови – 7,36-7,42.
Поддержание оптимального значения реакции среды в различных частях организма достигается благодаря согласованной работе буферных систем и органов выделения.
4-i-5.ru
Вода и электрический ток
Жидкости, как и твердые тела, могут быть проводниками и диэлектриками. Растворы и расплавы солей, кислот, оснований являются проводниками электрического тока второго рода. Тип проводимости таких проводников – ионный.
Проводники второго рода – такие проводники, в которых при протекании тока происходят химические процессы.
Описание:
В стакан с водой поместили два электрода, подключенные к источнику тока, в цепи в качестве индикатора тока взяли лампочку. Если замкнуть такую цепь, лампа гореть не будет, что означает отсутствие тока, а это значит, что в цепи есть разрыв, и вода сама по себе ток не проводит.
Но если в стакан добавить некоторое количество NaCl – поваренной соли – и повторить замыкание, то лампочка загорится. Это значит, что в стакане между катодом и анодом начали двигаться свободные носители заряда, в данном случае ионы (рис. 1).
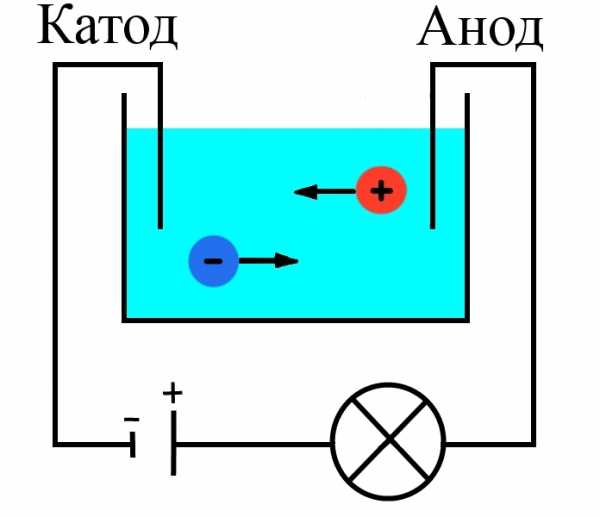
Рисунок 1. Схема опыта
Объяснение:
Откуда во втором случае (в соленой воде) берутся свободные заряды для протекания тока? Дело в том, что вода имеет полярные молекулы (рис. 2).
Рисунок 2. Полярность молекулы воды
При добавлении в воду соли молекулы воды ориентируются таким образом, что их отрицательные полюса находятся возле натрия, положительные – возле хлора. В результате взаимодействий между зарядами молекулы воды разрывают молекулы соли на пары разноименных ионов. Ион натрия имеет положительный заряд, ион хлора – отрицательный (рис. 3). Именно эти ионы и будут двигаться между электродами под действием электрического поля.
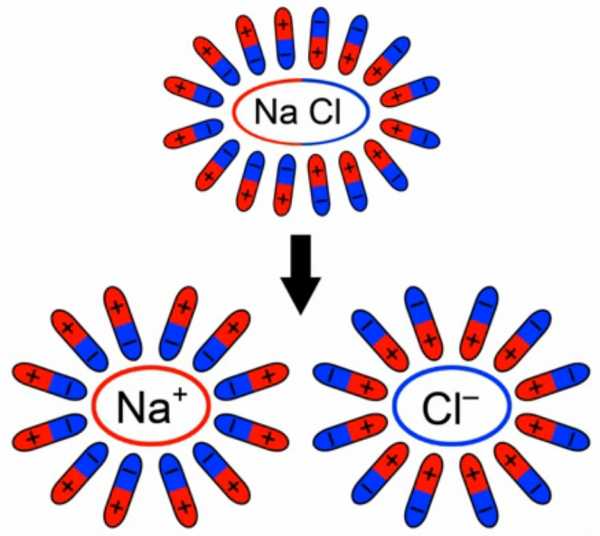
Рисунок 3. Схема образования свободных ионов
При подходе ионов натрия к катоду он получает свои недостающие электроны, ионы хлора при достижении анода отдают свои. Протекает электрический ток – лампочка горит.
virtuallab.by
Видеоматериалы
Опыт пилотных регионов, где соцнормы на электроэнергию уже введены, показывает: граждане платить стали меньше
Подробнее...С начала года из ветхого и аварийного жилья в республике были переселены десятки семей
Подробнее...Более 10-ти миллионов рублей направлено на капитальный ремонт многоквартирных домов в Лескенском районе
Подробнее...Актуальные темы
ОТЧЕТ о деятельности министерства энергетики, ЖКХ и тарифной политики Кабардино-Балкарской Республики в сфере государственного регулирования и контроля цен и тарифов в 2012 году и об основных задачах на 2013 год
Подробнее...Предложения организаций, осуществляющих регулируемую деятельность о размере подлежащих государственному регулированию цен (тарифов) на 2013 год
Подробнее...
КОНТАКТЫ
360051, КБР, г. Нальчик
ул. Горького, 4
тел: 8 (8662) 40-93-82
факс: 8 (8662) 47-31-81
e-mail:
Этот адрес электронной почты защищен от спам-ботов. У вас должен быть включен JavaScript для просмотра.