Электробезопасность
Стиральная, посудомоечная машина, холодильник прочно вошли в нашу жизнь. Почти в каждой семье есть
холодильник, у более чем половины семей имеются стиральные машины, а посудомоечные машины перестали быть
экзотикой. Они функциональны, экономичны, удобны и безопасны в обращении. Безопасность в обращении с бытовой
техникой гарантируется потребителю производителями бытовой техники и системой сертификации товаров,
действующей в нашей стране. Но при определенных условиях пользоваться бытовой техникой становится опасно.
В данной статье мы попытались осветить некоторые вопросы личной электробезопасности человека, и она
рассчитана на широкий круг читателей, но для неспециалиста некоторые термины могут быть малопонятны, а
статья показаться скучной – если это так, то не судите нас строго.
В нашей стране вопросам безопасности (безопасности государства – КГБ, безопасности труда, электробезопасности)
всегда уделялось большое внимание и, как правило, этими вопросами занимались хорошо подготовленные специалисты
и занимались профессионально. Шло время. Менялась страна. И оказалось, что вопросами безопасности, а личной
Шло время. Менялась страна. И оказалось, что вопросами безопасности, а личной
безопасности в первую очередь, приходится заниматься персонально каждому гражданину.
Одним из важных разделов личной безопасности каждого гражданина является электробезопасность.
Каждого человека на работе и дома окружает масса электрических приборов, и мы привычно включаем компьютер,
электрическую плиту, чайник, стиральную машину, посудомоечную машину (холодильник включен в сеть постоянно)
не задумываясь о том, насколько безопасно наше общение с источниками повышенной опасности – электрическими
приборами. Что интересно – если рассмотреть помещения, где мы чаще всего находимся, с позиций
электробезопасности, то наши кухни и ванные комнаты (если в ванной комнате установлена стиральная машина)
можно отнести к особо опасным помещениям.
В отношении опасности поражения людей электрическим током все помещения разделяются на следующие виды:
- помещения с повышенной опасностью
- особо опасные помещения
- помещения без повышенной опасности.

Помещениями с повышенной опасностью являются помещения, характеризующиеся в них одного из следующих
условий, создающих повышенную опасность:
- сырости или проводящей пыли,
- токопроводящих полов (металлических, земляных, железобетонных, кирпичных и т.п.),
- высокой температуры,
- возможности одновременного прикосновения человека к имеющим соединение с землей металлоконструкциям
зданий, технологическим аппаратам, механизмам и т.п. с одной стороны, и к металлическим корпусам
электрооборудования – с другой.
Особо опасные помещения характеризуются наличием одного из следующих условий, создающих особую опасность:
- особой сырости,
- химически активной среды,
- одновременного наличия двух или более условий повышенной опасности.
Помещениями без повышенной опасности являются помещения, в которых отсутствуют условия, создающие
повышенную опасность и особую опасность.
В отношении воздействия электрического тока на организм человека необходимо знать, что опасно не высокое
напряжение (разность потенциалов) само по себе, а величина протекающего через организм электрического тока.
Величина протекающего через организм тока прямо пропорциональна приложенному напряжению и обратно
пропорциональна сопротивлению тканей человека и сопутствующим сопротивлениям (сопротивление обуви, пола,
изоляции проводов, сопротивлению воздуха, внутреннему сопротивлению источника напряжения и т.д.). Для
примера можно рассмотреть два случая воздействия на человека высокого напряжения (10 тысяч вольт) –
напряжением от электрошокера и напряжением от линии ЛЭП. При равных условиях – равных напряжениях,
сопротивлениях тела, обуви и различных внутренних сопротивлениях источников тока, результат воздействия на
человека электрического тока будет не просто различен, а катастрофически различен.
- При воздействии электрическим током от электрошокера человек может потерять сознание.

- При воздействии электрическим током от линии ЛЭП – обуглиться.
Электрический ток, проходя через тело человека, производит тепловое, химическое и биологическое
воздействие, тем самым, нарушая нормальную жизнедеятельность организма.
Химическое действие электрического тока ведет к электролизу крови и других содержащихся в организме
растворов, что приводит к изменению их химического состава и, следовательно, к нарушению их функций.
Биологическое действие электрического тока проявляется в опасном возбуждении живых клеток организма, в
частности, нервных клеток и всей нервной системы. Такое возбуждение может сопровождаться судорогами,
явлениями паралича. В ряде случаев возможен паралич дыхательного аппарата (паралич мышц грудной клетки) и
паралич сердца (мышц желудочков сердца), являющийся причиной смертельного исхода. Прекращение работы сердца
под действием электрического тока может быть в результате непосредственного действия тока на сердечную
мышцу, когда ток проходит через область, или рефлекторным – вследствие нарушения функций центральной нервной
системы.
Степень поражения человека и тяжесть электрического удара зависят главным образом от следующих факторов:
- величины тока, проходящего через тело человека;
- пути тока в теле человека;
- длительности его прохождения.
Зависимость допустимых для человека значений токов от продолжительности их воздействия на организм человека
приведена на рисунке.
Допустимые для человека значения тока в зависимости от продолжительности воздействия.
1 – переменный ток 50 гц; 2 – постоянный ток.
На практике принимаются два пороговых значения электрического тока, выше которых токи опасны для жизни
человека:
для переменного тока – 75 мА;
для постоянного тока – 150 мА.
Но это не означает, что ниже этих значений токи безопасны. Они относительно безопасны, и степень их
безопасности зависит от многих сопутствующих факторов, в первую очередь от состояния здоровья человека.
Известен случай, когда здоровый молодой человек получил смертельный удар током от автомобильной
аккумуляторной батареи и многочисленные случаи, когда люди остаются живыми после удара молнии или удара
током при казни на электрическом стуле.
Стоит ли Вам надеяться на «авось» или заняться вопросами электробезопасности сейчас – решать Вам.
Если Вы решили, что стоит серьезно подойти к обеспечению своей электробезопасности, то необходимо выполнить
следующий минимум:
- Заземлить все корпуса электроприборов находящихся на кухне и в ванной комнате – холодильник,
посудомоечную машину, газовую плиту или электрическую плиту (электрическая плита должна быть заземлена
изначально), стиральную машину. - Проверить имеются ли в наличии и работоспособны автоматы защиты (автоматические выключатели, имеющие
только электромагнитный расцепитель) рекомендованные для установки производителями стиральных и
посудомоечных машин. Если они отсутствуют, то установить их.
Если они отсутствуют, то установить их. - Установить защитное отключение.
Защитным отключением называется система защиты, обеспечивающая автоматическое отключение всех фаз или
полюсов аварийного участка сети с напряжением до 1000 вольт с полным временем отключения с момента
возникновения однофазного замыкания не более 0,2 с.
В зависимости от входной величины устройства защитного отключения подразделяются на устройства,
реагирующие:
- на напряжение корпуса относительно земли;
- на ток замыкания на землю;
- на напряжение нулевой последовательности;
- на напряжение фазы относительно земли;
- на ток нулевой последовательности.
После выполнения всех трех пунктов, можно считать, что вы предприняли все необходимые меры для обеспечения
своей электробезопасности и безопасной работы Вашего холодильника, стиральной или посудомоечной машины.
Основные понятия и определения:
Травма, вызванная воздействием на организм электрического тока или электрической дуги, называется
электротравмой.
Электротравмы возможны в результате непосредственного контакта человека с токоведущими частями
электроустановки (стиральной, посудомоечной машины, холодильника), а также в случаях прикосновения к
металлическим конструктивным нетоковедущим частям электрооборудования, изоляция которого нарушена и имеет
место замыкание токоведущих частей на корпус.
Прикосновение человека к токоведущим частям электроустановки может быть двухфазным (двухполюсным) и
однофазным (однополюсным).
Электрическим замыканием на землю называется случайное электрическое соединение токоведущей части
электроустановки непосредственно с землей, нетоковедущими проводящими конструкциями или предметами, не
изолированными от земли.
Зона растекания тока замыкания на землю – зона, за пределами которой электрический потенциал, обусловленный
токами замыкания, может быть условно принят равным нулю.
Напряжением относительно земли при замыкании на корпус называется разность потенциалов между этим корпусом
и зоной нулевого потенциала.
В отношении воздействия на человека различают значения тока:
- пороговый ощутимый ток
- наименьшее значение ощутимого тока;
- пороговый неотпускающий ток
- наименьшее значение неотпускающего тока;
- пороговый фибрилляционный ток
- наименьшее значение фибрилляционного тока.
Напряжение прикосновения – напряжение между двумя точками цепи тока, которых одновременно касается человек.
Напряжение шага – напряжение между двумя точками цепи тока, находящимися одна от другой на расстоянии шага,
на которых стоит человек (на земле, на полу, и т.д.).
Заземление – преднамеренное электрическое соединение с заземляющим устройством частей электроустановки,
нормально не находящихся под напряжением.
Малое напряжение – номинальное напряжение не более 42 вольт, применяемое в целях уменьшения опасности
поражения человека электрическим током.
Если у Вас остались вопросы – обращайтесь к нам, в авторизованный сервисный центр «Эл Ко-сервис».
Мы всегда рады помочь Вам в решении возникших у Вас проблем.
Воздействия электрического тока на человека
Воздействия электрического тока на человека по характеру и по его видам чрезвычайно разнообразны. Они зависят от множества факторов.
По характеру воздействия различают: термические, биологические, электролитические, химические и механические повреждения.
Термическое действие тока проявляется ожогами отдельных участков тела, почернением и обугливанием кожи и мягких тканей; нагревом до высокой температуры органов, расположенных на пути прохождения тока, кровеносных сосудов и нервных волокон. Фактор нагрева вызывает функциональные расстройства в органах и системах человеческого тела.
Электролитическое действие тока выражается в разложении различных жидкостей организма на ионы, нарушающие их свойства.
Химическое действие тока проявляется в возникновении химических реакций в крови, лимфе, нервных волокнах с образованием новых веществ, не свойственных организму.
Биологическое действие приводит к раздражению и возбуждению живых тканей организма, возникновению судорог, остановке дыхания, изменению режима сердечной деятельности.
Механическое действие тока выражается в сильном сокращении мышц, вплоть до их разрыва, разрывам кожи, кровеносных сосудов, переломе костей, вывихе суставов, расслоении тканей.
По видам поражения различают: электротравмы и электрические
удары.
Электротравмы — это местные поражения (ожоги, электрические знаки, металлизация кожи, механические повреждения, электроофтальмия).
Токовые ожоги подразделяются на контактные и дуговые. Контактные возникают в месте контакта кожи с токоведущей частью электроустановки напряжением не выше 2 кВ, дуговые — в местах, где возникла электрическая дуга, обладающая высокой температурой и большой энергией. Дуга может вызвать обширные ожоги тела, обугливание и даже полное сгорание больших участков тела.
Электрические знаки — это уплотненные участки серого или бледно-желтого цвета на поверхности кожи человека, подвергнувшейся действию тока. Как правило, в месте электрического знака кожа теряет чувствительность.
Как правило, в месте электрического знака кожа теряет чувствительность.
Металлизация кожи — внедрение в верхние слои кожи мельчайших частиц металла, расплавившегося под действием электрической дуги или заряженных частиц электролита из электролизных ванн.
Электроофтальмия — воспаление наружных оболочек глаз в результате воздействия мощного потока ультрафиолетового излучения от электрической дуги. Возможно повреждение роговой оболочки, что особенно опасно.
Электрические удары — это общие поражения, связанные с возбуждением тканей проходящим через них током (сбои в функционировании центральной нервной системы, органов дыхания и кровообращения, потеря сознания, расстройства речи, судороги, нарушение дыхания вплоть до его остановки, мгновенная смерть).
По степени воздействия на человека различают три пороговых значения тока: ощутимый, неотпускающий и фибрилляционный.
Ощутимым называют электрический ток, который при прохождении через организм вызывает ощутимое раздражение. Ощущение от протекания переменного электрического тока, как правило, начинается от 0,6 мА.
Ощущение от протекания переменного электрического тока, как правило, начинается от 0,6 мА.
Неотпускающим называют ток, который при прохождении через человека вызывает непреодолимые судорожные сокращения мышц рук, ног или других частей тела, соприкасающихся с токоведущим проводником. Переменный ток промышленной частоты, протекая по нервным тканям, воздействует на биотоки мозга, вызывая эффект «приковывания» к неизолированному проводнику тока в месте контакта с ним. Человек не может самостоятельно оторваться от токоведущей части.
Фибрилляционный называют ток, который при прохождении через организм вызывает фибрилляцию сердца (разновременные некоординированные сокращения отдельных мышечных волокон сердца). Фибрилляция может привести к остановке сердца и параличу дыхания.
Степень поражения электрическим током зависит от электрической проводимости или от обратного ему параметра — общего электрического сопротивления организма. Они, в свою очередь, определяются:
— индивидуальными особенностями тела человека;
— параметрами электрической цепи (напряжением, силой и родом тока, частотой его колебаний), под действие которой попал работник;
— путем прохождения тока через тело человека;
— условиями включения в электросеть;
— продолжительностью воздействия;
— условиями внешней среды (температурой, влажностью, наличием токопроводящей пыли и др. ).
).
Низкое электрическое сопротивление организма способствует более тяжелым последствиям поражения. Электрическое сопротивление тела человека снижается вследствие неблагоприятных физиологических и психологических состояний (утомление, заболевание, алкогольное опьянение, голод, эмоциональное возбуждение).
Общее электрическое сопротивление человеческого организма суммируется из сопротивлений каждого участка тела, расположенного на пути прохождения тока. Каждый участок обладает своим сопротивлением. Наибольшее электросопротивление имеет верхний роговой слой кожи, в котором отсутствуют нервные окончания и кровеносные сосуды. При влажной или поврежденной коже сопротивление составляет около 1000 Ом. При сухой коже без повреждений оно многократно возрастает. При электропробое наружного слоя кожи полное сопротивление тела человека значительно снижается. Сопротивление кожи падает тем быстрее, чем длительнее процесс протекания тока.
Тяжесть поражения человека пропорциональна силе тока, прошедшего через его тело. Ток силой более 0,05 А может смертельно травмировать человека при продолжительности воздействия 0,1 с.
Ток силой более 0,05 А может смертельно травмировать человека при продолжительности воздействия 0,1 с.
Переменный ток более опасен, чем постоянный, однако при высоком напряжении (более 500 В) опаснее становится постоянный ток. Наиболее опасен частотный диапазон переменного тока от 20 до 100 Гц. Основная масса промышленного оборудования работает на частоте 50 Гц, входящей в этот опасный диапазон. Высокочастотные токи менее опасны. Токи высокой частоты могут вызвать лишь поверхностные ожоги, так как они распространяются только по поверхности тела.
Степень поражения организма во многом определяет путь, по которому электрический ток проходит через тело человека. Наиболее часты в практике варианты 1, 2, 5, 6, 7, показанные на рис. 2.1.
Рис. 2.1. Варианты путей прохождения электрического тока через тело человека: 1 — «рука—рука».; 2 — «рука—ноги»; 5 — «нога—нога»; 6 — «голова—ноги»; 7 — «голова—рука»
— человек дотрагивается двумя руками до токоведущих проводов или частей оборудования, находящихся под напряжением. В этом случае движение тока идет от одной руки к другой через легкие и сердце. Путь этот принято называть «рука — рука»;
В этом случае движение тока идет от одной руки к другой через легкие и сердце. Путь этот принято называть «рука — рука»;
— человек стоит двумя ногами на земле и прикасается одной рукой к источнику тока. Путь протекания тока в этом случае называют «рука — ноги». Ток проходит через легкие и, возможно, через сердце;
— человек стоит обеими ногами на земле в зоне стекания на землю тока от неисправного электрооборудования, выполняющего в данном случае роль заземлителя. Земля в радиусе до 20 м получает потенциал напряжения, уменьшающийся с удалением от заземлителя. Каждая из ног человека получает разный потенциал напряжения, определяемый удаленностью от неисправного электрооборудования. В результате возникает электрическая цепь «нога — нога», напряжение в которой называют шаговым;
— прикосновение головой к токоведущим частям может создать цепь, где путь тока будет «голова — руки» или «голова — ноги».
Наиболее опасными являются те варианты, при реализации которых в зону поражения попадают жизненно важные системы организма, — головной мозг, сердце, легкие. Это цепи: «голова — рука», «голова — ноги», «руки — ноги», «рука — рука».
Это цепи: «голова — рука», «голова — ноги», «руки — ноги», «рука — рука».
Пример. Переменный ток частотой 50 Гц и напряжением 220 В, являющийся стандартным для отечественных электрических сетей, при прохождении по пути «рука — ноги» в зависимости от силы тока может оказывать различное воздействие. Так, если сила тока составляет 0,6—1,5 мА, он уже ощутим. Ему сопутствует слабый зуд, легкое дрожание пальцев. При силе тока 2,0—2,5 мА появляются болевые ощущения и сильное дрожание пальцев. При силе тока 5,0—7,0 мА возникают судороги кистей рук. Ток силой 20,0—25,0 мА — это уже неотпускающий ток. Человек не может самостоятельно оторвать руки от проводника, наблюдаются сильные боли и судороги, затрудненное дыхание. При силе тока 50,0—80,0 мА происходит паралич дыхания (при длительном протекании тока может возникнуть фибрилляция сердца). При 90,0—100,0 мА наступает фибрилляция. Через 2—3 с наступает паралич дыхания (табл. 2.1).
Таблица 2.1. Характер воздействия на человека при протекании через тело (участки тела) электрического тока
Протекание по телу человека постоянного тока напряжением менее 500 В вызывает болевое ощущение в месте соприкосновения с проводником, в суставах конечностей, болевой шок, ожоги. Однако он может привести и к остановке дыхания или сердечной деятельности. При напряжении 500 В и выше различий в воздействии постоянного и переменного токов практически не наблюдается.
Однако он может привести и к остановке дыхания или сердечной деятельности. При напряжении 500 В и выше различий в воздействии постоянного и переменного токов практически не наблюдается.
Между током, протекающим через тело человека, и приложенным к нему напряжением существует нелинейная зависимость. При увеличении напряжения сила тока растет быстрее напряжения.
Степень опасности поражения электрическим током зависит от условий включения человека в электросеть. На производствах используют трехфазные электрические сети переменного тока (с изолированной нейтралью или с заземленной нейтралью) и однофазные электрические сети. Все они опасны, но у каждой степень опасности разная.
Для трехфазных сетей переменного тока с любым режимом нейтрали самым опасным является двухфазное прикосновение (одновременно к двум проводам исправной сети). Человек замыкает через свое тело два фазных провода и попадает под полное линейное напряжение сети. Ток при этом проходит по наиболее опасному пути «рука — рука». Сила тока максимальна, так как в сеть включается только очень невысокое (примерно 1000 Ом) сопротивление тела человека. Двухфазное прикосновение к действующим частям установки уже при напряжении 100 В может оказаться смертельным.
Сила тока максимальна, так как в сеть включается только очень невысокое (примерно 1000 Ом) сопротивление тела человека. Двухфазное прикосновение к действующим частям установки уже при напряжении 100 В может оказаться смертельным.
В случае прикосновении к проводу установки, находящейся в аварийном режиме (обрыв второго провода и замыкание фазы на землю), из-за перераспределения напряжений между фазами опасность серьезного поражения человека электрическим током несколько снижается.
Трехфазные электрические сети с заземленной нейтралью несколько менее опасны, чем сети с изолированной нейтралью. Такие сети обладают очень малым сопротивлением между нейтралью и землей, поэтому заземление нейтрали служит целям безопасности.
Наименее опасным всегда является прикосновение к одному из проводов исправной сети.
При падении оборванного провода на грунт или при повреждении изоляции и пробое фазы через корпус оборудования на землю, а также в местах расположения заземлителя происходит растекание тока замыкания в грунте. Оно подчиняется гиперболическому закону (рис. 2.2).
Оно подчиняется гиперболическому закону (рис. 2.2).
Рис. 2.2. Схема растекания тока замыкания в грунте: 1 — место падения на землю оборванного провода; 2 — кривая (гипербола) распределения потенциалов на поверхности земли при растекании тока; U3 — напряжение в точке замыкания
Так как грунт является существенным сопротивлением для растекания тока, все точки, расположенные на одной радиальной прямой, но на разных расстояниях от точки замыкания проводника на грунт, будут иметь разный потенциал. Он максимален у заземлителя, уменьшается по мере удаления от него и равен нулю за границей зоны растекания. На расстоянии 1 м от заземлителя падение напряжения в сухом грунте составляет уже 68 %, на расстоянии 10 м — 92 %. Нахождение человека в зоне растекания тока близко к заземлителю может быть опасным.
Выходить из опасной зоны необходимо по радиусу очень мелкими шагами. Согласно «Инструкции по технике безопасности при эксплуатации тяговых подстанций, пунктов электропитания и секционирования электрифицированных железных дорог» № ЦЭ-402, утвержденной МПС России 17. 10.96 г., перемещаться в зоне растекания тока замыкания на землю без средств защиты (диэлектрических галош, бот) следует, передвигая ступни ног по земле и не отрывая их одну от другой. С увеличением длины шага увеличивается разница в потенциалах, под которыми находится каждая из ног. Образующееся за счет разности потенциалов в зоне растекания тока напряжение между двумя точками поверхности земли, которые отстоят друг от друга в радиальном направлении на расстоянии шага (0,8 м), называют шаговым напряжением. Путь тока при шаговом напряжении «нога — нога» не касается жизненно важных органов. Однако при значительном напряжении возникают судороги ног, человек падает. Электрическая цепь в этом случае замыкается через все тело упавшего.
10.96 г., перемещаться в зоне растекания тока замыкания на землю без средств защиты (диэлектрических галош, бот) следует, передвигая ступни ног по земле и не отрывая их одну от другой. С увеличением длины шага увеличивается разница в потенциалах, под которыми находится каждая из ног. Образующееся за счет разности потенциалов в зоне растекания тока напряжение между двумя точками поверхности земли, которые отстоят друг от друга в радиальном направлении на расстоянии шага (0,8 м), называют шаговым напряжением. Путь тока при шаговом напряжении «нога — нога» не касается жизненно важных органов. Однако при значительном напряжении возникают судороги ног, человек падает. Электрическая цепь в этом случае замыкается через все тело упавшего.
В однофазных сетях постоянного тока наиболее опасным также является прикосновение человека одновременно к двум проводам, так как в этом случае ток, протекающий через тело человека, определяется только сопротивлением его тела.
Продолжительность воздействия тока часто служит фактором, от которого зависит исход поражения. Чем продолжительнее воздействует электрический ток на организм, тем тяжелее последствия. Через 30 с сопротивление тела человека протеканию тока падает примерно на 25 %, а через 90 с — на 70 %.
Чем продолжительнее воздействует электрический ток на организм, тем тяжелее последствия. Через 30 с сопротивление тела человека протеканию тока падает примерно на 25 %, а через 90 с — на 70 %.
Полезная информация:
Факторы, влияющие на исход поражения человека током
Конспект по безопасности жизнедеятельности
Характер и тяжесть поражения электрическим током зависят от ряда факторов, таких как величина и длительность протекания тока через тело человека, путь тока в теле человека, род и частота действующего тока, индивидуальные свойства человека и свойства окружающей среды, фактор внимания. Электрическое сопротивление тела человека и приложенное к нему напряжение также влияют на исход поражения, но лишь постольку, поскольку они определяют значение тока, проходящего через тело человека.
Величина тока, протекающего через тело человека, является основным фактором, влияющим на исход поражения. Чем больше величина тока, протекающего через тело человека, тем большее число заряженных частиц будет взаимодействовать с клетками организма и, следовательно, тем выше может быть тяжесть поражения. Опасность действия электрического тока частотой 50 Гц оценивается по ответным реакциям организма человека (табл. 4.1 – для пути тока в теле человека «рука – рука»).
Чем больше величина тока, протекающего через тело человека, тем большее число заряженных частиц будет взаимодействовать с клетками организма и, следовательно, тем выше может быть тяжесть поражения. Опасность действия электрического тока частотой 50 Гц оценивается по ответным реакциям организма человека (табл. 4.1 – для пути тока в теле человека «рука – рука»).
Таким образом, можно выделить три уровня тока через тело человека с соответствующими ответными реакциями организма как наиболее важные с точки зрения оценки опасности поражения человека: пороговые ощутимый, неотпускающий и фибрилляционный токи.
Пороговый ощутимый ток – это наименьшая величина тока через тело человека, вызывающего ощутимые раздражения. Для тока с частотой 50 Гц его величина в среднем составляет 1 мА, а для постоянного тока – 6 мА. Неощутимые токи считаются относительно без опасными. Тем не менее, длительное протекание неощутимого тока через тело человека (даже в течение нескольких минут) может отрицательно сказаться на здоровье и поэтому является недопустимым.
Таблица 4.1
| Величина тока через тело человека, мА | Характер воздействия |
| 8,0 – 10,0 | Сильные боли в руках. Руки трудно оторвать от электродов |
| 20 — 50 | Паралич рук, оторвать их от электродов невозможно. Очень сильные боли в руках и груди |
| 80 – 100 | Фибрилляция сердца через 2 – 3 с, паралич дыхания |
| Более 100 | То же действие, но за меньшее время. |
Примечание: при токах более 5 А фибрилляция не возникает, сердце останавливается.
Пороговый неотпускающий ток – это наименьшая величина тока через тело че ловека, сопровождающаяся судорожными сокращениями мышц и потерей контроля над управлением ими, начиная с которой человек не в состоянии самостоятельно освободиться от действия тока (например, оторвать руки от электродов). При частоте 50 Гц величину этого тока можно считать равной 10 мА.
Неотпускающих уровней постоянного тока, строго говоря, нет, т.е. человек при любых значениях тока может оторваться от токоведущей части. Однако в момент отрыва возникают болезненные сокращения мышц, аналогичные наблюдаемым при переменном токе такой же величины. Поэтому в качестве порогового неотпускающего тока при постоянном напряжении условно принимают ток, равный 50 мА, при котором большинство взрослых людей всё же в состоянии выдержать боль, возникающую в момент отрыва рук от электродов.
Токи через тело человека, превышающие величину порогового неотпускающего тока, следует считать опасными для человека.
Пороговый фибрилляционный ток – это наименьшая величина тока через тело человека, вызывающего фибрилляцию сердца. При частоте 50 Гц величина этого тока составляет около 100 мА, а для постоянного тока – примерно 300 мА.
Продолжительность воздействия тока оказывает существенное влияние на исход поражения человека. Чем дольше действие тока, тем больше вероятность тяжёлого или даже смертельного исхода. Объясняется это тем, что с увеличением времени воздействия тока на живые ткани всё большее количество заряженных частиц (носителей электрического тока) взаимодействует с клетками организма и, следовательно, всё большее число клеток оказывается поражённым. С течением времени растёт величина самого тока через тело человека за счёт уменьшения сопротивления тела че ловека, возникающего в результате нагрева тела током. Наконец, при длительном действии тока на организм человека более частыми могут стать совпадения интервалов времени протекания тока через сердечную мышцу с интервалами наиболее уязвимой фазы Т кардиоцикла, когда желудочки сердца находятся в расслабленном состоянии, а вероятность возникновения фибрилляции сердца сильно возрастает. Продолжительность фазы Т около 0,2 с.
Объясняется это тем, что с увеличением времени воздействия тока на живые ткани всё большее количество заряженных частиц (носителей электрического тока) взаимодействует с клетками организма и, следовательно, всё большее число клеток оказывается поражённым. С течением времени растёт величина самого тока через тело человека за счёт уменьшения сопротивления тела че ловека, возникающего в результате нагрева тела током. Наконец, при длительном действии тока на организм человека более частыми могут стать совпадения интервалов времени протекания тока через сердечную мышцу с интервалами наиболее уязвимой фазы Т кардиоцикла, когда желудочки сердца находятся в расслабленном состоянии, а вероятность возникновения фибрилляции сердца сильно возрастает. Продолжительность фазы Т около 0,2 с.
Путь тока в теле человека оказывает существенное влияние на исход пораже ния. Наиболее тяжёлые электротравмы возникают в случаях, когда на пути тока оказываются жизненно важные органы (мозг, сердце, лёгкие) или уязвимые места, богатые нервными окончаниями, чувствительными к электрическому току. Наиболее опасными путями протекания тока являются: «голова – руки», «голова – ноги», «рука – рука», «рука – ноги». Наиболее уязвимыми местами тела человека считаются: тыльная часть руки, спина, шея, висок, плечи, передние части ног. Образование электрической цепи через уязвимые места при неблагоприятном стечении обстоятельств может привести к тяжёлым исходам поражения при токах даже в несколько миллиампер.
Наиболее опасными путями протекания тока являются: «голова – руки», «голова – ноги», «рука – рука», «рука – ноги». Наиболее уязвимыми местами тела человека считаются: тыльная часть руки, спина, шея, висок, плечи, передние части ног. Образование электрической цепи через уязвимые места при неблагоприятном стечении обстоятельств может привести к тяжёлым исходам поражения при токах даже в несколько миллиампер.
Род и частота тока также влияют на исход поражения. Наиболее опасными являются переменные токи частотой 20 — 100 Гц. При частотах меньше 20 Гц или больше 100 Гц опасность поражения током снижается. Токи с частотами в несколько сотен кГц и выше фибрилляции сердца практически не вызывают, однако возможность их термического и биологического действия сохраняется.
Индивидуальные свойства человека также влияют на исход поражения током. Физически здоровые люди легче переносят электрические удары, чем больные и слабые. Повышенной восприимчивостью к электрическому току обладают лица, страдающие рядом заболеваний, в первую очередь, болезнями кожи, сердечно-сосудистой системы, органов внутренней секреции, лёгких, нервными болезнями. Утомление, возникающее к концу рабочего дня, снижая внимательность, не только увеличивает вероятность поражения током, но и может усугубить его тяжесть. Отягощают электротравму алкогольные опьянения и болезненные состояния. Существует список болезней, препятствующих допуску к работе по обслуживанию действующих электроустановок.
Утомление, возникающее к концу рабочего дня, снижая внимательность, не только увеличивает вероятность поражения током, но и может усугубить его тяжесть. Отягощают электротравму алкогольные опьянения и болезненные состояния. Существует список болезней, препятствующих допуску к работе по обслуживанию действующих электроустановок.
Условия внешней среды в некоторых случаях увеличивают опасность поражения током. Повышенная влажность вдыхаемого воздуха, пониженное атмосферное давление, перегрев, уменьшенное содержание кислорода в воздухе или уве личенное содержание углекислого газа повышают чувствительность организма к электрическому току.
Фактор внимания учитывает состояние центральной нервной системы человека. Установлено, что последствия поражения в результате неожиданного электрического удара могут оказаться более тяжёлыми по сравнению со случаем, если тот же человек получит электрический удар, ожидая его. Наиболее опасные электротравмы происходят с людьми, случайно оказавшимися под напряжением. Наоборот, если человек знает о грозящей ему опасности, работает в состоянии сосредоточенного внимания, то поражение током, если оно произойдёт, не будет для него неожиданным. Последствия такого поражения, как правило, оказываются менее тяжёлыми.
Наоборот, если человек знает о грозящей ему опасности, работает в состоянии сосредоточенного внимания, то поражение током, если оно произойдёт, не будет для него неожиданным. Последствия такого поражения, как правило, оказываются менее тяжёлыми.
Конспект по безопасности жизнедеятельности
Действие электрического тока на организм человек
« Действие
электрического
Тока на организм
человек».
Цель: показать какие основные
факторы влияют на исход
поражения электрическим
током
• Электротравматизм характеризуют такие
особенности: защитная реакция организма
появляется только после попадания человека
под напряжение, т. е. когда электрический ток
уже протекает через его организм;
электрический ток действует не только в местах
контактов с телом человека и на пути
прохождения через организм, но и вызывает
рефлекторное действие, проявляющееся в
нарушении нормальной деятельности сердечнососудистой и нервной системы, дыхания и т.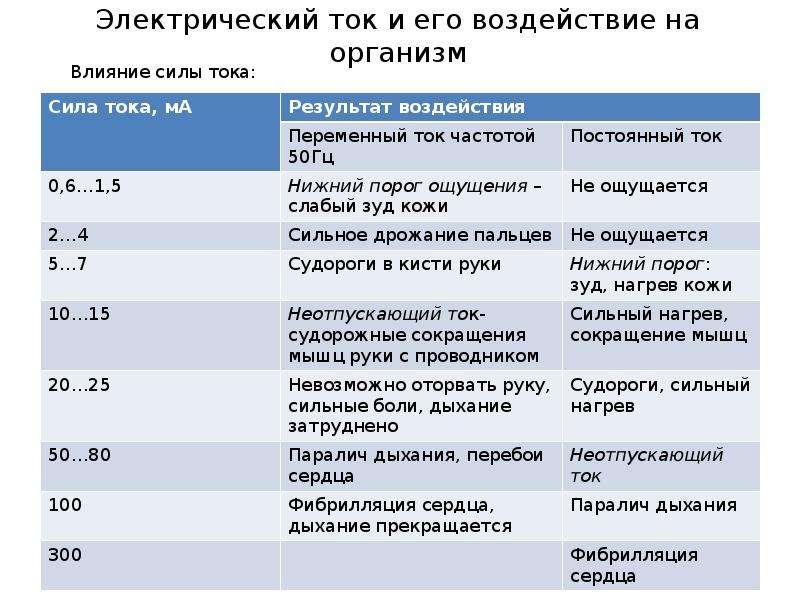 д.
д.
Электротравму человек может получить как при
непосредственном контакте с токоведущими
частями, так и при поражении напряжением
прикосновения или шага, через электрическую
дугу.
Электротравматизм по сравнению с
другими видами производственного травматизма
составляет небольшой процент, однако по числу
травм с тяжелым, и особенно летальным, исходом
занимает одно из первых мест. Наибольшее число
электротравм (60—70 %) происходит при работе на
электроустановках напряжением до 1000 В. Это
объясняется широким распространением таких
электроустановок и сравнительно низким уровнем
электротехнической подготовки лиц,
эксплуатирующих их. Электроустановок напряжением
свыше 1000 В в эксплуатации значительно меньше, и
обслуживает их специально обученный персонал, что
и обусловливает меньшее количество электротравм.
Причины поражения человека
электрическим током
• Причины поражения человека электрическим током следующие:
прикосновение к неизолированным токоведущим частям; к
металлическим частям оборудования, оказавшимся под
напряжением вследствие повреждения изоляции; к
неметаллическим предметам, оказавшимся под напряжением;
поражение током напряжения шага и через.
Пороговые значения электрического
тока
Электрический ток различной силы оказывает различное
действие на человека. Выделены пороговые значения
электрического тока: пороговый ощутимый ток — 0,6…1,5 мА
при переменном токе частотой 50 Гц и 5… 7 мА при
постоянном токе; пороговый неотпускающий ток (ток,
вызывающий
при
прохождении
через
человека
непреодолимые судорожные сокращения мышц руки, в
которой зажат проводник) — 10…15 мА при 50 Гц и 50…80 мА
при постоянном токе; пороговый фибрилляционный ток (ток,
вызывающий при прохождении через организм фибрилляцию
сердца) — 100 мА при 50 Гц и 300 мА при постоянном
электрическом токе.
12. От чего зависит степень действия электрического тока на организм человека
Исход поражения также зависит от
длительности протекания тока через
человека. С увеличением длительности
нахождения человека под напряжением
эта опасность увеличивается.
Что опаснее — переменный или постоянный электрический ток?
Опасность переменного тока зависит от частоты этого тока.
Исследованиями установлено, что токи в диапазоне от 10 до 500 Гц
практически одинаково опасны. С дальнейшим увеличением частоты
значения пороговых токов повышаются. Заметное снижение опасности
поражения человека электрическим током наблюдается при частотах
более 1000 Гц.
Постоянный ток менее опасен и пороговые значения его в 3 — 4 раза
выше, чем переменного тока частотой 50 Гц. Однако при разрыве цепи
постоянного тока ниже порогового ощутимого возникают резкие
болевые ощущения, вызываемые током переходного процесса.
Положение о меньшей опасности постоянного тока по сравнению с
переменным справедливо при напряжениях до 400 В. В диапазоне
400…600 В опасности постоянного и переменного тока частотой 50 Гц
практически одинаковы, а с дальнейшим увеличением напряжения
относительная опасность постоянного тока увеличивается. Это
Это
объясняется физиологическими процессами действия на живую клетку.
Следовательно, действие электрического тока на организм человека
многообразно и зависит от многих факторов.
Роль оценки порога мерцательной аритмии в руководстве лечением
Indian Pacing Electrophysiol J. 2003 Oct-Dec; 3(4): 224–230.
Опубликовано в Интернете 1 октября 2003 г.
Медицинский университет префектуры Киото, медицинский факультет, отделение кардиологии, Каварамати Хирокодзи, Камигё-ку, Киото, 602-8566, Япония
Адрес для корреспонденции: д-р Такеши Сираяма, MD, Доктор философии, Медицинский университет префектуры Киото, медицинский факультет, отделение кардиологии, Каварамачи Хирокодзи, Камигё-ку, Киото, 602-8566, Япония.Электронная почта: pj.ca.m-upk.otok@amayaris
Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что оригинал работа цитируется правильно.
Abstract
Фибрилляцию предсердий можно воспроизводимо индуцировать быстрой стимуляцией частотой 50 Гц, которая проводится в систолическую и раннюю диастолическую фазы возбуждения предсердий. Продолжительность мерцательной аритмии, индуцированной таким образом, примерно зависела от текущей амплитуды стимуляции.Минимальный ток, который мог вызвать длительную фибрилляцию предсердий (30 секунд в клинических условиях, 2 секунды в модели кролика или крысы), определяли как порог фибрилляции предсердий (ППП). AFT была выше у пациентов, у которых в анамнезе была фибрилляция предсердий, чем у тех, у кого ее не было. Антиаритмические препараты повышали AFT в разной степени как в экспериментальных, так и в клинических случаях. Долгосрочную эффективность лекарственного средства можно было бы предсказать у пациента, измерив, насколько лекарственное средство увеличило AFT (точка отсечки = увеличение 5 мА).AFT является полезным маркером для оценки уязвимости предсердий и определения фармакологического лечения мерцательной аритмии.
Ключевые слова: фибрилляция предсердий, электрофизиологическое исследование, терапия, прогноз
Введение
Мерцательная аритмия является объектом интенсивных исследований, поскольку фибрилляция является последним рубежом в аритмологии [1-3]. Теперь у нас есть несколько терапевтических методов лечения этой распространенной аритмии, включая фармакологический и немедикаментозный подход.Однако долгосрочный успех этих методов лечения будет в лучшем случае от 50% до 60% [4]. Есть несколько причин ее сложности: 1) эта аритмия в основном связана со старением в клинических случаях, 2) механизм этой аритмии до конца не ясен [5], 3) нет подходящей модели на животных [6]. Мы работали над этими проблемами в течение нескольких лет и стали использовать порог фибрилляции предсердий в качестве инструмента для оценки легкости вызвать фибрилляцию предсердий (уязвимость предсердий) как в экспериментальных [7-10], так и в клинических [11-13] настройки.Это уникальный параметр для количественной оценки уязвимости предсердий [12,13]. Поскольку в этой области было проведено очень мало исследований, я суммирую данные из нашей лаборатории, сравнивая их с желудочковым аналогом в этой обзорной статье.
Поскольку в этой области было проведено очень мало исследований, я суммирую данные из нашей лаборатории, сравнивая их с желудочковым аналогом в этой обзорной статье.
Что такое порог фибрилляции?
Порог фибрилляции изучался в основном в желудочке [14-16] после Wiggers et al [17,18]. Для индукции фибрилляции желудочков в больном и нормальном сердце давали одиночный стимул.Для этого стимул следует давать в критический момент времени с достаточной амплитудой тока. Временная точка обычно находится на пике зубца Т ЭКГ. Минимальная амплитуда тока, вызывающая фибрилляцию, определяется как порог фибрилляции. Эта концепция основана на том факте, что фибрилляция может быть вызвана силой тока большей, чем критическая (пороговая) амплитуда. Недавно было признано, что вторая критическая амплитуда существует, когда амплитуда тока постепенно увеличивается.Сила тока, превышающая вторую критическую точку, может не вызвать фибрилляцию, а, скорее, остановить фибрилляцию [19,20]. Эта точка называется порогом дефибрилляции, который в настоящее время широко изучается из-за того, что в клинической практике используются имплантируемые кардиовертеры-дефибрилляторы. В сочетании с уязвимым периодом (зона критических моментов времени для индукции фибрилляции) существует область на кривой интервала силы, где фибрилляция может быть вызвана одним стимулом [17,18]. Эта область смещается вправо по оси интервала сцепления, например, при ишемии миокарда или введении антиаритмических препаратов [21] ().Тот же аргумент можно применить и к атриуму. Однако предсердный уязвимый период был менее определен, чем желудочковый [22,23]. Предсердный зубец T едва различим на стандартной ЭКГ.
В сочетании с уязвимым периодом (зона критических моментов времени для индукции фибрилляции) существует область на кривой интервала силы, где фибрилляция может быть вызвана одним стимулом [17,18]. Эта область смещается вправо по оси интервала сцепления, например, при ишемии миокарда или введении антиаритмических препаратов [21] ().Тот же аргумент можно применить и к атриуму. Однако предсердный уязвимый период был менее определен, чем желудочковый [22,23]. Предсердный зубец T едва различим на стандартной ЭКГ.
На рисунке показан пример отношения прочности к интервалу. Треугольники представляют собой порог стимуляции в каждом интервале сопряжения после начального отклонения предсердной/желудочковой активности. Кружки указывают на индукцию повторяющихся ответов, а квадраты показывают индукцию фибрилляции. Закрытые символы представляют собой контрольные данные, а открытые символы — данные, полученные при наличии ишемии или прокаинамида.
Существует несколько методов индукции фибрилляции желудочков [14,17]. Среди них непрерывная высокочастотная стимуляция с частотой 50-100 Гц, которая охватывает весь «уязвимый период», может постоянно вызывать фибрилляцию [14]. Таким образом, мы применили этот тип стимуляции к предсердиям, и минимальный ток, вызывающий длительную фибрилляцию предсердий (> 30 секунд в клинических условиях,> 2 секунд в экспериментах), был определен как порог фибрилляции (). Продолжительность «длительной» фибрилляции предсердий была выбрана в качестве определения достаточно произвольно, но она основывалась на соотношении между интенсивностью тока и продолжительностью (см. Matsuo et al. [9]).Продолжительность положительно коррелировала с силой тока, пока ток не достигал порога. Это определение отличается от общепринятого использования с точки зрения модели стимуляции.
Среди них непрерывная высокочастотная стимуляция с частотой 50-100 Гц, которая охватывает весь «уязвимый период», может постоянно вызывать фибрилляцию [14]. Таким образом, мы применили этот тип стимуляции к предсердиям, и минимальный ток, вызывающий длительную фибрилляцию предсердий (> 30 секунд в клинических условиях,> 2 секунд в экспериментах), был определен как порог фибрилляции (). Продолжительность «длительной» фибрилляции предсердий была выбрана в качестве определения достаточно произвольно, но она основывалась на соотношении между интенсивностью тока и продолжительностью (см. Matsuo et al. [9]).Продолжительность положительно коррелировала с силой тока, пока ток не достигал порога. Это определение отличается от общепринятого использования с точки зрения модели стимуляции.
Показаны три отведения стандартной записи ЭКГ и 3 внутрисердечные записи. HRA, RAA и CS являются высокими правым предсердием, ушком правого предсердия и коронарным синусом соответственно. В середине рисунка к HRA применяли быструю стимуляцию с частотой 50 Гц в течение 1 секунды, что вызывало фибрилляцию предсердий. Постоянная стимуляция с частотой 120/мин предшествовала быстрой стимуляции. Измеряли продолжительность мерцательной аритмии, а затем увеличивали текущую амплитуду быстрой стимуляции для следующей попытки. Минимальный ток, который мог вызвать «устойчивую» фибрилляцию, определяли как порог фибрилляции предсердий.
Постоянная стимуляция с частотой 120/мин предшествовала быстрой стимуляции. Измеряли продолжительность мерцательной аритмии, а затем увеличивали текущую амплитуду быстрой стимуляции для следующей попытки. Минимальный ток, который мог вызвать «устойчивую» фибрилляцию, определяли как порог фибрилляции предсердий.
Механизм индукции фибрилляции
Точный механизм индукции фибрилляции одиночным импульсом или последовательностью импульсов не ясен. Тем не менее, есть некоторые наблюдательные исследования в желудочке [14,15,17,19]: 1) локальная повторяющаяся активность индуцировалась в месте стимуляции, 2) распространялись возбуждения, 3) повторяющиеся возбуждения наблюдались во многих участках миокарда 4) возбуждения приводили к дезорганизованной деятельности (фибрилляции) из-за неоднородности проводимости и реполяризации.При высокочастотной стимуляции желудочка с интенсивностью диастолического порога можно наблюдать желудочковый ответ, имитирующий желудочковую тахикардию. По мере постепенного увеличения интенсивности интервалы возбуждения желудочков становятся короче. При критической интенсивности стимулирующего тока и выше желудочковые возбуждения переходят в фибрилляции. Хотя эти результаты основаны на исследовании желудочков, вполне вероятно, что такое же явление может наблюдаться и в предсердиях.
При критической интенсивности стимулирующего тока и выше желудочковые возбуждения переходят в фибрилляции. Хотя эти результаты основаны на исследовании желудочков, вполне вероятно, что такое же явление может наблюдаться и в предсердиях.
Экспериментальная методика индукции мерцательной аритмии
Наиболее популярным методом индукции мерцательной аритмии является метод экстрастимуляции, т. скорость [23]. Поскольку воспроизводимость этого метода относительно низкая, после многих испытаний часто необходима статистическая оценка [24] для оценки эффективности лекарственного средства или уязвимости предсердий. С другой стороны, непрерывная быстрая стимуляция может легко вызвать фибрилляцию.Таким образом, этот метод был введен для количественной оценки предсердной уязвимости (легкости вызвать мерцательную аритмию). Для этой цели мы выбрали 50 Гц для 1-секундной стимуляции. Приращение силы тока составляет 1 мА для клинических условий и от 0,1 до 0,5 мА для экспериментального использования.
Экспериментальные результаты
Порог фибрилляции предсердий был измерен в изолированных сердцах морской свинки или кролика. Блокаторы натриевых каналов [7,8,11] (дизопирамид, пилсикаинид, флекаинид, априндин, лидокаин), блокаторы калиевых каналов [7,10] (Е-4031), амиодарон и SD-32129 повышали порог фибрилляции предсердий в разной степени.Хотя повышение порога фибрилляции предсердий, индуцированное антиаритмическими препаратами, было положительно связано с увеличением эффективного рефрактерного периода, Е-4031 обладал наименьшей активностью [7]. Эти результаты можно объяснить тем, что блокаторы натриевых каналов делают рефрактерный период более продолжительным, чем Е-4031, из-за более длительной рефрактерности после возбуждения после высокочастотной стимуляции [25]. Обратите внимание, что эффект блокировки калиевых каналов блокаторами Ikr (такими как E-4031) менее заметен, когда частота возбуждения становится выше (обратный блок, зависящий от использования [26], но см. Ohler et al [27]).При наличии в перфузирующем растворе антиаритмических препаратов было труднее вызвать повторяющиеся предсердные импульсы или мерцательную аритмию с помощью электрической стимуляции. При этом порог мерцательной аритмии был повышен.
Ohler et al [27]).При наличии в перфузирующем растворе антиаритмических препаратов было труднее вызвать повторяющиеся предсердные импульсы или мерцательную аритмию с помощью электрической стимуляции. При этом порог мерцательной аритмии был повышен.
Эффективный рефрактерный период становится короче, если к предсердию постоянно применяется быстрая стимуляция. Это явление называется «электрическим ремоделированием предсердий» [28], которое сопровождается снижением кальциевого тока L-типа и транзиторным внешним током [2,29].Также сообщалось об экспрессии новых каналов [30]. Было проведено большое количество экспериментальных исследований ремоделирования предсердий. В этих исследованиях для индукции мерцательной аритмии использовалась одиночная экстрастимуляция или импульсная стимуляция, аналогичная нашей. Однако уязвимость предсердий сравнивалась с точки зрения продолжительности индуцированной фибрилляции предсердий, но не интенсивности стимуляции. В этих исследованиях оценивали не то, насколько легко вызвать фибрилляцию предсердий, а то, насколько сложно восстановиться после аритмии.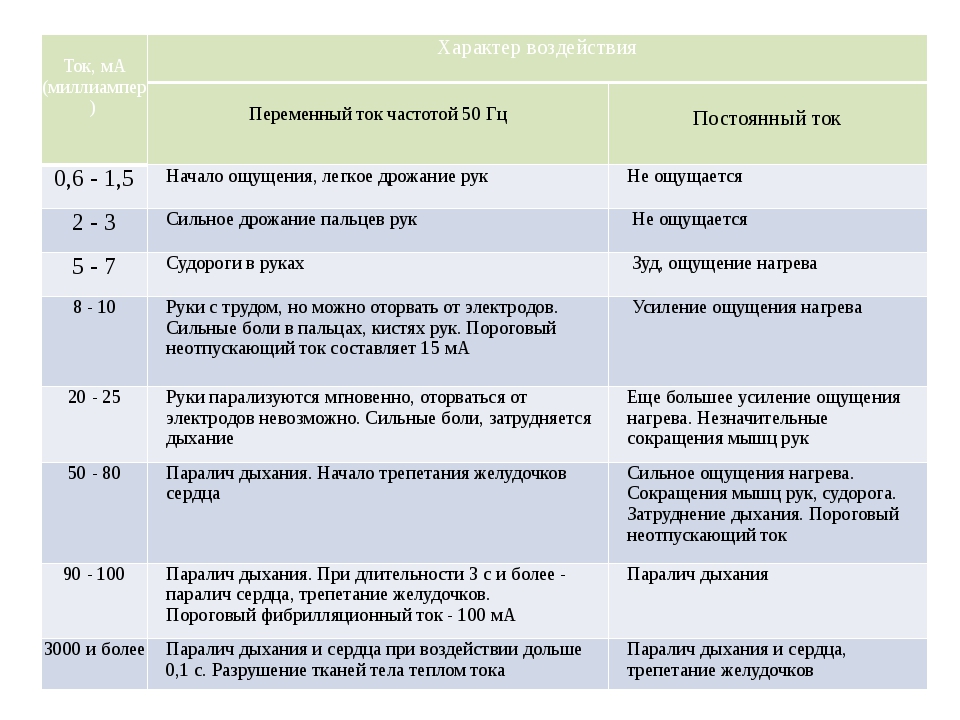 Оценка длительности аритмии выявляет ее стабильность после реализации физиолого-биохимических изменений предсердий, но не может быть пригодна для оценки склонности больных к пароксизмальному приступу мерцательной аритмии. По нашему опыту, более сильный ток в предсердие может вызвать более длительную фибрилляцию предсердий, пока ток не достигнет порога фибрилляции [12].
Оценка длительности аритмии выявляет ее стабильность после реализации физиолого-биохимических изменений предсердий, но не может быть пригодна для оценки склонности больных к пароксизмальному приступу мерцательной аритмии. По нашему опыту, более сильный ток в предсердие может вызвать более длительную фибрилляцию предсердий, пока ток не достигнет порога фибрилляции [12].
Клиническая осуществимость
Экспериментальные данные свидетельствуют о том, что измерение порога может предсказать легкость индукции мерцательной аритмии.Действительно, порог фибрилляции предсердий был ниже у пациентов с фибрилляцией предсердий в анамнезе (медиана 11 мА), чем в контрольной группе (медиана 5 мА) [12]. Когда точка отсечки была установлена на уровне 10 мА, чувствительность и специфичность составляли 94% и 60% соответственно. Эффективный рефрактерный период, время проведения или другие показатели уязвимости предсердий не отличались между двумя группами. Вторичными показателями, позволяющими отличить пациентов с фибрилляцией предсердий от здоровых людей, были % максимальной фрагментации предсердий (%MAF) и зона фрагментированной активности (FAZ) [31]. Их чувствительность и специфичность составляли 78%, 52% (%MAF) и 47%, 84% (FAZ) соответственно. %MAF — относительное увеличение ширины локальной электрограммы предсердий при дополнительной стимуляции. ФАЗ – это зона интервалов сцепления, удлиняющая локальную электрограмму предсердий на 50% и более.
Их чувствительность и специфичность составляли 78%, 52% (%MAF) и 47%, 84% (FAZ) соответственно. %MAF — относительное увеличение ширины локальной электрограммы предсердий при дополнительной стимуляции. ФАЗ – это зона интервалов сцепления, удлиняющая локальную электрограмму предсердий на 50% и более.
Порог фибрилляции предсердий (ТПФ) мог зависеть от вегетативного тонуса, поскольку инфузия изопротеренола снижала ПТП (неопубликованные данные). Данные, полученные в день установки катетеров, были ниже данных, полученных в последующие дни.Таким образом, результаты измерения следует интерпретировать с осторожностью. Однако воспроизводимость AFT была превосходной (±1 мА, r=0,95 на линии регрессии) при краткосрочном обследовании (<3 часов) или при измерении на следующий день или позже после установки катетеров.
Оценка эффективности лекарств в клинических условиях
Преимуществом измерения AFT будет количественная оценка эффективности лекарств. Антиаритмические препараты повышали AFT в целом, но повышение AFT под действием препарата было различным у отдельных пациентов. Например, прокаинамид повысил AFT на 5 мА у пациента, а пропафенон вообще не изменил AFT у того же пациента. Таким образом, мы можем разделить антиаритмические препараты на 2 группы у отдельных пациентов, т. е. препараты, которые значительно повышают AFT, и препараты, которые не повышают AFT у пациента. Эффективные препараты у одного пациента не обязательно были такими же у другого пациента. Когда точка отсечения эффективности была установлена на увеличение 5 мА, «эффективное» лекарство могло предотвратить 88% пациентов от рецидива фибрилляции предсердий по крайней мере в течение 1 года, тогда как только 13% не имели фибрилляции предсердий с «неэффективными» лекарствами. [13].Таким образом, этот метод может быть использован для подбора эффективных препаратов у конкретного пациента.
Например, прокаинамид повысил AFT на 5 мА у пациента, а пропафенон вообще не изменил AFT у того же пациента. Таким образом, мы можем разделить антиаритмические препараты на 2 группы у отдельных пациентов, т. е. препараты, которые значительно повышают AFT, и препараты, которые не повышают AFT у пациента. Эффективные препараты у одного пациента не обязательно были такими же у другого пациента. Когда точка отсечения эффективности была установлена на увеличение 5 мА, «эффективное» лекарство могло предотвратить 88% пациентов от рецидива фибрилляции предсердий по крайней мере в течение 1 года, тогда как только 13% не имели фибрилляции предсердий с «неэффективными» лекарствами. [13].Таким образом, этот метод может быть использован для подбора эффективных препаратов у конкретного пациента.
Однако прогноз эффективности не означал высокой эффективности препарата в большой популяции. Как сообщалось ранее [1,4], эффективность каждого препарата в отношении мерцательной аритмии в нашем исследовании составляла от 40 до 50%. AFT — это метод выбора полезных лекарств для конкретного пациента.
AFT — это метод выбора полезных лекарств для конкретного пациента.
Серийный электрофизиологический тест был менее рекомендован при желудочковой тахикардии, поскольку «эффективное лекарство», определяемое с точки зрения индуцируемости, не улучшало прогноз пациентов [32].С другой стороны, AFT не зависит от определения индуцируемости по типу «все или ничего», но определяет, насколько сильным является эффект препарата против аритмии. На самом деле, фибрилляция предсердий всегда индуцировалась в этом методе из-за определения AFT.
Контроль ЧСС и контроль ритма
Очевидно, что измерение AFT определяет препарат, подходящий для поддержания синусового ритма. Недавно были опубликованы результаты исследования Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) [33].Это исследование не показало преимущества поддержания синусового ритма над контролем ЧСС с точки зрения прогноза. Этот результат может свидетельствовать против полезности измерения AFT. Однако смертность пациентов, перенесших пароксизмальную фибрилляцию предсердий, относительно невелика. Наибольшее беспокойство пациентов часто вызывает его симптом. Таким образом, когда смертность не отличается, желательно выбрать менее симптоматическую жизнь. В этом смысле фармакологическое лечение антиаритмическими препаратами класса I все еще может быть терапией первой линии при «одинокой» фибрилляции предсердий.
Наибольшее беспокойство пациентов часто вызывает его симптом. Таким образом, когда смертность не отличается, желательно выбрать менее симптоматическую жизнь. В этом смысле фармакологическое лечение антиаритмическими препаратами класса I все еще может быть терапией первой линии при «одинокой» фибрилляции предсердий.
AFT в будущем
AFT является количественным маркером для выбора эффективных препаратов против мерцательной аритмии. Концепция этого метода – «медицина на заказ». Масштабное популяционное исследование позволило бы выявить общую эффективность препарата, но отрицательной стороной является пренебрежение индивидуальностью или специфичностью каждого пациента. Поскольку эффективность фармакологического и немедикаментозного лечения еще не высока, важно знать, какой метод следует применять в первую очередь. Можно сначала измерить AFT, и если удастся найти «эффективное» лекарство, пациента следует лечить по схеме.Если «эффективное» лекарство не найдено, следует рассмотреть вопрос о катетерной абляции или каком-либо другом немедикаментозном подходе.
Ссылки
- Хайри П., Наттел С. Новый взгляд на механизмы и лечение фибрилляции предсердий. CMAJ. 2002; 167:1012–1020. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Bosch RF, Nattel S. Клеточная электрофизиология мерцательной аритмии. Кардиовасц Рез. 2002; 54: 259–269. [PubMed] [Google Scholar]
- Nattel S, Li D, Yue L, et al.Основные механизмы мерцательной аритмии — очень новый взгляд на очень старые идеи. Annu Rev Physiol. 2000;62:51–77. [PubMed] [Google Scholar]
- Wijffels MC, Crijns HJ. Неинвазивные характеристики мерцательной аритмии: значение холтеровского мониторирования для лечения ФП. Карта Electrophysiol Rev. 2002; 6: 233–238. [PubMed] [Google Scholar]
- Brundel BJ, Henning RH, Kampinga HH, et al. Молекулярные механизмы ремоделирования при мерцательной аритмии человека. Кардиовасц Рез. 2002; 54: 315–324.[PubMed] [Google Scholar]
- Гаспо Р. Модель мерцательной аритмии у собак, вызванная тахикардией. Клиническая значимость и сравнение с другими моделями.
 Фармакотоксические методы. 1999; 42:11–20. [PubMed] [Google Scholar]
Фармакотоксические методы. 1999; 42:11–20. [PubMed] [Google Scholar] - Иноуэ М., Иноуэ Д., Ишибаши К. и др. Влияние Е-4031 на порог мерцательной аритмии в предсердиях морских свинок: сравнительное исследование с антиаритмическими препаратами класса I. J Cardiovasc Pharmacol. 1994; 24: 534–541. [PubMed] [Google Scholar]
- Иноуэ М., Иноуэ Д., Ишибаши К. и др.Влияние пилсикаинида на порог фибрилляции предсердий у морских свинок. Сравнительное исследование с дизопирамидом, лидокаином и флекаинидом. Jpn Heart J. 1993; 34: 301–312. [PubMed] [Google Scholar]
- Мацуо Р., Шираяма Т., Иноуэ К. и др. SD3212, новый антиаритмический препарат, повышает порог фибрилляции предсердий в изолированных сердцах кроликов. Сердечные сосуды. 1999; 14: 127–136. [PubMed] [Google Scholar]
- Шираяма Т., Сакамото Т., Ямамура М. и др. Механизм укорочения предсердного рефрактерного периода после кратковременной быстрой кардиостимуляции.В: Tse HF, Lee KL, Lau CP и др., редакторы. Клиническая кардиостимуляция и электрофизиология.
 Болонья: Редакция Мондуцци; 2003. стр. 467–470. [Google Scholar]
Болонья: Редакция Мондуцци; 2003. стр. 467–470. [Google Scholar] - Ишибаши К., Иноуэ Д., Сакаи Р. и др. Влияние дизопирамида на порог мерцательной аритмии в предсердии человека. Int J Кардиол. 1995; 52: 177–184. [PubMed] [Google Scholar]
- Inoue K, Shirayama T, Shiraishi H, et al. Клиническое значение порога мерцательной аритмии у больных с пароксизмальной мерцательной аритмией.Пейсинг Клин Электрофизиол. 2001; 24:796–805. [PubMed] [Google Scholar]
- Shirayama T, Shiraishi H, Yoshida S, et al. Порог фибрилляции предсердий предсказывал долгосрочную эффективность фармакологического лечения больных без структурной патологии сердца. Европас. 2002; 4: 383–389. [PubMed] [Google Scholar]
- Sugimoto T, Schaal SF, Wallace AG, et al. Факторы, определяющие предрасположенность к фибрилляции желудочков, индуцированной переменным током частотой 60 Гц. Цирк Рез. 1967; 21: 601–608. [PubMed] [Google Scholar]
- Тода И., Мураками Ю., Нодзаки А. и др.Порог фибрилляции желудочков, измеренный при непрерывной стимуляции 50 импульсов в секунду для оценки антифибрилляторного эффекта препаратов.
 Jpn Circ J. 1988; 52: 249–253. [PubMed] [Google Scholar]
Jpn Circ J. 1988; 52: 249–253. [PubMed] [Google Scholar] - Костис Дж. Б., Гудкинг М. Дж., Гоцояннис С. и др. Влияние лидокаина на порог мерцательной аритмии. Am Heart J. 1977; 94: 764–768. [PubMed] [Google Scholar]
- Wiggers CJ, Wegria NF. Фибрилляция желудочков из-за одиночных локализованных индукционных и конденсаторных разрядов, применяемых во время уязвимой фазы систолы желудочков.Am J Physiol. 1940; 128: 500–505. [Google Scholar]
- Wiggers CJ, Wegria R. Количественное измерение порога фибрилляции желудочков млекопитающих с наблюдениями за действием новокаина. Am J Physiol. 1940; 131: 296–308. [Google Scholar]
- Карагеузян Х.С., Чен П.С. Клеточный механизм повторного входа, вызванный сильным электрическим раздражителем: значение для фибрилляции и дефибрилляции. Кардиовасц Рез. 2001; 50: 251–262. [PubMed] [Google Scholar]
- Chen PS, Feld GK, Kriett JM, et al.Связь между верхним пределом уязвимости и порогом дефибрилляции у человека. Тираж.
 1993; 88: 186–192. [PubMed] [Google Scholar]
1993; 88: 186–192. [PubMed] [Google Scholar] - Майкельсон Э.Л., Спир Дж.Ф., Мур Нил Э. и др. Влияние прокаинамида на соотношение силовых интервалов в нормальном и хронически перенесенном инфаркте миокарда собак. Ам Джей Кардиол. 1981; 47: 1223–1232. [PubMed] [Google Scholar]
- Orias O, Gilbert JL, Siebens AA, et al. Эффективность одиночных прямоугольных электрических импульсов известной продолжительности и силы при стимуляции фибрилляции предсердий.Am J Physiol. 1950; 162: 219–225. [PubMed] [Google Scholar]
- Brooks McC C, Orias O, Gilbert JL, et al. Фибрилляция предсердий: связь «уязвимого периода» с феноменом «провала» кривой возбудимости предсердий. Am J Physiol. 1951; 164: 301–306. [PubMed] [Google Scholar]
- Шинагава К., Широшита-Такешита А., Шрам Г. и др. Влияние антиаритмических препаратов на фибрилляцию в ремоделированном предсердии: понимание механизма превосходной эффективности амиодарона. Тираж.2003; 107:1440–1446. [PubMed] [Google Scholar]
- Канки Х.
 , Митамура Х., Такацуки С. и др. Постреполяризационная рефрактерность как потенциальный антифибрилляционный механизм пилсикаинида, чистого блокатора натриевых каналов с медленной кинетикой восстановления. Сердечно-сосудистые препараты Ther. 1998; 12: 475–482. [PubMed] [Google Scholar]
, Митамура Х., Такацуки С. и др. Постреполяризационная рефрактерность как потенциальный антифибрилляционный механизм пилсикаинида, чистого блокатора натриевых каналов с медленной кинетикой восстановления. Сердечно-сосудистые препараты Ther. 1998; 12: 475–482. [PubMed] [Google Scholar] - Wettwer E, Scholtysik G, Schaad A, et al. Влияние нового антиаритмического препарата III класса Е-4031 на сократительную способность миокарда и электрофизиологические параметры.J Cardiovasc Pharmacol. 1991; 17: 480–487. [PubMed] [Google Scholar]
- Ohler A, Amos GJ, Wettwer E, et al. Частотно-зависимые эффекты E-4031, алмокаланта, дофетилида и тедисамила на продолжительность потенциала действия: нет доказательств «зависимого от обратного применения» блокады. Naunyn Schmiedebergs Arch Pharmacol. 1994; 349: 602–610. [PubMed] [Google Scholar]
- Wijffels MCEF, Kirchhof CJHJ, Dorland R, et al. Мерцательная аритмия порождает мерцательную аритмию: исследование на бодрствующих козах с хроническими инструментами.
 Тираж. 1995; 92: 1954–1968. [PubMed] [Google Scholar]
Тираж. 1995; 92: 1954–1968. [PubMed] [Google Scholar] - Allessie M, Ausma J, Schotten U, et al. Электрическое, сократительное и структурное ремоделирование при мерцательной аритмии. Кардиовасц Рез. 2002; 54: 230–246. [PubMed] [Google Scholar]
- Yamashita T, Murakawa Y, Hayami N, et al. Краткосрочные эффекты быстрой кардиостимуляции на уровень мРНК потенциал-зависимых K(+) каналов в предсердии крысы: электрическое ремоделирование при пароксизмальной предсердной тахикардии. Тираж. 2000;101:2007–2014. [PubMed] [Google Scholar]
- Охе Т., Мацухиса М., Камакура С. и др.Связь между расширением зоны фрагментированной предсердной активности и мерцательной аритмией. Ам Джей Кардиол. 1983; 52: 1219–1222. [PubMed] [Google Scholar]
- Мейсон Дж.В. Сравнение семи антиаритмических препаратов у пациентов с желудочковыми тахиаритмиями. Электрофизиологическое исследование в сравнении с исследователями электрокардиографического мониторинга. N Engl J Med. 1993; 329: 452–458.
 [PubMed] [Google Scholar]
[PubMed] [Google Scholar] - Wyse DG, Waldo AL, DiMarco JP и др. Сравнение контроля частоты и ритма у пациентов с мерцательной аритмией.N Engl J Med. 2002; 347:1825–1833. [PubMed] [Google Scholar]
Портал | Справочная информация по предельным значениям
EMF-Portal | Справочная информация о предельных значениях
×
- Домой
- Более
- Электротравмы
- Справочная информация о предельных значениях
Реакции человека на электрический ток зависят от силы и продолжительности прохождения тока через тело, а также от пути прохождения тока.Они варьируются от тонкого восприятия до фатального события, вызванного прерыванием нормальной сердечной деятельности. Для оценки возможной опасности, связанной с прохождением тока через тело, действительны следующие пороговые значения, которые зависят от различных физиологических эффектов. Пороги зависят от размера площади контакта, влажности кожи и физиологических особенностей человека. Ниже приведены определения пороговых значений:
Ниже приведены определения пороговых значений:
На следующем рисунке технической спецификации TS IEC 60479-1 (2005 г.) представлены четыре зоны тока, зависящие от продолжительности прохождения тока, которые демонстрируют различные физиологические эффекты, такие как восприятие , непроизвольные сокращения мышц или фибрилляция желудочков, которые отличаются потенциальной опасностью для человека.Цифра действительна для переменного тока (AC) в диапазоне частот 15 – 100 Гц с путем тока от левой руки к обеим ногам. Классификация зон приведена ниже:
Условные временные/текущие зоны воздействия переменного тока. токи (от 15 Гц до 100 Гц) на людей для пути тока, соответствующего левой руке к ноге (рисунок 20 DIN IEC/TS 60479-1 на немецком языке).
Рисунок 20 DIN IEC/TS 60479-1 (VDE V 0140-479-1), изд. 2007 г. на немецком языке, воспроизведено с разрешения 72.016 DIN Deutsches Institut für Normung e.V. и VDE Verband der Elektrotechnik Elektronik Informationstechnik e.V.. Для дальнейшего распространения требуется отдельное разрешение. Для применения стандартов актуальны версии последней редакции, которые доступны в VDE VERLAG GMBH, Bismarckstr. 33, 10625 Берлин, Германия, www.vde-verlag.de и Beuth Verlag GmbH, 10772 Берлин, Германия.
Для применения стандартов актуальны версии последней редакции, которые доступны в VDE VERLAG GMBH, Bismarckstr. 33, 10625 Берлин, Германия, www.vde-verlag.de и Beuth Verlag GmbH, 10772 Берлин, Германия.
Рисунок с различными опасными зонами показывает, что токи до 0,5 мА не воспринимаются или почти не воспринимаются независимо от продолжительности прохождения тока.Порог отпускания зависит от времени и находится в диапазоне от 5 мА при длительности протекания тока более 6 секунд до 200 мА при длительности 10 миллисекунд. Кроме того, на рисунке видно, что уже небольшие токи около 40 мА могут привести к фибрилляции желудочков и, следовательно, к смерти человека, если ток, протекающий через тело человека, превышает 2 секунды.
Поскольку допустимые токи тела в повседневной жизни измерить невозможно, необходимо рассчитать предельные значения допустимых напряжений прикосновения для нескольких условий переменного и постоянного тока.Требуются данные о сопротивлении тела в различных условиях (например, влажность кожи, размер площади контакта (см. Параметры воздействия электрического тока). Техническая спецификация IEC 60479-1 (2005) о возможном воздействии электрического тока на человека и домашний скот содержит необходимые данные для расчета допустимых напряжений прикосновения
Параметры воздействия электрического тока). Техническая спецификация IEC 60479-1 (2005) о возможном воздействии электрического тока на человека и домашний скот содержит необходимые данные для расчета допустимых напряжений прикосновения
Этот веб-сайт использует файлы cookie, чтобы обеспечить вам наилучшие возможности просмотра. Продолжая использовать этот веб-сайт, вы соглашаетесь с использованием нами файлов cookie.
%PDF-1.5
%
7 0 объект
>>>/BBox[0 0 579,84 766,56]/длина 116>>поток
х%=@~N(cR{!!۳-)Б[ɧ;-8
7мНэБ,сб д
конечный поток
эндообъект
5 0 объект
>>>/BBox[0 0 579,84 766,56]/длина 116>>поток
х%=@~N(cR{!!۳-)Б[ɧ;-8
7мНэБ,сб д
конечный поток
эндообъект
6 0 объект
>>>/BBox[0 0 579,84 766,56]/длина 116>>поток
х%=@~N(cR{!!۳-)Б[ɧ;-8
7мНэБ,сб д
конечный поток
эндообъект
3 0 объект
>>>/BBox[0 0 579,84 766,56]/длина 116>>поток
х%=@~N(cR{!!۳-)Б[ɧ;-8
7мНэБ,сб д
конечный поток
эндообъект
1 0 объект
>>>/BBox[0 0 579.84 766,56]/длина 116>>поток
х%=@~N(cR{!!۳-)Б[ɧ;-8
7мНэБ,сб д
конечный поток
эндообъект
4 0 объект
>>>/BBox[0 0 579,84 766,56]/длина 116>>поток
х%=@~N(cR{!!۳-)Б[ɧ;-8
7мНэБ,сб д
конечный поток
эндообъект
8 0 объект
>>>/BBox[0 0 579,84 766,56]/длина 116>>поток
х%=@~N(cR{!!۳-)Б[ɧ;-8
7мНэБ,сб д
конечный поток
эндообъект
10 0 объект
>поток
iText 4. 2.0 от 1T3XT2022-02-01T22:18:54-08:00
2.0 от 1T3XT2022-02-01T22:18:54-08:00
конечный поток
эндообъект
11 0 объект
>поток
x+
Фатальный ток | Физиотерапия
Получить помощь с доступом
Институциональный доступ
Доступ к контенту с ограниченным доступом в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту следующими способами:
Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту следующими способами:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически,
и невозможно выйти из учетной записи с проверкой подлинности IP.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения.
Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Щелкните Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- Находясь на сайте учреждения, используйте учетные данные, предоставленные вашим учреждением.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Многие общества предлагают своим членам доступ к своим журналам с помощью единого входа между веб-сайтом общества и Oxford Academic. Из журнала Oxford Academic:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом. Не используйте личную учетную запись Oxford Academic.

- После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Некоторые общества используют личные аккаунты Oxford Academic для своих членов.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные учетные записи Oxford Academic для предоставления доступа своим членам.
Институциональная администрация
Для библиотекарей и администраторов ваша личная учетная запись также предоставляет доступ к управлению институциональной учетной записью.
Здесь вы найдете параметры для просмотра и активации подписок, управления институциональными настройками и параметрами доступа, доступа к статистике использования и т. д.
д.
Просмотр ваших зарегистрированных учетных записей
Вы можете одновременно войти в свою личную учетную запись и учетную запись своего учреждения.Щелкните значок учетной записи в левом верхнем углу, чтобы просмотреть учетные записи, в которые вы вошли, и получить доступ к функциям управления учетной записью.
Выполнен вход, но нет доступа к содержимому
Oxford Academic предлагает широкий ассортимент продукции. Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ.
Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю.
Конститутивно активный ацетилхолинзависимый ток калия повышает порог дефибрилляции предсердий, благоприятствуя повторному инициированию после разряда показатель успешности дефибрилляции предсердий или aDFT, культуры фибрилляционных кардиомиоцитов предсердий (aCMC) обрабатывали тертиапином (блокатором I
K, ACh-c ) перед тем, как подвергнуть их воздействию электрического тока 25–100 В для определения DFT. Лечение тертиапином заметно повышало вероятность успеха дефибрилляции по сравнению с необработанным контролем (с 36,3 до 80,0% при 50 В и с 91,0 до 100,0% при 100 В, рис. 1d). Увеличение частоты успеха сопровождалось значительным снижением DFT с 60,0 ± 25,1 В в контрольных культурах аКМЦ (n = 33) до 35,5 ± 10,9 В в культурах аКМЦ, обработанных тертиапином (n = 10; p < 0,05) (рис. 1д).
Лечение тертиапином заметно повышало вероятность успеха дефибрилляции по сравнению с необработанным контролем (с 36,3 до 80,0% при 50 В и с 91,0 до 100,0% при 100 В, рис. 1d). Увеличение частоты успеха сопровождалось значительным снижением DFT с 60,0 ± 25,1 В в контрольных культурах аКМЦ (n = 33) до 35,5 ± 10,9 В в культурах аКМЦ, обработанных тертиапином (n = 10; p < 0,05) (рис. 1д).
Рисунок 1
Характеристика модели и влияние модуляции I K,ACh-c на aDFT.
( a ) Типичное фазово-контрастное изображение конфлюэнтного монослоя аКМЦ. ( b ) Моментальный снимок оптического сигнала с пространственной и высокочастотной фильтрацией в монослое aCMC во время стимуляции с частотой 1 Гц (левая панель), показывающий нормальный равномерно распространяющийся выпуклый волновой фронт и после пакетной стимуляции, показывающий повторный вход сложной спиральной волны в виде 2D модель AF (правая панель). ( c ) Типичный пример выходного сигнала осциллографа во время двухфазного усеченного экспоненциального удара напряжением 40 В. Пунктирная линия указывает пиковое напряжение первой фазы, используемое в дальнейшем анализе.Количественная оценка ( d ) процента успешной дефибрилляции (DF) при 50 и 100 В и ( e ) порога предсердной DF (aDFT) в контрольных и обработанных тертиапином культурах. ( f ) Вестерн-блоттинг экспрессии Kir3.4 в культурах aCMC, трансдуцированных LV.Kir3.4↓, и в контрольных культурах aCMC, трансдуцированных LV-PpLuc↓, с использованием глицеральдегид-3-фосфатдегидрогеназы в качестве контроля нагрузки. MWM: маркер молекулярной массы (числа указаны в кДа). ( г ) Количественное определение aDFT в культурах aCMC, трансдуцированных LV.PpLuc↓ или LV-Kir3.4↓. *p < 0,05 по сравнению с контролем; # p < 0,05 по сравнению с LV.PpLuc↓.
Пунктирная линия указывает пиковое напряжение первой фазы, используемое в дальнейшем анализе.Количественная оценка ( d ) процента успешной дефибрилляции (DF) при 50 и 100 В и ( e ) порога предсердной DF (aDFT) в контрольных и обработанных тертиапином культурах. ( f ) Вестерн-блоттинг экспрессии Kir3.4 в культурах aCMC, трансдуцированных LV.Kir3.4↓, и в контрольных культурах aCMC, трансдуцированных LV-PpLuc↓, с использованием глицеральдегид-3-фосфатдегидрогеназы в качестве контроля нагрузки. MWM: маркер молекулярной массы (числа указаны в кДа). ( г ) Количественное определение aDFT в культурах aCMC, трансдуцированных LV.PpLuc↓ или LV-Kir3.4↓. *p < 0,05 по сравнению с контролем; # p < 0,05 по сравнению с LV.PpLuc↓.
Блокада I
K,ACh-c снижает aDFT за счет увеличения длины волны
Чтобы выяснить механизмы, с помощью которых блокада I K,ACh-c снижает DFT, мы сначала исследовали влияние тертиапина на несколько электрофизиологических параметров (). т.е. скорость проводимости [CV], продолжительность потенциала действия [AP] при 80% реполяризации [APD 80 ], длина волны, длина цикла повторного входа и сложность).Тертиапин (n = 10) значительно увеличивал APD 80 в aCMC во время повторного входа (54,0 ± 20,7 против 25,8 ± 4,6 мс в контрольных культурах [n = 33]) (дополнительная рис. 2A, B, подтверждая наличие конститутивно активного I К,АХ в культурах аКМЦ 18 . CV во время повторного входа существенно не пострадал (9,5 ± 2,8 против 11,7 ± 2,9 см / с в контрольных культурах) (дополнительная рис. 2A, C). Следовательно, длина волны (определяемая по произведению APD и CV) была значительно увеличена при лечении тертиапином (0,0.48 ± 0,15 против 0,30 ± 0,10 см в контрольных культурах) (дополнительная рис. 2A, D). За счет этого увеличения длины волны блокада I K, ACh-c вызвала значительное увеличение длины цикла повторного входа (106,2 ± 28,5 против 61,9 ± 18,1 мс в контрольных культурах) (дополнительная рис.
т.е. скорость проводимости [CV], продолжительность потенциала действия [AP] при 80% реполяризации [APD 80 ], длина волны, длина цикла повторного входа и сложность).Тертиапин (n = 10) значительно увеличивал APD 80 в aCMC во время повторного входа (54,0 ± 20,7 против 25,8 ± 4,6 мс в контрольных культурах [n = 33]) (дополнительная рис. 2A, B, подтверждая наличие конститутивно активного I К,АХ в культурах аКМЦ 18 . CV во время повторного входа существенно не пострадал (9,5 ± 2,8 против 11,7 ± 2,9 см / с в контрольных культурах) (дополнительная рис. 2A, C). Следовательно, длина волны (определяемая по произведению APD и CV) была значительно увеличена при лечении тертиапином (0,0.48 ± 0,15 против 0,30 ± 0,10 см в контрольных культурах) (дополнительная рис. 2A, D). За счет этого увеличения длины волны блокада I K, ACh-c вызвала значительное увеличение длины цикла повторного входа (106,2 ± 28,5 против 61,9 ± 18,1 мс в контрольных культурах) (дополнительная рис. 2A, E) и снижение сложности аритмии. (2,5 ± 3,5 против 5,06 ± 5,06 PS в контрольных культурах) (дополнительная рис. 2A, F).
2A, E) и снижение сложности аритмии. (2,5 ± 3,5 против 5,06 ± 5,06 PS в контрольных культурах) (дополнительная рис. 2A, F).
Затем был построен график DFT в зависимости от CV, APD 80 , длины волны, длины цикла повторного входа или сложности.Как показано на дополнительном рисунке 3A, CV не показал какой-либо очевидной связи с DFT (R 2 = 0,12). Кроме того, как длина цикла повторного входа, так и APD 80 продемонстрировали слабую обратную (гиперболоподобную) связь с DFT (R 2 = 0,24 и 0,34 соответственно) (дополнительная рис. 3B, C). Казалось, что DFT увеличивалась в соответствии со сложностью аритмии, хотя эта корреляция была не очень сильной (R 2 = 0,51, дополнительная рис. 3D). Напротив, между длиной волны и DFT была обнаружена более очевидная связь, которая показала увеличение DFT с уменьшением длины волны (R 2 = 0.65, дополнительный рис. 3E). В совокупности эти результаты свидетельствуют о том, что блокада I K,ACh-c снижает DFT за счет увеличения длины волны во время возвратных тахиаритмий.
Эффект нокдауна
Kcnj5 на электрофизиологические параметры и aDFT
Чтобы исключить возможность того, что эффект тертиапина, снижающий DFT, был вызван другим механизмом действия, чем его способность блокировать I K,ACh-c , Экспрессия Kcnj5 в культурах aCMC специфически подавлялась РНКи с использованием LV.Кир3.4↓. После трансдукции LV.Kir3.4↓ уровни Kir3.4 снизились до 36,5 ± 3,6% от таковых в контрольных культурах, трансдуцированных LV.PpLuc↓), судя по вестерн-блоттингу (рис. 1f). Оптическое картирование этих культур во время повторного входа дало результаты, аналогичные результатам, полученным после лечения тертиапином, а именно: значительное увеличение APD 80 (дополнительная рис. 4A, B), незначительное снижение CV (дополнительная рис. 4A, C) и значительное увеличение длины волны (дополнительный рис. 4A, D) и длины цикла повторного входа (дополнительный рис.4A, E), в то время как сложность аритмии значительно уменьшилась (дополнительная рис. 4A, F). Важно отметить, что DFT также значительно уменьшился при нокдауне Kcnj5 (25,0±3,5 [n = 14] против 50,7±19,4 V в культурах, трансдуцированных LV.PpLuc↓ [n = 13]) (рис. 1g). Тенденции взаимосвязи между aDFT и CV, APD 80 , длиной волны, длиной цикла повторного входа или сложностью были аналогичны тем, которые были обнаружены в экспериментах с тертиапином, описанных на дополнительном рисунке 3 (данные не показаны).
4A, F). Важно отметить, что DFT также значительно уменьшился при нокдауне Kcnj5 (25,0±3,5 [n = 14] против 50,7±19,4 V в культурах, трансдуцированных LV.PpLuc↓ [n = 13]) (рис. 1g). Тенденции взаимосвязи между aDFT и CV, APD 80 , длиной волны, длиной цикла повторного входа или сложностью были аналогичны тем, которые были обнаружены в экспериментах с тертиапином, описанных на дополнительном рисунке 3 (данные не показаны).
Успешная дефибрилляция зависит от принудительного удаления PS
Для изучения того, как увеличение длины волны блокадой I K,ACh-c или нокдауном Kcnj5 снижает aDFT, были изучены механизмы успешной и неудачной дефибрилляции.
Во время повторного входа наблюдалась непрерывная пространственная прогрессия активации и фазы вокруг ПС (точка, окруженная полным циклом фазы [2π]) 21 (рис. 2а, б, левые изображения), сохраняющая оба ПС и, как следствие, реципрокная тахиаритмия. После воздействия на такую культуру высокоэнергетическим электрическим током эта непрерывная пространственная прогрессия активации была нарушена за счет одновременной деполяризации больших участков культуры (рис. 2а, правое изображение; рис.2в, красная стрелка). Как следствие, электрический шок заставил все клетки перейти в одну и ту же фазу ПД (рис. 2б, средний рисунок; рис. 2г, красная и зеленая стрелки), нарушив конвергенцию фазы 2π, необходимую для поддержания ПС. Следовательно, после синхронной реполяризации (рис. 2b, правое изображение; рис. 2c) повторный вход был полностью прекращен (дополнительный фильм 1).
2а, правое изображение; рис.2в, красная стрелка). Как следствие, электрический шок заставил все клетки перейти в одну и ту же фазу ПД (рис. 2б, средний рисунок; рис. 2г, красная и зеленая стрелки), нарушив конвергенцию фазы 2π, необходимую для поддержания ПС. Следовательно, после синхронной реполяризации (рис. 2b, правое изображение; рис. 2c) повторный вход был полностью прекращен (дополнительный фильм 1).
Рисунок 2
Успешная дефибрилляция.
( a,b ) Типичная активационная ( a ) и фазовая ( b ) последовательность карты культуры предсердий, демонстрирующая однороторную тахиаритмию до (слева), во время (в середине) и после (справа) воздействие электрического тока выше ТПФ.Для упрощения интерпретации результатов был выбран пример ограниченной сложности. Белые стрелки и кружки указывают направление распространения AP и расположение PS соответственно. +: сторона катода первой фазы. –: сторона анода первой фазы. ( c ) Линейный анализ «оптических точек доступа» (слева) и отфильтрованных оптических сигналов (справа) (между точками I и II на подрисунке b ), показывающий синхронизацию деполяризации после применения электрического шока (указано красной стрелкой).Пунктирная белая линия указывает на положение функционального ядра повторного входа. Цветная полоса под осью X соответствует полосе на подрисунке и . ( d ) График фазы в четырех точках, равномерно расположенных вокруг PS (точки A, B, C и D на подрисунке b ) до, во время и после применения электрического тока (указано красной стрелкой) , показывающий полностью асинхронное развитие фаз до, но полную синхронизацию всех фаз (зеленая стрелка) после нанесения удара электрическим током.
( c ) Линейный анализ «оптических точек доступа» (слева) и отфильтрованных оптических сигналов (справа) (между точками I и II на подрисунке b ), показывающий синхронизацию деполяризации после применения электрического шока (указано красной стрелкой).Пунктирная белая линия указывает на положение функционального ядра повторного входа. Цветная полоса под осью X соответствует полосе на подрисунке и . ( d ) График фазы в четырех точках, равномерно расположенных вокруг PS (точки A, B, C и D на подрисунке b ) до, во время и после применения электрического тока (указано красной стрелкой) , показывающий полностью асинхронное развитие фаз до, но полную синхронизацию всех фаз (зеленая стрелка) после нанесения удара электрическим током.
Соответственно, после воздействия на культуру разряда ниже ТПФ купирование аритмии не удалось вследствие неполной синхронизации фаз вокруг ФС, препятствовавшей ее окончательному удалению. В этих случаях электрический шок по-прежнему вызывал одновременную активацию больших участков культур (рис. 3а, в), нарушая непрерывную пространственную (рис. 3а, б) и временную (рис. 3г) прогрессию активации и фазы вокруг очага. PS. Однако отслеживание пространственного и временного фазового хода показало неполную синхронизацию фаз (точка Б на рис.3b, d) после низкоэнергетического шока, вызывающего сохранение PS и отказ дефибрилляции (дополнительный фильм 2).
3а, в), нарушая непрерывную пространственную (рис. 3а, б) и временную (рис. 3г) прогрессию активации и фазы вокруг очага. PS. Однако отслеживание пространственного и временного фазового хода показало неполную синхронизацию фаз (точка Б на рис.3b, d) после низкоэнергетического шока, вызывающего сохранение PS и отказ дефибрилляции (дополнительный фильм 2).
Рисунок 3
Неудачная дефибрилляция из-за неполного удаления PS.
( a,b ) Типичная активационная ( a ) и фазовая ( b ) последовательность карт предсердной культуры, демонстрирующая однороторную тахиаритмию до (слева), во время (в середине) и после (справа) воздействия к поражению электрическим током ниже ТПФ. Для упрощения интерпретации результатов был выбран пример ограниченной сложности.( c ) Линейный анализ «оптических ПД» и отфильтрованных оптических сигналов (между точками I и II на подрисунке b ), показывающий синхронизацию деполяризации во время применения электрического шока (указано красной стрелкой). ( d ) График фазы в четырех точках, равномерно расположенных вокруг PS (точки A, B, C и D на подрисунке b ) до, во время и после применения электрического тока (указано красной стрелкой) , показывающий асинхронное развитие фазы до и неполную синхронизацию всех фаз (зеленая стрелка), в основном в точке B, после нанесения удара электрическим током, что приводит к продолжению асинхронного развития фазы.Обозначения те же, что и на рис. 2.
( d ) График фазы в четырех точках, равномерно расположенных вокруг PS (точки A, B, C и D на подрисунке b ) до, во время и после применения электрического тока (указано красной стрелкой) , показывающий асинхронное развитие фазы до и неполную синхронизацию всех фаз (зеленая стрелка), в основном в точке B, после нанесения удара электрическим током, что приводит к продолжению асинхронного развития фазы.Обозначения те же, что и на рис. 2.
Неудачная дефибрилляция, вызванная постшоковым образованием ПС
Интересно, что применение электрошока к культурам аКМС во время фибрилляции при напряжениях, устраняющих все ПС, имевшиеся до разряда, не обязательно приводило к к успешной дефибрилляции. В таких случаях постепенная пространственная прогрессия активации и фазы, существовавшей до шока (рис. 4а, б, левые изображения), снова прерывалась одновременной активацией больших участков культуры, что приводило к фазовой синхронизации и устранению существующих ПС ( Инжир. 4б, средний рисунок; Рис. 4c,d, зеленые стрелки и рис. 5a). Однако, если сила удара была ниже DFT, новые ФС формировались в культуре до ее полной реполяризации. Вновь сформированные PS снова вызвали повторную активацию, восстановив фибрилляцию по другому образцу активации (повторная инициация), что привело к неудачной попытке дефибрилляции (рис. 4a, b, правые изображения; рис. 4c, d; дополнительный фильм 3).
4б, средний рисунок; Рис. 4c,d, зеленые стрелки и рис. 5a). Однако, если сила удара была ниже DFT, новые ФС формировались в культуре до ее полной реполяризации. Вновь сформированные PS снова вызвали повторную активацию, восстановив фибрилляцию по другому образцу активации (повторная инициация), что привело к неудачной попытке дефибрилляции (рис. 4a, b, правые изображения; рис. 4c, d; дополнительный фильм 3).
Рисунок 4
Неудачная дефибрилляция, вызванная повторным запуском.
( a,b ) Типичная активационная ( a ) и фазовая ( b ) последовательность карты предсердной культуры до (слева), во время (в центре) и после (справа) воздействия электрического тока ниже ДПФ.( c ) График фазы в четырех точках (A, B, C и D на подрисунке b ), равномерно расположенных вокруг PS, который устраняется электрическим током, и в четырех точках (E, F, G и H на подрисунке б ) вокруг ПС, возникающего после применения электрошока (указано красной стрелкой). В точках A, B, C и D показано асинхронное прохождение фаз до и полная синхронизация всех фаз после нанесения удара электрическим током (зеленая стрелка), за которым последовало прохождение фаз, синхронизированное в точках A и D и B и C из-за распространения ПД от разные ПС.До применения электрического тока в точках E, F, G и H наблюдалось фазовое развитие, синхронизированное в точках E и H и F и G вследствие распространения ПД от близлежащего ИП. Нанесение электрошока приводило к полной синхронизации всех фаз (зеленая стрелка), после чего прогрессирование фаз происходило асинхронно вследствие возникновения ПС между этими точками. Символы такие же, как на рис. 2.
В точках A, B, C и D показано асинхронное прохождение фаз до и полная синхронизация всех фаз после нанесения удара электрическим током (зеленая стрелка), за которым последовало прохождение фаз, синхронизированное в точках A и D и B и C из-за распространения ПД от разные ПС.До применения электрического тока в точках E, F, G и H наблюдалось фазовое развитие, синхронизированное в точках E и H и F и G вследствие распространения ПД от близлежащего ИП. Нанесение электрошока приводило к полной синхронизации всех фаз (зеленая стрелка), после чего прогрессирование фаз происходило асинхронно вследствие возникновения ПС между этими точками. Символы такие же, как на рис. 2.
Рис. 5
Относительная роль повторного инициирования при неудачной дефибрилляции.
( a ) Линейный анализ «оптических ПД» (слева) и отфильтрованных оптических сигналов (справа), показывающий синхронизацию деполяризации во время применения электрического шока (указано красной стрелкой).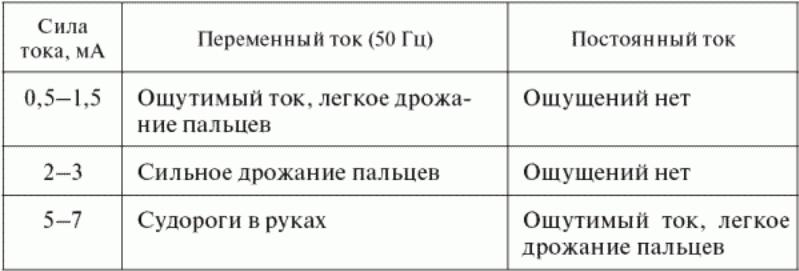 Точки I и II соответствуют точкам I и II на рис. 4б. Пунктирные белые линии указывают на положение функциональных ядер повторного входа. Цветная полоса под осью X соответствует полосе на рисунке 5а. ( b ) Количественное определение максимального напряжения во время протокола добавочного разряда 25–100 В, при котором дефибрилляция не удалась из-за неудачного удаления фазовой сингулярности (PS) или формирования PS после разряда, что привело к повторному инициированию повторного входа.*p < 0,05 по сравнению с неудачной синхронизацией.
Точки I и II соответствуют точкам I и II на рис. 4б. Пунктирные белые линии указывают на положение функциональных ядер повторного входа. Цветная полоса под осью X соответствует полосе на рисунке 5а. ( b ) Количественное определение максимального напряжения во время протокола добавочного разряда 25–100 В, при котором дефибрилляция не удалась из-за неудачного удаления фазовой сингулярности (PS) или формирования PS после разряда, что привело к повторному инициированию повторного входа.*p < 0,05 по сравнению с неудачной синхронизацией.
Важно отметить, что сбой дефибрилляции в результате повторного инициирования был обнаружен при значительно более высоких напряжениях (, например, ближе к ТПФ), чем сбой дефибрилляции, вызванный неудачным удалением PS (58,6 ± 21,6 против 34,5 ± 8,2 В). (рис. 5б). Это указывает на то, что из механизмов, ответственных за неудачную дефибрилляцию, повторное инициирование более важно для настройки DFT. Вместе эти результаты позволяют предположить, что увеличение длины волны с помощью блокады I K,ACh-c может уменьшить DFT путем подавления возникновения постшокового формирования PS.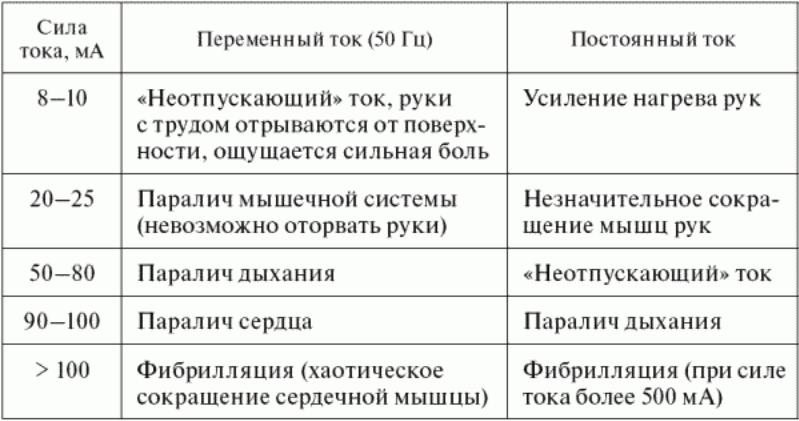
Механизм повторной инициации после разряда
Для выяснения механизма, лежащего в основе постшокового образования PS, мы сначала подвергли контрольные культуры предсердий (n = 10) разрядам напряжением 25–100 В без предварительной индукции повторного входа или электрической стимуляции. Ни в одной из этих культур не наблюдалось появления PS после шока (дополнительная рис. 5A, B), что исключает протокол или конфигурацию шока как причину повторного входа в систему после шока.
Далее мы исследовали реполяризацию фибриллирующих контрольных или обработанных тертиапином культур после применения разрядов с величиной ниже ДПФ, установленной для контрольных условий ( i.е. 30 В). Это показало, что положение вновь образованных ПС совпадало с самыми крутыми градиентами APD после удара, при этом фронт возвратной волны после удара перемещался от области самой поздней к области самой ранней реполяризации (рис. 6а). Было обнаружено, что дисперсия продолжительности ПД, вызванного ударом, значительно выше при самых коротких интервалах между пиками до удара и после удара (рис. 6б, г). Блокада I K,ACh-c тертиапином не предотвращала дисперсии реполяризации таких индуцированных ударом ПД (рис.6в,г). Фактически, дисперсия APD после шока в культурах, обработанных тертиапином, была значительно выше при диастолических интервалах от 18 до 42 мс (рис. 7d). Тем не менее, максимальная дисперсия APD после шока (90 277, т.е. 90 278 при самом коротком диастолическом интервале) существенно не отличалась между контрольными культурами и культурами, обработанными тертиапином. Поэтому, чтобы активно оценить вклад дисперсии APD в повторную инициацию, мы создали постоянные неоднородности реполяризации в культурах aCMC, трансдуцируя левую половину культур LV.Kir3.4↓ (или LV.PpLuc↓ в качестве контроля), оставляя правую половину культур нетрансдуцированными, как описано в дополнительных онлайн-материалах (дополнительные рисунки 6, 7). Интересно, что такое пространственно определенное подавление Kir3.4 значительно снизило порог дефибрилляции (29,2 ± 4,6 против 41,1 ± 13,5 В в гетерогенно трансдуцированных PpLuc↓ контрольных культурах) (дополнительная рис.
6б, г). Блокада I K,ACh-c тертиапином не предотвращала дисперсии реполяризации таких индуцированных ударом ПД (рис.6в,г). Фактически, дисперсия APD после шока в культурах, обработанных тертиапином, была значительно выше при диастолических интервалах от 18 до 42 мс (рис. 7d). Тем не менее, максимальная дисперсия APD после шока (90 277, т.е. 90 278 при самом коротком диастолическом интервале) существенно не отличалась между контрольными культурами и культурами, обработанными тертиапином. Поэтому, чтобы активно оценить вклад дисперсии APD в повторную инициацию, мы создали постоянные неоднородности реполяризации в культурах aCMC, трансдуцируя левую половину культур LV.Kir3.4↓ (или LV.PpLuc↓ в качестве контроля), оставляя правую половину культур нетрансдуцированными, как описано в дополнительных онлайн-материалах (дополнительные рисунки 6, 7). Интересно, что такое пространственно определенное подавление Kir3.4 значительно снизило порог дефибрилляции (29,2 ± 4,6 против 41,1 ± 13,5 В в гетерогенно трансдуцированных PpLuc↓ контрольных культурах) (дополнительная рис. 7F). Более того, анализ области первой активации после применения разрядов ниже ТПФ показал, что эти участки были обнаружены только в нетрансдуцированной части (область I) ЛЖ.Kir3.4↓-трансдуцированные культуры aCMC (n = 10) (дополнительная рис. 7G). Для сравнения, в культурах, обработанных LV.PpLuc↓, не было обнаружено явного предпочтения в отношении места повторной инициации, т.е. 40% первых ПД после шока возникали в нетрансдуцированной области (область I) по сравнению с 10% и 20% в пограничной зоне (область II) и трансдуцированной области (область III) соответственно; n = 10) (дополнительный рис. 7G). Вместе эти результаты предполагают, что повторная инициация и предотвращение повторной инициации с помощью ингибирования I K, ACh-c не обусловлены гетерогенностью реполяризации в нашей модели.
7F). Более того, анализ области первой активации после применения разрядов ниже ТПФ показал, что эти участки были обнаружены только в нетрансдуцированной части (область I) ЛЖ.Kir3.4↓-трансдуцированные культуры aCMC (n = 10) (дополнительная рис. 7G). Для сравнения, в культурах, обработанных LV.PpLuc↓, не было обнаружено явного предпочтения в отношении места повторной инициации, т.е. 40% первых ПД после шока возникали в нетрансдуцированной области (область I) по сравнению с 10% и 20% в пограничной зоне (область II) и трансдуцированной области (область III) соответственно; n = 10) (дополнительный рис. 7G). Вместе эти результаты предполагают, что повторная инициация и предотвращение повторной инициации с помощью ингибирования I K, ACh-c не обусловлены гетерогенностью реполяризации в нашей модели.
Рисунок 6
Неоднородности реполяризации и неудачная дефибрилляция.
( a ) Карта продолжительности ПД до 80% реполяризации (APD 80 ) (левая панель) индуцированного ударом ПД и фазовая карта (правая панель) контрольной культуры непосредственно после нанесения электрического разряда, показывающая, что места самых крутых градиентов APD/реполяризации совпадают с областями формирования PS непосредственно после шока. Увеличенная область (красный квадрат) карты реполяризации (верхняя правая панель) указывает APD и направление распространения AP, идущее от области последней реполяризации к области самой ранней реполяризации (белая стрелка).( b ) Наложение областей с PPI от 6 до 12 мс (серая штриховка) и карта APD 80 , показывающая, что области с крутыми градиентами APD попадают в области с самыми короткими PPI. ( c ) Карта реполяризации (левая панель) индуцированного шоком AP в культуре, обработанной тертиапином. ( d ) Количественная оценка дисперсии APD 80 AP, индуцированных электрическим током 30 В, в обработанных тертиапином и контрольных культурах при PPI от 12 до 42 мс.
Увеличенная область (красный квадрат) карты реполяризации (верхняя правая панель) указывает APD и направление распространения AP, идущее от области последней реполяризации к области самой ранней реполяризации (белая стрелка).( b ) Наложение областей с PPI от 6 до 12 мс (серая штриховка) и карта APD 80 , показывающая, что области с крутыми градиентами APD попадают в области с самыми короткими PPI. ( c ) Карта реполяризации (левая панель) индуцированного шоком AP в культуре, обработанной тертиапином. ( d ) Количественная оценка дисперсии APD 80 AP, индуцированных электрическим током 30 В, в обработанных тертиапином и контрольных культурах при PPI от 12 до 42 мс.
Рисунок 7
Неоднородности деполяризации и неудачная дефибрилляция.
( a ) Карта амплитуды ПД, индуцированного ударом, без (левая панель) или с наложением областей с ИЦП от 6 до 12 мс (серая штриховка; средняя панель) и фазовая карта контрольная культура сразу после нанесения 30-вольтового электрического разряда, показывающая совместную локализацию коротких PPI, низкие амплитуды ПД, вызванные ударом, и места появления постшокового PS. ( b ) Карта амплитуды индуцированного шоком ПД культуры, обработанной тертиапином. ( c ) Количественная оценка индуцированной ударом амплитуды ПД в контрольных и обработанных тертиапином культурах при ИПП от 12 до 42 мс.( d ) Отфильтрованные оптические сигналы между точками I и II, изображенные на подрисунке ( a ), демонстрирующие нарушение вызванной ударом деполяризации вблизи точки II, что приводит к распространению фронта волны ПД, вызванной ударом, к точке II (направление обозначено синим цветом). стрелка и белая стрелка в A). ( e ) Отфильтрованные оптические сигналы между точками I и II, изображенные на подрисунке (b ), демонстрирующие блок проводимости (обозначенный двойными синими линиями и двойными белыми линиями на A) индуцированного ударом переднего фронта волны на реполяризующей обратной волне предшоковой активации между областями большой и нарушенной шок-индуцированной деполяризации.
( b ) Карта амплитуды индуцированного шоком ПД культуры, обработанной тертиапином. ( c ) Количественная оценка индуцированной ударом амплитуды ПД в контрольных и обработанных тертиапином культурах при ИПП от 12 до 42 мс.( d ) Отфильтрованные оптические сигналы между точками I и II, изображенные на подрисунке ( a ), демонстрирующие нарушение вызванной ударом деполяризации вблизи точки II, что приводит к распространению фронта волны ПД, вызванной ударом, к точке II (направление обозначено синим цветом). стрелка и белая стрелка в A). ( e ) Отфильтрованные оптические сигналы между точками I и II, изображенные на подрисунке (b ), демонстрирующие блок проводимости (обозначенный двойными синими линиями и двойными белыми линиями на A) индуцированного ударом переднего фронта волны на реполяризующей обратной волне предшоковой активации между областями большой и нарушенной шок-индуцированной деполяризации.
Впоследствии, чтобы активно оценить роль индуцированной ударом деполяризации в повторном инициировании, мы количественно оценили влияние ИПП на амплитуду индуцированных ударом ПД при 30 В (, т. е. ниже среднего ДПФ) и при 90°С. V (, т.е. выше среднего ДПФ) во время фибрилляции. Амплитуды ПД, вызванные ударом, были значительно выше при 90 В, чем при 30 В (дополнительная рис. 8А). Амплитуда ПД, вызванная ударом, значительно уменьшилась с уменьшением PPI при обоих напряжениях (дополнительный рис.8А). Интересно, что разряды 90 В сглаживали кривую зависимости между ИПП и амплитудой по сравнению с разрядами 30 В (n = 6 культур на группу), что связано с его повышенным влиянием на относительную рефрактерную ткань при коротких ИПП. Соответственно, в отсутствие повторного входа или до электрической стимуляции не было различий в амплитуде ПД, вызванной разрядом 30 или 90 В (дополнительная рис. 8B, n = 6 культур на группу), в то время как функциональное ядро возвратной спирали волны не влияли на деполяризацию, индуцированную ударом (судя по влиянию расстояния до ПС на локальную амплитуду ПД, индуцированную ударом, дополнительный рис.8C, n = 6 культур на группу).
е. ниже среднего ДПФ) и при 90°С. V (, т.е. выше среднего ДПФ) во время фибрилляции. Амплитуды ПД, вызванные ударом, были значительно выше при 90 В, чем при 30 В (дополнительная рис. 8А). Амплитуда ПД, вызванная ударом, значительно уменьшилась с уменьшением PPI при обоих напряжениях (дополнительный рис.8А). Интересно, что разряды 90 В сглаживали кривую зависимости между ИПП и амплитудой по сравнению с разрядами 30 В (n = 6 культур на группу), что связано с его повышенным влиянием на относительную рефрактерную ткань при коротких ИПП. Соответственно, в отсутствие повторного входа или до электрической стимуляции не было различий в амплитуде ПД, вызванной разрядом 30 или 90 В (дополнительная рис. 8B, n = 6 культур на группу), в то время как функциональное ядро возвратной спирали волны не влияли на деполяризацию, индуцированную ударом (судя по влиянию расстояния до ПС на локальную амплитуду ПД, индуцированную ударом, дополнительный рис.8C, n = 6 культур на группу).
Важно отметить, что области возникновения ПС после электрошока также совмещены с (границами) областями наименьшей амплитуды ударно-индуцированного ПД (, т. е. в областях с наименьшими ИПП) (рис. 7а), с проведение индуцированного ударом волнового фронта ПД, направленного от сильно деполяризованных к неполностью деполяризованным областям (рис. 7а, г). Тертиапин не оказывал значимого влияния на амплитуду ПД, индуцированную ударом (рис. 7в). Однако, как и при разрядах высокого напряжения, лечение тертиапином показало тенденцию к уплощению кривой зависимости между ИПП и амплитудой ПД, индуцированной разрядом (рис.7в). Более того, в зонах гетерогенной индуцированной ударом деполяризации в культурах, обработанных тертиапином, индуцированный ударом волновой фронт ПД блокировался на рефрактерном хвосте предшоковой активации вследствие тертиапин-зависимого увеличения длины волны (рис. 7д). .
е. в областях с наименьшими ИПП) (рис. 7а), с проведение индуцированного ударом волнового фронта ПД, направленного от сильно деполяризованных к неполностью деполяризованным областям (рис. 7а, г). Тертиапин не оказывал значимого влияния на амплитуду ПД, индуцированную ударом (рис. 7в). Однако, как и при разрядах высокого напряжения, лечение тертиапином показало тенденцию к уплощению кривой зависимости между ИПП и амплитудой ПД, индуцированной разрядом (рис.7в). Более того, в зонах гетерогенной индуцированной ударом деполяризации в культурах, обработанных тертиапином, индуцированный ударом волновой фронт ПД блокировался на рефрактерном хвосте предшоковой активации вследствие тертиапин-зависимого увеличения длины волны (рис. 7д). .
В совокупности эти результаты позволяют предположить, что неудачная дефибрилляция из-за повторного инициирования вызвана гетерогенной деполяризацией как следствием нарушения деполяризации ткани при коротких ИПП. Это вызывает крутые градиенты мембранного потенциала после удара, которые позволяют однонаправленному распространению ПД, вызванного ударом, в этих критических областях. Блокада I K,ACh-c притупляет неоднородность деполяризации, вызванную разрядами низкого напряжения, и подавляет однонаправленное распространение индуцированных разрядом ПД за счет увеличения длины волны, что предотвращает повторную инициацию и снижает ДПФ.
Блокада I K,ACh-c притупляет неоднородность деполяризации, вызванную разрядами низкого напряжения, и подавляет однонаправленное распространение индуцированных разрядом ПД за счет увеличения длины волны, что предотвращает повторную инициацию и снижает ДПФ.
Эффект блокады I
K,ACh-c при электрической кардиоверсии всего сердца механизмы, определяющие aDFT.Однако, чтобы подтвердить эффект снижения aDFT блокады I K,ACh-c в более сложных и клинически значимых трехмерных условиях, мы изучили эффект блокады I K,ACh-c тертиапином во время картирования всего сердца ( Рис. 8а). Действительно, при самой низкой энергии дефибрилляции (30 В) в контрольных сердцах наблюдалась неудачная дефибрилляция. Повторное инициирование фибрилляции было основным механизмом неудачной дефибрилляции, поскольку после удара электрическим током можно было наблюдать заметное изменение длины цикла, что позволяет предположить, что последующая фибрилляция поддерживалась другим путем повторного входа (рис. 8б). После лечения тертиапином сердца демонстрировали сильное увеличение предсердной APD и длины цикла после индукции ФП (рис. 8c) и демонстрировали прекращение ФП с помощью ECV при самом низком напряжении (30 V). Как и ожидалось из экспериментов in vitro с , тертиапин явно снижал порог ECV (36,1 ± 11,3 против 27,2 ± 0,66 В в необработанных контрольных сердцах) (рис. 8d), в то время как вероятность успеха ECV при разрядах 30 В была увеличена на 60 % (100% против 40% в контрольных сердцах) (рис. 8e). В совокупности эти результаты подтверждают мнение о том, что I K,ACh-c повышает порог ECV и снижает вероятность успешной дефибрилляции предсердий во всем сердце.
8б). После лечения тертиапином сердца демонстрировали сильное увеличение предсердной APD и длины цикла после индукции ФП (рис. 8c) и демонстрировали прекращение ФП с помощью ECV при самом низком напряжении (30 V). Как и ожидалось из экспериментов in vitro с , тертиапин явно снижал порог ECV (36,1 ± 11,3 против 27,2 ± 0,66 В в необработанных контрольных сердцах) (рис. 8d), в то время как вероятность успеха ECV при разрядах 30 В была увеличена на 60 % (100% против 40% в контрольных сердцах) (рис. 8e). В совокупности эти результаты подтверждают мнение о том, что I K,ACh-c повышает порог ECV и снижает вероятность успешной дефибрилляции предсердий во всем сердце.
Рисунок 8
Подтверждение ex vivo роли I K,ACh-c в определении aDFT.
( a ) Пример сердца новорожденной крысы в установке картирования ex vivo перед началом протокола индукции ФП. Типичные желудочковые (V) и предсердные ( b ) однопиксельные записи ( b ) контроля (n = 6, 16,7% неиндуцируемые) и ( c ) леченного тертиапином (n = 7, 57,1% неиндуцируемое) сердце. Красные стрелки указывают момент применения электрического тока.Обратите внимание на увеличение частоты активации предсердий после применения электрического тока в контрольном сердце. Количественная оценка ( d ) порога дефибрилляции предсердий (aDFT) и ( e ) частоты успешных результатов электрической кардиоверсии (ECV) после нанесения 30-вольтового электрического разряда в контрольных и леченных тертиапином сердцах. а.е.: условные единицы.
Красные стрелки указывают момент применения электрического тока.Обратите внимание на увеличение частоты активации предсердий после применения электрического тока в контрольном сердце. Количественная оценка ( d ) порога дефибрилляции предсердий (aDFT) и ( e ) частоты успешных результатов электрической кардиоверсии (ECV) после нанесения 30-вольтового электрического разряда в контрольных и леченных тертиапином сердцах. а.е.: условные единицы.
Macroshock — обзор | ScienceDirect Topics
Опасность поражения электрическим током
Пациенты под наркозом в операционной особенно уязвимы для поражения электрическим током.Они без одежды, мокрые, окружены электрическими устройствами и подключены к ним, и не могут оторваться от электрических контактов или дать понять, что они подвергаются поражению электрическим током.
Если часть человеческого тела замыкает (т. е. замыкает) электрическую цепь, повреждающее действие электричества может возникать в результате энергии, передаваемой электричеством (например, вызывая ожоги), или в результате воздействия на электрофизиологические свойства ткани, особенно нервная и мышечная ткань (включая миокард, центральную нервную систему и скелетные мышцы). Степень повреждения, если таковое имеется, зависит от продолжительности воздействия, напряжения, силы тока, частоты и плотности тока (количество тока на единицу площади). Нервно-мышечная ткань особенно чувствительна к стимуляции электричеством из стандартных электрических розеток (например, в Соединенных Штатах от переменного тока с частотой 60 Гц). Электричество очень высоких частот не вызывает стимуляции нервно-мышечной ткани. Электрокоагуляторы используют сверхвысокие частоты, чтобы избежать опасной стимуляции электрически чувствительных тканей.
Степень повреждения, если таковое имеется, зависит от продолжительности воздействия, напряжения, силы тока, частоты и плотности тока (количество тока на единицу площади). Нервно-мышечная ткань особенно чувствительна к стимуляции электричеством из стандартных электрических розеток (например, в Соединенных Штатах от переменного тока с частотой 60 Гц). Электричество очень высоких частот не вызывает стимуляции нервно-мышечной ткани. Электрокоагуляторы используют сверхвысокие частоты, чтобы избежать опасной стимуляции электрически чувствительных тканей.
Макрошок возникает при протекании электрического тока через тело, обычно от места проникновения через кожу к месту выхода через кожу. Повреждение может произойти, когда ток проходит через сердце, электрически стимулируя сердце. Поскольку ток распределяется по большей площади поперечного сечения, для нанесения серьезных травм требуется значительный ток. На рис. P3.5 показано повреждающее воздействие различных токов при частоте переменного тока 60 Гц. Сухая кожа имеет типичное сопротивление около 50 000 Ом, что приводит к току 2.4 мА, если макрошок вызван электричеством из розетки 120В, 60Гц. 1 Это выше порога восприятия, но в большинстве случаев не вызывает повреждений. Влажная кожа и электроды снижают сопротивление кожи примерно до 1000 Ом, что приводит к току 120 мА при тех же условиях, что находится в пределах диапазона, который, как известно, вызывает фибрилляцию желудочков.
Сухая кожа имеет типичное сопротивление около 50 000 Ом, что приводит к току 2.4 мА, если макрошок вызван электричеством из розетки 120В, 60Гц. 1 Это выше порога восприятия, но в большинстве случаев не вызывает повреждений. Влажная кожа и электроды снижают сопротивление кожи примерно до 1000 Ом, что приводит к току 120 мА при тех же условиях, что находится в пределах диапазона, который, как известно, вызывает фибрилляцию желудочков.
Обычно электричество, подаваемое через стандартные электрические розетки, имеет заземление (т. е. между «горячим» проводом и землей или землей имеется напряжение 120 В).Если цепь с высоким сопротивлением непреднамеренно замыкается между человеком и электрической розеткой, ток может протекать через заземляющий провод с более низким сопротивлением (а также отключать автоматический выключатель, блокируя протекание тока). По тем же причинам большинство металлических корпусов электроприборов также заземлены. В случае неисправной проводки большая часть электрического тока будет проходить через заземляющий провод, а не через отдельный контакт с металлическим корпусом. Во многих макрошоковых ситуациях человек подключается к горячему проводу и одновременно касается земли.Вот почему важно избегать заземления пациента (например, запрещая пациенту прикасаться к заземленному металлическому оборудованию).
Во многих макрошоковых ситуациях человек подключается к горячему проводу и одновременно касается земли.Вот почему важно избегать заземления пациента (например, запрещая пациенту прикасаться к заземленному металлическому оборудованию).
В изолированных электрических системах провод под напряжением не имеет отношения к земле (т. е. даже если бы человек одновременно коснулся провода под напряжением и земли, ток не протекал бы). В некоторых операционных, где очень трудно полностью избежать «касания» пациента земли, использование изолированной электрической системы обеспечивает дополнительную безопасность.В этих системах электроэнергия подается через «изолирующий трансформатор», который изолирует («не заземляет») электроэнергию от земли. Монитор изоляции линии постоянно контролирует целостность этой изоляции и сообщает о величине тока утечки, которая может возникнуть в случае неисправности устройств или проводки.
Микрошок Повреждение возникает вследствие подачи электрического тока непосредственно в ткань миокарда (например, через катетер легочной артерии, заполненный раствором электролита). Из-за большей плотности тока в непосредственной близости от восприимчивой ткани достаточно гораздо меньших токов, чтобы вызвать неблагоприятные эффекты. Фибрилляция желудочков может быть вызвана микрошоковыми токами силой до 100 мкА. Минимально допустимый ток микроудара менее 10 мкА. Протекание тока, достаточное для травмы, может происходить отчасти потому, что цепи, участвующие в микрошоке, обычно имеют низкое сопротивление.
Из-за большей плотности тока в непосредственной близости от восприимчивой ткани достаточно гораздо меньших токов, чтобы вызвать неблагоприятные эффекты. Фибрилляция желудочков может быть вызвана микрошоковыми токами силой до 100 мкА. Минимально допустимый ток микроудара менее 10 мкА. Протекание тока, достаточное для травмы, может происходить отчасти потому, что цепи, участвующие в микрошоке, обычно имеют низкое сопротивление.
Опасность поражения электрическим током при электрокоагуляции часто связана с неправильным контактом возвратной пластины с пациентом или ее отсоединением.Во время правильной работы ток проходит от кончика электрокоагулятора через тело и выходит из тела через возвратную пластину. Возвратная площадка имеет большую конструкцию, поэтому плотность тока (количество электрического тока на квадратный сантиметр) в месте выхода уменьшается, что снижает тепло, выделяемое при протекании тока. Если часть возвратной площадки отсоединена от пациента, весь ток протекает через меньшую область, которая касается пациента. Плотность тока в этой области намного выше нормы и может привести к ожогам.Если соединение с возвратной пластиной нарушено, ток от электрокоагулятора будет протекать альтернативными путями, чтобы выйти из тела (например, через электроды ЭКГ, через части тела пациента, соприкасающиеся с металлическими частями операционного стола, или через катетеры, которые подключены). к электрическому устройству). Высокие частоты, используемые в электрокоагуляции (от 500 кГц до > 1 МГц), увеличивают вероятность прохождения переменного тока из-за непреднамеренной емкостной связи, даже если электрохирургическое устройство электрически изолировано от земли.Устройства для электрокоагуляции включают в себя механизмы измерения сопротивления для обнаружения отказов возвратной пластины (альтернативные схемы для протекания тока практически всегда имеют более высокое сопротивление, чем сопротивление в возвратной пластине). Поскольку ток от электрокаутерных устройств может нарушить работу имплантированного электронного оборудования, такого как кардиостимуляторы, возвратную пластину следует размещать таким образом, чтобы предотвратить протекание тока от операционного поля через имплантированное устройство к возвратной пластине.
Плотность тока в этой области намного выше нормы и может привести к ожогам.Если соединение с возвратной пластиной нарушено, ток от электрокоагулятора будет протекать альтернативными путями, чтобы выйти из тела (например, через электроды ЭКГ, через части тела пациента, соприкасающиеся с металлическими частями операционного стола, или через катетеры, которые подключены). к электрическому устройству). Высокие частоты, используемые в электрокоагуляции (от 500 кГц до > 1 МГц), увеличивают вероятность прохождения переменного тока из-за непреднамеренной емкостной связи, даже если электрохирургическое устройство электрически изолировано от земли.Устройства для электрокоагуляции включают в себя механизмы измерения сопротивления для обнаружения отказов возвратной пластины (альтернативные схемы для протекания тока практически всегда имеют более высокое сопротивление, чем сопротивление в возвратной пластине). Поскольку ток от электрокаутерных устройств может нарушить работу имплантированного электронного оборудования, такого как кардиостимуляторы, возвратную пластину следует размещать таким образом, чтобы предотвратить протекание тока от операционного поля через имплантированное устройство к возвратной пластине.
Границы | Пространственные изменения волновой динамики мерцательной аритмии после применения антиаритмических препаратов: исследование компьютерного моделирования
Введение
Мерцательная аритмия (ФП) является распространенной аритмией с распространенностью более 1.6% от общей численности населения, и распространенность продолжает расти в стареющем обществе (Kim et al., 2018). Антиаритмические препараты (ААД) являются наиболее часто используемыми препаратами первой линии для контроля ритма ФП. Однако непреднамеренное использование ААД может увеличить смертность (Cardiac-Arrhythmia-Suppression-Trial-(CAST)-Investigators, 1989; The-AFFIRM-Investigators, 2004) и иметь риск различных побочных эффектов (Chandhok and Schwartzman, 2007). . После создания рекомендаций по лечению ФП с использованием ААД безопасность ААД улучшилась, а ранний контроль ритма с помощью ААД обеспечивает лучший прогноз у пациентов с ФП (Kirchhof et al., 2020; Hindricks et al., 2021). Тем не менее, поскольку ААД являются блокаторами ионных каналов, их эффективность сильно варьируется от человека к человеку из-за взаимодействия нескольких ионных каналов и генетического влияния (Darbar and Roden, 2013) и остается неудовлетворительной (Roy et al. , 2000). Было проведено множество экспериментальных исследований для изучения эффектов ААД, однако большинство из них были результатами исследований на животных (Varela et al., 2016). Предыдущее исследование показало, что гетерогенность APD способствует возникновению субстрата для аритмогенных реэнтри-волн во время инициации и поддержания ФП.Амиодарон продемонстрировал анти-ФП эффект за счет увеличения предсердной APD и снижения гетерогенности APD. Увеличение предсердной APD и снижение гетерогенности APD были эффективны в контроле аритмогенного повторного входа (Varela et al., 2016). Если влияние ААД на контроль ритма можно предсказать с помощью имитационного моделирования, может стать возможным эффективный выбор ААД, который может уменьшить неблагоприятные эффекты или метод проб и ошибок. Недавно мы сообщили, что виртуальный тест AAD может быть выполнен с помощью компьютерного моделирования, отражающего персонализированную анатомию предсердий, гистологию и электрофизиологию пациентов с ФП (Hwang et al.
, 2000). Было проведено множество экспериментальных исследований для изучения эффектов ААД, однако большинство из них были результатами исследований на животных (Varela et al., 2016). Предыдущее исследование показало, что гетерогенность APD способствует возникновению субстрата для аритмогенных реэнтри-волн во время инициации и поддержания ФП.Амиодарон продемонстрировал анти-ФП эффект за счет увеличения предсердной APD и снижения гетерогенности APD. Увеличение предсердной APD и снижение гетерогенности APD были эффективны в контроле аритмогенного повторного входа (Varela et al., 2016). Если влияние ААД на контроль ритма можно предсказать с помощью имитационного моделирования, может стать возможным эффективный выбор ААД, который может уменьшить неблагоприятные эффекты или метод проб и ошибок. Недавно мы сообщили, что виртуальный тест AAD может быть выполнен с помощью компьютерного моделирования, отражающего персонализированную анатомию предсердий, гистологию и электрофизиологию пациентов с ФП (Hwang et al. , 2021). Компьютерное моделирование может оценить эффективность нескольких ААД в одних и тех же условиях и количественно оценить механистические эффекты ААД с использованием карт с очень высоким пространственно-временным разрешением (Loewe et al., 2014; Li et al., 2016; Lim et al., 2020b; Бай и др., 2021; Хван и др., 2021). Этот виртуальный тест на ААД не имеет этических проблем, поскольку позволяет тестировать несколько препаратов в различных дозах без риска побочных эффектов (Hwang et al., 2021). В этом исследовании был проанализирован механизм влияния ААД на волновую динамику ФП с использованием компьютерного моделирования ФП, которое отражало анатомические, гистологические и электрофизиологические характеристики 25 пациентов с ФП.Целью данного исследования было количественное определение доминирующей частоты (DF) и ее пространственной неоднородности после использования AAD (Jarman et al., 2012; Kogawa et al., 2015; Li et al., 2016) и сравнение региональных различий между легочные вены (ЛВ) и области вне ЛВ, а также различия в зависимости от условий перелома волны ФП (Li et al.
, 2021). Компьютерное моделирование может оценить эффективность нескольких ААД в одних и тех же условиях и количественно оценить механистические эффекты ААД с использованием карт с очень высоким пространственно-временным разрешением (Loewe et al., 2014; Li et al., 2016; Lim et al., 2020b; Бай и др., 2021; Хван и др., 2021). Этот виртуальный тест на ААД не имеет этических проблем, поскольку позволяет тестировать несколько препаратов в различных дозах без риска побочных эффектов (Hwang et al., 2021). В этом исследовании был проанализирован механизм влияния ААД на волновую динамику ФП с использованием компьютерного моделирования ФП, которое отражало анатомические, гистологические и электрофизиологические характеристики 25 пациентов с ФП.Целью данного исследования было количественное определение доминирующей частоты (DF) и ее пространственной неоднородности после использования AAD (Jarman et al., 2012; Kogawa et al., 2015; Li et al., 2016) и сравнение региональных различий между легочные вены (ЛВ) и области вне ЛВ, а также различия в зависимости от условий перелома волны ФП (Li et al. , 2016). Кроме того, мы сравнили характеристики волновой динамики в эпизодах прекращения или дефрагментации ФП на фоне применения ААД.
, 2016). Кроме того, мы сравнили характеристики волновой динамики в эпизодах прекращения или дефрагментации ФП на фоне применения ААД.
Материалы и методы
Этическое одобрение
Протокол исследования соответствовал Хельсинкской декларации и был одобрен Институциональным наблюдательным советом сердечно-сосудистой больницы Северанс системы здравоохранения Университета Йонсей.Все участники были включены в базу данных Yonsei AF Ablation Cohort Database (ClinicalTrials.gov Identifier: NCT02138695) и предоставили письменное согласие на участие в исследовании.
Соответствие времени активации
Сначала было проведено электроанатомическое моделирование с использованием данных о напряжении пациента. Во время катетерной аблации ФП с поверхности отдельных предсердий было получено более 500 точек данных биполярного напряжения, которые включали последовательные записи электрограмм с продолжительностью цикла 500 мс (рис. 1).Отдельные КТ-изображения были объединены с данными о напряжении для создания персонализированной электроанатомической среды каждого пациента. Метод обратного взвешивания по расстоянию (IDW) (Ugarte et al., 2015) использовался для интерполяции сигнала клинического напряжения для моделирования. Интерполяция была основана на методе IDW (Ugarte et al., 2015) и находилась в радиусе 10 мМ от интересующей области. Интерполяция данных клинического напряжения дала виртуальную карту напряжения с амплитудой. Подробное уравнение для IDW было следующим:
Метод обратного взвешивания по расстоянию (IDW) (Ugarte et al., 2015) использовался для интерполяции сигнала клинического напряжения для моделирования. Интерполяция была основана на методе IDW (Ugarte et al., 2015) и находилась в радиусе 10 мМ от интересующей области. Интерполяция данных клинического напряжения дала виртуальную карту напряжения с амплитудой. Подробное уравнение для IDW было следующим:
Wij=dij-a∑knjdkj,Rj=∑i=1njwijRij
Рис. 1. Компьютерное моделирование левого предсердия при мерцательной аритмии (ФП). Реалистическое моделирование левого предсердия (ЛП) проводилось с использованием интерполяции карты напряжения и слияния с КТ-изображениями. Были реализованы фиброз и ориентация волокон. Для анализа были проведены синхронизация карты LAT и протокол моделирования AF.
, где W продемонстрировал средневзвешенное значение соседних значений; i и j представляли неизвестные и известные значения соответствующих точек; d ij – a – расстояние между неизвестной и известной точками; R j представляет значение интерполяции в неизвестной точке j; и R ij указали известную точку значения. Трехмерная модель левого предсердия (ЛП) была создана с использованием интерполированной карты напряжения и КТ-изображений с помощью системы Ensite Navx (Abbott Inc., Лейк-Блафф, Иллинойс, США). Точное сопоставление данных вольтажа и КТ-изображений на 3D-модели ЛП проводилось с использованием вращения и перемещения. Мы интерполировали клиническую карту напряжения, чтобы создать виртуальную карту напряжения на 3D-модели. Регистрация электроанатомических карт на КТ-моделях включала четыре следующих этапа: геометрия, обрезка, масштабирование поля и выравнивание.Во время таких шагов могла возникнуть ошибка регистрации. Каждый шаг выполнялся вручную оператором, поэтому потенциально существовала возможная человеческая ошибка (Lim et al., 2020a). Ориентация волокон включала два состояния: отслеживание и визуализацию. Отслеживание было параллельной задачей, что делает его эффективным для отслеживания волокна на основе графического процессора (GPU). Проводимость менялась в зависимости от направления вектора.
Трехмерная модель левого предсердия (ЛП) была создана с использованием интерполированной карты напряжения и КТ-изображений с помощью системы Ensite Navx (Abbott Inc., Лейк-Блафф, Иллинойс, США). Точное сопоставление данных вольтажа и КТ-изображений на 3D-модели ЛП проводилось с использованием вращения и перемещения. Мы интерполировали клиническую карту напряжения, чтобы создать виртуальную карту напряжения на 3D-модели. Регистрация электроанатомических карт на КТ-моделях включала четыре следующих этапа: геометрия, обрезка, масштабирование поля и выравнивание.Во время таких шагов могла возникнуть ошибка регистрации. Каждый шаг выполнялся вручную оператором, поэтому потенциально существовала возможная человеческая ошибка (Lim et al., 2020a). Ориентация волокон включала два состояния: отслеживание и визуализацию. Отслеживание было параллельной задачей, что делает его эффективным для отслеживания волокна на основе графического процессора (GPU). Проводимость менялась в зависимости от направления вектора. Вектор, указывающий перпендикулярно направлению проводимости, указывал на более медленную проводимость по сравнению с вектором, указывающим в том же направлении, что и проводимость.Ориентация волокон была получена путем моделирования карты клинической локальной активации, а также сетки геометрии предсердий на основе атласа. Ориентация волокон была получена путем моделирования карты клинической локальной активации, а также сетки предсердной геометрии на основе атласа (Pashakhanloo et al., 2016; Lim et al., 2020a). Мы оценили персонализированную ориентацию волокон, используя метод на основе атласа (Niederer et al., 2019; Roney et al., 2021), чтобы отразить анизотропную проводимость от изотропной треугольной сетки с краями 300 мкМ.Затем мы скорректировали ориентацию волокон на основе клинической карты LAT. Проводимость нашей модели (Zahid et al., 2016) составляла 0,1264 См/м (нефиброзная продольная ячейка), 0,0546 См/м (фиброзная продольная ячейка), 0,0252 См/м (нефиброзная поперечная ячейка) и 0,0068 См/м (фиброзная поперечная ячейка).
Вектор, указывающий перпендикулярно направлению проводимости, указывал на более медленную проводимость по сравнению с вектором, указывающим в том же направлении, что и проводимость.Ориентация волокон была получена путем моделирования карты клинической локальной активации, а также сетки геометрии предсердий на основе атласа. Ориентация волокон была получена путем моделирования карты клинической локальной активации, а также сетки предсердной геометрии на основе атласа (Pashakhanloo et al., 2016; Lim et al., 2020a). Мы оценили персонализированную ориентацию волокон, используя метод на основе атласа (Niederer et al., 2019; Roney et al., 2021), чтобы отразить анизотропную проводимость от изотропной треугольной сетки с краями 300 мкМ.Затем мы скорректировали ориентацию волокон на основе клинической карты LAT. Проводимость нашей модели (Zahid et al., 2016) составляла 0,1264 См/м (нефиброзная продольная ячейка), 0,0546 См/м (фиброзная продольная ячейка), 0,0252 См/м (нефиброзная поперечная ячейка) и 0,0068 См/м (фиброзная поперечная ячейка).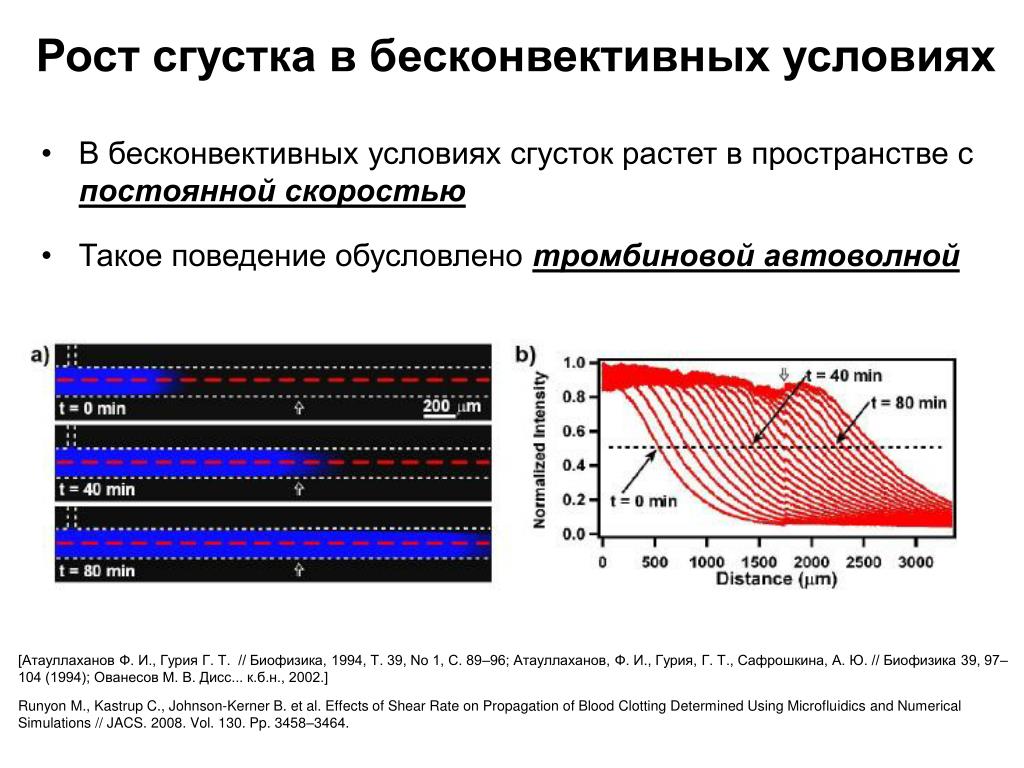 Площадь фиброза оценивали на основании клинической биполярной карты. Фиброз определяли с использованием нелинейной зависимости биполярного напряжения и вероятности фиброза. Уравнение для вероятности фиброза было описано следующим образом (Hwang et al., 2019):
Площадь фиброза оценивали на основании клинической биполярной карты. Фиброз определяли с использованием нелинейной зависимости биполярного напряжения и вероятности фиброза. Уравнение для вероятности фиброза было описано следующим образом (Hwang et al., 2019):
Pfibrosis={1,X<0-40,0X3+155X2-206X+99,8 0≤X≤1,740,1,74 , где X — биполярное напряжение в каждом узле, и оно варьировалось от 0 до 1,74 мВ. Если X > 1,74 мВ, то P фиброз будет равно нулю. Вероятность фиброза определяли с использованием данных клинического биполярного напряжения. Отслеживание волокна было выполнено для определения направления проводимости. Фиброз был представлен с использованием отношения между вероятностью фиброза и значениями биполярного напряжения (Zahid et al., 2016). Коэффициент диффузии калибровали путем синхронизации клинической и виртуальной скорости проводимости. Перед предварительным моделированием скорость проведения рассчитывали, используя расстояние от места стимуляции до придатка ЛП, и делили его на время прохождения, чтобы получить скорость проведения. Модель предсердных миоцитов человека (Courtemanche et al., 1998) использовалась для нормального синусового ритма, и состояние ФП было создано путем модификации этой модели (Lee et al., 2016). Для базового состояния AF, I Na , I , I — , I CAL , I KUR , а I CAUP были сокращены на 10, 70, 70 , 50 и 20%, а I K 1 увеличилось на 110% по сравнению с моделью Куртеманша (Lee et al., 2016). В исследовании использовались пять типов ААД. Наше специализированное программное обеспечение на базе графического процессора (CUVIA вер. 2.5, модель: SH01; Laonmed Inc., Сеул, Южная Корея) использовался виртуально, чтобы индуцировать и применять соответствующие ионные токи для AAD. DF и Smax были проанализированы с использованием того же программного обеспечения на базе графического процессора. ФП инициировали в месте стимуляции с использованием стимуляции ФП от 200 до 120 мс с восемью ударами за цикл с использованием ионных токов для определенных ААД. Виртуальное место стимуляции было сопоставлено с картой времени клинической активации для реалистичного моделирования ЛП. COV=σx¯ σ представляет собой стандартное отклонение, а x¯ указывает среднее значение. Непрерывные переменные были представлены в виде медианы и интерквартильного диапазона. Сравнение DF, Smax и COV проводили с использованием теста t и критерия Манна-Уитни в зависимости от распределения. Значение p <0,05 считалось статистически значимым. Любой случай, когда ДФ прекращалась до 17 с, исключался из исследования. Статистический анализ проводился с использованием SPSS (IBM Corp., IBM SPSS Statistics for Windows, Version 21.0) и RStudio [команда RStudio (2020). RStudio: Комплексная разработка программного обеспечения R. RStudio, PBC, Бостон, Массачусетс]. Группа пациентов состояла из 25 пациентов с ФП (68,0% мужчин, возраст 59,8 ± 9,8 лет, 32,0% пароксизмальная ФП), которым была проведена радиочастотная катетерная абляция (дополнительная таблица 3). В таблице 1 сравнивались эффекты ААД на электрофизиологические параметры и параметры волновой динамики. Таблица 1. Влияние антиаритмических препаратов (ААД) на электрофизиологические параметры и параметры фибриллярной волновой динамики. Рисунок 2. Влияние антиаритмических препаратов (ААД) на области вне ЛВ и легочных вен (ЛВ). Среди 10 сегментов ЛП мы сравнили площади антрального отдела ЛВ и экстра-ЛВ (табл. 2). Показатели Smax и DF не различались между антральным отделом ЛВ и ЛП вне ЛВ во время исходной ФП.После введения ААД средняя DF стала ниже ( p < 0,001, рис. 2), а COV-DF выше ( p = 0,003, рис. 2) в антральном отделе ЛВ, чем в областях ЛП вне ЛВ, что предположили более низкий и нестабильный ДФ в антральном отделе ЛВ после ААД. Таблица 2. Влияние антиаритмических препаратов (ААД) на легочную вену (ЛВ) по сравнению с тканью вне ЛВ. Мы сравнили изменения средней DF и COV-DF при значении Smax, равном 1. Таблица 3. Динамика волн фибрилляции предсердий (ФП) в зависимости от значений Smax. Рис. 3. Изменения доминирующей частоты (DF) при высокой и низкой Smax. Трехмерная карта DF показала, что средний DF был обратно пропорционален среднему значению Smax. В табл. 4 представлены электрофизиологические характеристики терминации и дефрагментации эпизодов ФП после введения ААД. В эпизодах дефрагментации ФП в течение 32 с после введения ААД средняя ФП была достоверно ниже ( p < 0.001, таблица 4 и рисунок 4), а COV-DF был значительно выше ( p <0,001, рисунок 5), чем у пациентов с устойчивой ФП. В эпизодах прекращения ФП средний DF был постоянно ниже ( p < 0,001, таблица 4), а COV-DF выше ( p < 0,001, рисунок 5). Тенденция низкой DF и нестабильной (более высокой) COV-DF в эпизодах дефрагментации ФП была последовательной независимо от класса IC или класса III AAD (таблица 4). Таблица 4. Электрофизиологические характеристики купированной фибрилляции предсердий (ФП) после приема антиаритмических препаратов (ААД). Рис. 4. Изменения доминантной частоты (ДЧ) при терминальной и предсердной тахикардии. Трехмерная карта DF показала, что средний DF был ниже во время эпизодов ПТ и эпизодов прекращения ФП. На электрограммах регистрировались эпизоды прекращения ПТ и ФП. Рис. 5. Неоднородность доминирующей частоты (DF). Неоднородность DF наблюдалась как в общей группе дефрагментации, так и в группе терминации. Мы оценили пространственные изменения в динамике волны ФП, отражаемые средней DF и COV-DF после использования AAD в реалистичной вычислительной модели, которая отражала геометрию, гистологию и электрофизиологию ЛП у 25 пациентов с ФП. Классы и дозы ААД, по-видимому, влияли на динамику волны ФП, и эти эффекты различались между областями ЛВ и экстра-ЛВ в зависимости от Smax. AAD легко вызывали дефрагментацию или прерывание при уменьшенном среднем DF и пространственно нестабильном DF (высокий COV-DF). Механизм AAD включает блокирование специфических трансмембранных ионных каналов для ингибирования механизмов инициации или поддержания фибрилляции. Препараты класса IC функционируют путем блокирования быстрого входящего тока натрия, который замедляет скорость нарастания потенциала действия, а ААД класса III блокируют выходящий поток калия, удлиняя реполяризацию и рефрактерность (Kowey, 1998).Однако неизвестно, как ААД действуют на разные области предсердия и как волновая динамика реагирует в соответствии с анатомической структурой. Было проведено много исследований роли ЛВ в механизме ФП (Khan, 2004). ЛВ имеют венозное происхождение предсердия, которое отличается от других частей предсердия с точки зрения эмбриологического развития (Sherif, 2013), и на них сильно влияют гены, связанные с ФП, такие как PITX2 (Wang et al. Гипотеза очагового источника и гипотеза множественных вейвлетов рассматривались как механизмы инициации и поддержания ФП (Saad et al., 2009; Narayan and Jalife, 2014). Гипотеза о фокальном источнике указывает на то, что особая форма модели повторного входа в атмосферу, создаваемая роторами, приводит в движение механизм AF. На протяжении многих лет было проведено множество исследований (Pandit et al., 2005; Jarman et al., 2012; Sánchez et al., 2012) для понимания меандра спиральных волн и прекращения AF различными способами. После AAD непрерывные разрывы волн и повторные входы не могли поддерживаться, что приводило к завершению или дефрагментации. Хотя изгиб спирали и прекращение повторного входа трудно поддаются количественному изучению (Pandit et al., 2005), мы проанализировали изменения DF и Smax во время дефрагментации AF с использованием реалистичного компьютерного моделирования AF. Это связано с тем, что компьютерное моделирование позволило многократно выполнять пространственно-временное картирование с высоким разрешением (Li et al., 2016; Hwang et al., 2021). В данном исследовании изменения волновой динамики ДФ имели тесную связь с дефрагментацией ФП. Эпизоды дефрагментированной ФП после виртуального вмешательства с ААД характеризовались сниженной средней DF и высокой COV-DF (пространственной нестабильностью DF) независимо от типа AAD.Эти изменения ФП стабильно наблюдались в эпизодах прекращения ФП. Изменение Smax не оказывало прямого влияния на прекращение ФП, что, по-видимому, было связано с тем, что ААД не оказывали существенного влияния на Smax. Правое предсердие (ПП) исключено из исследования. Двухпредсердную модель преждевременно применять в персонализированном моделировании, поскольку текущее разрешение изображения не может определить персонализированные межпредсердные соединения. Неоднородность из-за нервного влияния игнорировалась.Слой ориентации волокон был монослоем. Толщина стенки ЛП может быть реализована для отражения более клинически приемлемой модели ЛП. Биполярный вольтаж не был подходящим маркером фиброза, и ориентация волокон не измерялась для конкретного пациента. Чтобы включить клиническую электроанатомическую карту в компьютерное моделирование с высоким разрешением, мы сильно экстраполировали ограниченное количество биполярных электрограмм. Мы измеряли DF в фиксированном временном окне, и она не менялась с течением времени. Области, особенно ионные токи, специфичные для PV, не применялись в этом исследовании из-за отсутствия ссылок на влияние ионных токов AAD на клетки PV.В этом исследовании не моделировались фокальные триггеры. Персонализированная модель ЛП состояла из монослоя. Толщина стенки ЛП может быть реализована для отражения более клинически приемлемой модели ЛП. Множественные сайты индукции могут отражать сложный механизм инициации ФП (Prakosa et al., 2018). Хотя существуют некоторые различия в частотно-зависимых изменениях потенциала действия, восстановлении и динамике кальция среди различных моделей клеток миокарда человека (Nygren et al., 1998; Maleckar et al., 2009; Grandi et al., 2011; Koivumäki et al., 2011), модель Куртеманша-Рамиреса-Наттеля (Sossalla et al., 2010; Grandi et al., 2011) точно представляет математическое моделирование предсердных миоцитов человека, как показано в наших предыдущих исследованиях (Hwang et al. , 2016, 2019, 2021; Lee et al., 2016; Lim et al., 2020a, b). Значения проводимости ионных токов могут быть неточным представлением эффектов AAD в миоцитах предсердий человека, однако степень неопределенности была минимальной, поскольку в качестве эталонов были выбраны крупные млекопитающие (дополнительная таблица 2).Для анализа использовались данные инвазивного картирования. Неинвазивное позднее усиление гадолинием данных магнитно-резонансной томографии сердца можно использовать для дальнейшего анализа (Lopez-Perez et al., 2015). Снижение DF из-за AAD преимущественно наблюдается в областях PV, а AAD-индуцированное низкое и гетерогенное состояние DF во время состояния с высоким Smax было связано с прекращением или дефрагментацией AF. Персонализированное компьютерное моделирование ФП предоставило доказательства того, как ААД проявляют анти-ФП эффекты в зависимости от предсердной области или электрофизиологического состояния. Оригинальные вклады, представленные в исследовании, включены в статью/дополнительный материал, дальнейшие запросы можно направлять соответствующим авторам. Исследования с участием людей были рассмотрены и одобрены Институциональным наблюдательным советом сердечно-сосудистой больницы Северанс. Пациенты/участники предоставили письменное информированное согласие на участие в этом исследовании. IH участвовал в сборе данных, статистическом анализе и написании рукописи. J-WP участвовала в статистическом анализе и сборе данных. O-SK участвовала в программировании программного обеспечения и сборе данных. BL подтвердил получение данных и ссылки. JL предоставил поддержку для программирования программного обеспечения. ZJ способствовал сбору клинических данных. H-TY, T-HK и BJ внесли свой вклад в сбор и интерпретацию клинических данных.H-NP внес свой вклад в дизайн исследования, сбор клинических данных, интерпретацию данных и пересмотр рукописи. Все авторы внесли свой вклад в статью и одобрили представленную версию. Эта работа была поддержана грантами (HI19C0114) и (HI21C0011) Министерства здравоохранения и социального обеспечения, а также грантом (NRF-2020R1A2B01001695) Программы фундаментальных научных исследований Национального исследовательского фонда Кореи, финансируемой Министерством Наука, ИКТ и планирование будущего.Эта работа также была поддержана проектом Brain Korea 21 PLUS для медицинских наук Университета Йонсей. Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов. Все претензии, изложенные в этой статье, принадлежат исключительно авторам и не обязательно представляют претензии их дочерних организаций или издателя, редакторов и рецензентов.Любой продукт, который может быть оценен в этой статье, или претензии, которые могут быть сделаны его производителем, не гарантируются и не поддерживаются издателем. Мы хотели бы поблагодарить Джона Мартина за его лингвистическую помощь. Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fphys.2021.733543/full#supplementary-material . Бай, Дж., Zhu, Y., Lo, A., Gao, M., Lu, Y., Zhao, J., et al. (2021). In silico оценка эффектов антиаритмических препаратов класса I на Pitx2-индуцированную фибрилляцию предсердий: выводы из популяций электрофизиологических моделей клеток и тканей предсердий человека. Междунар. Дж. Мол. науч. 22:1265. дои: 10.3390/ijms22031265 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Сердечная аритмия-Подавление-Испытания (CAST)-Исследователи (1989). Предварительный отчет: влияние энкаинида и флекаинида на смертность в рандомизированном исследовании подавления аритмии после инфаркта миокарда. Н. англ. Дж. Мед. 321, 406–412. дои: 10.1056/nejm198 3210629 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Чандхок, С., и Шварцман, Д. (2007). Терапия амиодароном для контроля предсердного ритма: выводы, полученные на основе опыта одного центра. Дж. Кардиовасц. Электрофизиол. 18, 714–718. doi: 10.1111/j.1540-8167.2007.00847.x Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Чен Дж., Мандапати Р., Беренфельд, О., Сканес, А.С., Грей, Р.А., и Джалифе, Дж. (2000). Динамика вейвлетов и их роль при мерцательной аритмии в изолированном сердце овцы. Кардиовасц. Рез. 48, 220–232. doi: 10.1016/s0008-6363(00)00177-2 Полнотекстовая перекрестная ссылка | Академия Google Chen, S.A., Hsieh, M.H., Tai, C.T., Tsai, C.F., Prakash, V.S., Yu, W.C., et al. (1999). Инициация фибрилляции предсердий эктопическими сокращениями, исходящими из легочных вен: электрофизиологические характеристики, фармакологические ответы и эффекты радиочастотной абляции. Тираж 100, 1879–1886 гг. doi: 10.1161/01.cir.100.18.1879 Полнотекстовая перекрестная ссылка | Академия Google Куртеманш, М., Рамирес, Р. Дж., и Наттель, С. (1998). Ионные механизмы, лежащие в основе свойств потенциала действия предсердий человека: выводы из математической модели. утра. Дж. Физиол. 275, h401–h421. Академия Google Гранди Э., Пандит С.В., Фойгт Н., Уоркман А.Дж., Добрев Д., Джалифе Дж. и др. (2011). Потенциал действия предсердий человека и модель Ca2+: синусовый ритм и хроническая фибрилляция предсердий. Обр. Рез. 109, 1055–1066. doi: 10.1161/circresaha.111.253955 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Hindricks, G., Potpara, T., Dagres, N., Arbelo, E., Bax, J.J., Blomström-Lundqvist, C., et al. (2021). Рекомендации ESC по диагностике и лечению мерцательной аритмии 2020 г., разработанные в сотрудничестве с Европейской ассоциацией кардио-торакальной хирургии (EACTS): Рабочая группа по диагностике и лечению мерцательной аритмии Европейского общества кардиологов (ESC), разработанная совместно с специальный вклад Европейской ассоциации сердечного ритма (EHRA) ESC. евро. Heart J. 42, 373–498. Академия Google Хван, И., Пак, Дж.-В., Квон, О.-С., Лим, Б., Хонг, М., Ким, М., и др. (2021). Компьютерное моделирование антиаритмических препаратов при мерцательной аритмии в зависимости от генотипа. Фронт. Физиол. 12:650449. doi: 10.3389/fphys.2021.650449 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Хван, М., Ким, Дж., Лим, Б., Сонг, Дж.-С., Юнг, Б., Шим, Э. Б., и другие. (2019). На морфологию биполярной электрограммы влияет множество факторов: исследование моделирования in silico. Расчет PLoS. биол. 15:e1006765. doi: 10.1371/journal.pcbi.1006765 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Хван, М., Сонг, Дж.-С., Ли, Ю.-С., Ли, К., Шим, Э.Б., и Пак, Х.-Н. (2016). Электрофизиологическая абляция ротора в моделировании мерцательной аритмии in-silico: сравнение с доминирующей частотой, энтропией Шеннона и фазовой сингулярностью. PLoS One 11:e0149695. doi: 10.1371/journal.pone.0149695 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Джарман, Дж.W., Wong T., Kojodjojo P., Spohr H., Davies J.E., Roughton M., et al. (2012). Пространственно-временное поведение высокой доминирующей частоты при пароксизмальной и персистирующей фибрилляции предсердий в левом предсердии человека. Обр. Аритмия. Электрофизиол. 5, 650–658. doi: 10.1161/circep.111.967992 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Калифа Дж., Танака К., Зайцев А.В., Уоррен М., Вайдьянатан Р., Ауэрбах Д. и соавт. (2006). Механизмы фракционирования волн на границах высокочастотного возбуждения в задней части левого предсердия изолированного сердца овцы при мерцательной аритмии. Тираж 113, 626–633. doi: 10.1161/circulationaha.105.575340 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Ким, Д., Ян, П. С., Джанг, Э., Ю, Х. Т., Ким, Т. Х., Ум, Дж. С., и другие. (2018). 10-летние общенациональные тенденции заболеваемости, распространенности и неблагоприятных исходов неклапанной фибрилляции предсердий, общенациональные данные медицинского страхования, охватывающие все население Кореи. утра. Heart J. 202, 20–26. дои: 10.1016/j.ahj.2018.04.017 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Кирххоф, П., Camm, A.J., Goette, A., Brandes, A., Eckardt, L., Elvan, A., et al. (2020). Ранняя терапия контроля ритма у пациентов с мерцательной аритмией. Новый англ. Дж. Мед. 383, 1305–1316. Академия Google Когава Р., Окумура Ю., Ватанабэ И., Кофуне М., Нагашима К., Мано Х. и др. (2015). Пространственная и временная изменчивость сложной фракционированной активности предсердной электрограммы и доминирующей частоты при мерцательной аритмии человека. Дж. Аритмия. 31, 101–107.doi: 10.1016/j.joa.2014.08.004 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Койвумяки, Дж. Т., Корхонен, Т., и Тави, П. (2011). Влияние высвобождения кальция из саркоплазматического ретикулума на динамику кальция и морфологию потенциала действия в предсердных миоцитах человека: компьютерное исследование. Расчет PLoS. биол. 7:e1001067. doi: 10.1371/journal.pcbi.1001067 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Ли, Ю. С., Хван, М., Song, J.S., Li, C., Joung, B., Sobie, E.A., et al. (2016). Вклад ионных токов в зависящую от скорости продолжительность потенциала действия и характер повторного входа в математическую модель мерцательной аритмии человека. PLoS One 11:e0150779. doi: 10.1371/journal.pone.0150779 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Li, C., Lim, B., Hwang, M., Song, J.-S., Lee, Y.-S., Joung, B., et al. (2016). Пространственно-временная стабильность участков с доминирующей частотой в in-silico моделировании трехмерного картирования фибрилляции предсердий левого предсердия. PLoS One 11:e0160017. doi: 10.1371/journal.pone.0160017 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Лим, Б., Ким, Дж., Хванг, М., Сонг, Дж.-С., Ли, Дж.К., Ю, Х.-Т., и др. (2020а). Процедура in situ для высокоэффективного компьютерного моделирования мерцательной аритмии, отражающая индивидуальную анатомию, ориентацию волокон, фиброз и электрофизиологию. науч. Респ. 10:2417. Академия Google Лим Б., Парк Дж. В., Хван М., Ryu, A.J., Kim, I.S., Yu, H.T., et al. (2020б). Электрофизиологическое значение межпредсердной проводимости, в том числе кавотрикуспидального перешейка, при мерцательной аритмии. J. Physiol. 598, 3597–3612. дои: 10.1113/jp279660 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Loewe, A., Lutz, Y., Wilhelms, M., Sinnecker, D., Barthel, P., Scholz, E.P., et al. (2014). In-silico оценка динамических эффектов амиодарона и дронедарона на патоэлектрофизиологию предсердий человека. Europace 16, (Приложение 4), iv30–iv38. Академия Google Лопес-Перес, А., Себастьян, Р., и Ферреро, Дж. М. (2015). Трехмерное компьютерное моделирование сердца: методы, особенности и приложения. Биомед. англ. 14:35. Академия Google Малекар, М.М., Гринштейн, Дж.Л., Джайлз, В.Р., и Траянова, Н.А. (2009). Изменения тока К+ объясняют скорость зависимости потенциала действия в предсердных миоцитах человека. утра. Дж. Физиол. Цирк Сердца. Физиол. 297, h2398–h2410. Академия Google Нараян, С. М., и Джалифе, Дж. (2014). Предложение CrossTalk: было продемонстрировано, что роторы вызывают фибрилляцию предсердий у человека. J. Physiol. 592, 3163–3166. doi: 10.1113/jphysiol.2014.271031 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Найгрен, А., Фисет, К., Фирек, Л., Кларк, Дж. В., Линдблад, Д. С., Кларк, Р. Б., и соавт. (1998). Математическая модель клетки предсердия взрослого человека. Обр. Рез. 82, 63–81. doi: 10.1161/01.res.82.1.63 Полнотекстовая перекрестная ссылка | Академия Google Пандит С.В., Беренфельд О., Анумонво Дж.М., Зарицкий Р.М., Кнеллер Дж., Наттел С. и соавт. (2005). Ионные детерминанты функционального возврата в двухмерную модель клеток предсердия человека во время имитации хронической фибрилляции предсердий. Биофиз. J. 88, 3806–3821. doi: 10.1529/biophysj.105.060459 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Парк, Дж.H., Pak, H.-N., Choi, E.J., Jang, J.K., Kim, S.K., Choi, D.H., et al. (2009). Взаимосвязь между эндокардиальным напряжением и регионарным объемом в электроанатомически реконструированном левом предсердии у пациентов с фибрилляцией предсердий: сравнение трехмерных компьютерных томографических изображений и картирование напряжения. Дж. Кардиовасц. Электрофизиол. 20, 1349–1356. doi: 10.1111/j.1540-8167.2009.01557.x Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Пашаханлоо, Ф., Herzka, D.A., Ashikaga, H., Mori, S., Gai, N., Bluemke, D.A., et al. (2016). Архитектура миофибрилл предсердий человека, выявленная с помощью субмиллиметровой диффузионно-тензорной визуализации. Обр. Аритмия. Электрофизиол. 9:e004133. Академия Google Prakosa, A., Arevalo, HJ, Deng, D., Boyle, P.M., Nikolov, P.P., Ashikaga, H., et al. (2018). Персонализированная технология виртуального сердца для проведения аблации желудочковой тахикардии, связанной с инфарктом. Нац. Биомед.англ. 2, 732–740. doi: 10.1038/s41551-018-0282-2 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Roney, C.H., Bendikas, R., Pashakhanloo, F., Corrado, C., Vigmond, E.J., Mcveigh, E.R., et al. (2021). Составление атласа предсердных волокон человека. Энн. Биомед. англ. 49, 233–250. doi: 10.1007/s10439-020-02525-w Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Рой Д., Талайич М., Дориан П., Коннолли С., Айзенберг М.Дж., Грин М. и др. (2000). Амиодарон для профилактики рецидивов мерцательной аритмии. Новый англ. Дж. Мед. 342, 913–920. Академия Google Команда RStudio (2020). Rstudio: интегрированная разработка для R. RStudio , Бостон, Массачусетс: RStudio, PBC. Академия Google Саад, М. Н., Морин, Д. П., и Хатиб, С. (2009). Мерцательная аритмия: современный взгляд. Окснер. J. 9, 241–247. Академия Google Санчес, К., Corrias, A., Bueno-Orovio, A., Davies, M., Swinton, J., Jacobson, I., et al. (2012). Насос Na+/K+ является важным модулятором рефрактерности и динамики ротора в ткани предсердия человека. утра. Дж. Физиол. Цирк Сердца. Физиол. 302, h2146–h2159. Академия Google Shattock, M.J., Park, K.C., Yang, H.-Y., Lee, A.W.C., Niederer, S., Macleod, K.T., et al. (2017). Наклон восстановления в основном определяется продолжительностью стационарного потенциала действия. Кардиовасц.Рез. 113, 817–828. Дои: 10.1093/cvr/cvx063 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Шериф, HM (2013). Развивающиеся легочные вены и левое предсердие: значение стратегии аблации мерцательной аритмии. евро. Дж. Кардиоторак. Surg. 44, 792–799. doi: 10.1093/ejcts/ezt098 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Соссалла, С., Каллмейер, Б., Вагнер, С., Мазур, М., Маурер, У., Тойшер, К., и другие. (2010). Измененные токи Na+ при мерцательной аритмии: влияние ранолазина на аритмии и сократительную способность предсердного миокарда человека. Дж. Ам. Сб. Кардиол. 55, 2330–2342. Академия Google The-AFFIRM-Investigators (2004). Взаимосвязь между синусовым ритмом, лечением и выживаемостью в последующем исследовании контроля ритма при фибрилляции предсердий (AFFIRM). Тираж 109, 1509–1513. doi: 10.1161/01.cir.0000121736.16643.11 Полнотекстовая перекрестная ссылка | Академия Google Угарте, Й.П., Тобон, К., Ороско-Дуке, А., Бесерра, М.А., и Бустаманте, Дж. (2015). Влияние плотности электрограмм на обнаружение и удаление кончика ротора при хронической фибрилляции предсердий: исследование in silico. Europace 17, (Приложение 2), ii97–ii104. Академия Google Варела, М., Колман, М. А., Хэнкокс, Дж. К., и Асланиди, О. В. (2016). Неоднородность предсердий создает повторно входящий субстрат во время мерцательной аритмии и действия антиаритмических препаратов: механистические выводы из моделей предсердий собак. Вычисление PLoS. биол. 12:e1005245. doi: 10.1371/journal.pcbi.1005245 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Wang, J., Klysik, E., Sood, S., Johnson, R.L., Wehrens, X.H.T., and Martin, J.F. (2010). Pitx2 предотвращает предрасположенность к предсердным аритмиям, подавляя спецификацию левостороннего кардиостимулятора. Проц. Натл. акад. науч. США 107, 9753–9758. doi: 10.1073/pnas.0912585107 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Ву, Т.-Дж., Лин, С.-Ф., Вайс, Дж.Н., Тинг, С.-Т., и Чен, П.-С. (2002). Два типа фибрилляции желудочков в изолированных сердцах кроликов. Тираж 106, 1859–1866 гг. doi: 10.1161/01.cir.0000031334.49170.fb Полнотекстовая перекрестная ссылка | Академия Google Zahid, S., Cochet, H., Boyle, P.M., Schwarz, E.L., Whyte, K.N., Vigmond, E.J., et al. (2016). Модели, полученные от пациентов, связывают локализацию рецидивирующего драйвера при фибрилляции предсердий с пространственным паттерном фиброза. Кардиовасц.Рез. 110, 443–454. doi: 10.1093/cvr/cvw073 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google . Затем мы сопоставили скорость проведения из моделирования с клинической скоростью проведения путем модуляции коэффициента диффузии (Lim et al., 2020a). Цветовая шкала, указывающая время проведения, сравнивалась между клинической и виртуальной картами времени активации для сопоставления, чтобы получить точную среду проведения для каждого пациента.
Затем мы сопоставили скорость проведения из моделирования с клинической скоростью проведения путем модуляции коэффициента диффузии (Lim et al., 2020a). Цветовая шкала, указывающая время проведения, сравнивалась между клинической и виртуальной картами времени активации для сопоставления, чтобы получить точную среду проведения для каждого пациента. Виртуальное антиаритмическое лекарственное вмешательство
 Класс III включал амиодарон, соталол и дронедарон, а класс IC — флекаинид и пропафенон. Высокая доза включала амиодарон 10 мкМ, соталол 10 мМ, дронедарон 10 мкМ, флекаинид 15 мкМ и пропафенон 10 мкМ. Низкие дозы включали амиодарон 5 мкМ, соталол 60 мкМ, дронедарон 3 мкМ, флекаинид 5 мкМ и пропафенон 5 мкМ. Все ионные изменения для каждого препарата были получены из ранее опубликованных ссылок. В наших ссылках на AAD использовались значения IC50.Мы использовали такие ссылки и внесли процентные изменения относительно модели Куртеманша-Рамиреса-Наттеля (Courtemanche et al., 1998). Снижение проводимости канала рассчитывали, чтобы отразить эффект блокировки ионных каналов при рассматриваемой концентрации. Для реализации ионных токов для каждой дозы мы провели поиск литературы и внедрили такую информацию для построения ионных токов для каждой дозы, как сообщалось ранее в нашем исследовании (Hwang et al., 2021). Согласно модели Куртеманша-Рамиреса-Наттеля (Sossalla et al., 2010; Grandi et al.
Класс III включал амиодарон, соталол и дронедарон, а класс IC — флекаинид и пропафенон. Высокая доза включала амиодарон 10 мкМ, соталол 10 мМ, дронедарон 10 мкМ, флекаинид 15 мкМ и пропафенон 10 мкМ. Низкие дозы включали амиодарон 5 мкМ, соталол 60 мкМ, дронедарон 3 мкМ, флекаинид 5 мкМ и пропафенон 5 мкМ. Все ионные изменения для каждого препарата были получены из ранее опубликованных ссылок. В наших ссылках на AAD использовались значения IC50.Мы использовали такие ссылки и внесли процентные изменения относительно модели Куртеманша-Рамиреса-Наттеля (Courtemanche et al., 1998). Снижение проводимости канала рассчитывали, чтобы отразить эффект блокировки ионных каналов при рассматриваемой концентрации. Для реализации ионных токов для каждой дозы мы провели поиск литературы и внедрили такую информацию для построения ионных токов для каждой дозы, как сообщалось ранее в нашем исследовании (Hwang et al., 2021). Согласно модели Куртеманша-Рамиреса-Наттеля (Sossalla et al., 2010; Grandi et al. , 2011), в качестве базового уровня, эффекты каждой дозы реализовывались за счет применения блокады определенных ионных каналов. В дополнительных таблицах 1, 2 представлены подробные описания изменений ионного тока по сравнению с исходным уровнем в ответ на различные рекомендации по ААД, включая препараты класса IC и класса III, а также каждую дозу.
, 2011), в качестве базового уровня, эффекты каждой дозы реализовывались за счет применения блокады определенных ионных каналов. В дополнительных таблицах 1, 2 представлены подробные описания изменений ионного тока по сравнению с исходным уровнем в ответ на различные рекомендации по ААД, включая препараты класса IC и класса III, а также каждую дозу. Индукция мерцательной аритмии, анализ доминантной частоты и Smax
 Перед моделированием индукции ФП клинические и виртуальные места стимуляции были сопоставлены, чтобы отразить персонализированную модель ЛП.Успешная индукция ФП определялась во время стимуляции ФП путем наблюдения за электрограммой на трехмерной карте ЛП (дополнительный рисунок 1). Дефрагментация ФП включает прекращение ФП и преобразование ФП в предсердную тахикардию. Дефрагментацию определяли путем визуальной оценки электрограммы и трехмерной карты активации в каждом случае. Если было <2 спиральных волн, мы определяли это как дефрагментированное состояние. После успешной индукции ФП наблюдалось поддержание ФП до 32 с. В период обслуживания рассчитывалась ДФ от 17 до 23 с.APD 90 представлял собой нормальный синусовый ритм, измеренный при длительности цикла стимуляции 600 мс. Мы рассчитали с использованием нелинейной аппроксимации APD 90 и диастолического интервала (Shattock et al., 2017) для более чем 400 000 узлов во время односторонней стимуляции. Значения Smax были определены в каждом узле в регионах ЛП на одного пациента.
Перед моделированием индукции ФП клинические и виртуальные места стимуляции были сопоставлены, чтобы отразить персонализированную модель ЛП.Успешная индукция ФП определялась во время стимуляции ФП путем наблюдения за электрограммой на трехмерной карте ЛП (дополнительный рисунок 1). Дефрагментация ФП включает прекращение ФП и преобразование ФП в предсердную тахикардию. Дефрагментацию определяли путем визуальной оценки электрограммы и трехмерной карты активации в каждом случае. Если было <2 спиральных волн, мы определяли это как дефрагментированное состояние. После успешной индукции ФП наблюдалось поддержание ФП до 32 с. В период обслуживания рассчитывалась ДФ от 17 до 23 с.APD 90 представлял собой нормальный синусовый ритм, измеренный при длительности цикла стимуляции 600 мс. Мы рассчитали с использованием нелинейной аппроксимации APD 90 и диастолического интервала (Shattock et al., 2017) для более чем 400 000 узлов во время односторонней стимуляции. Значения Smax были определены в каждом узле в регионах ЛП на одного пациента.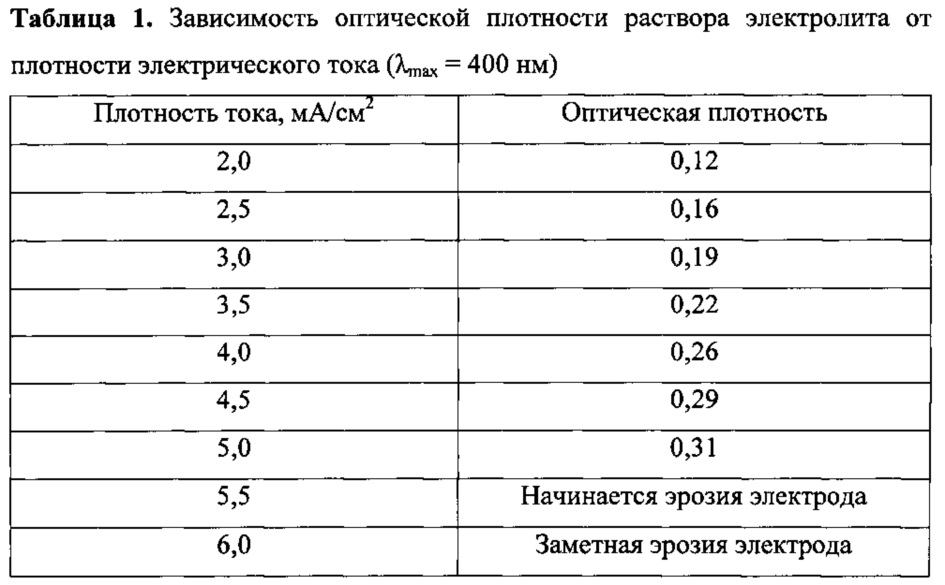 Для регионального анализа Smax и DF ЛА был разделен на 10 регионов. 10 регионов ЛА были выбраны на основании предыдущего клинического исследования (Park et al., 2009). Мы использовали 3D-спиральные КТ-изображения ЛП для разделения частей ЛП в соответствии с эмбриологическим происхождением.Части включают венозное левое предсердие (заднее левое предсердие, включая антральный отдел и заднюю стенку), переднее левое предсердие (исключая придаток левого предсердия) и левое предсердие. Мы также разделили антральный отдел ЛВ, заднюю нижнюю стенку и перегородку по задней нижней линии и линии перегородки. Средние DF и средние Smax рассчитывали по результатам всех 10 регионов. Высокий DF и высокий Smax были определены как соответствующие верхние 10% значений (дополнительные рисунки 2, 3). Для стабильности DF и Smax после ААД рассчитывали коэффициент вариации (COV) высокого DF и высокого Smax как стандартное отклонение, деленное на среднее значение:
Для регионального анализа Smax и DF ЛА был разделен на 10 регионов. 10 регионов ЛА были выбраны на основании предыдущего клинического исследования (Park et al., 2009). Мы использовали 3D-спиральные КТ-изображения ЛП для разделения частей ЛП в соответствии с эмбриологическим происхождением.Части включают венозное левое предсердие (заднее левое предсердие, включая антральный отдел и заднюю стенку), переднее левое предсердие (исключая придаток левого предсердия) и левое предсердие. Мы также разделили антральный отдел ЛВ, заднюю нижнюю стенку и перегородку по задней нижней линии и линии перегородки. Средние DF и средние Smax рассчитывали по результатам всех 10 регионов. Высокий DF и высокий Smax были определены как соответствующие верхние 10% значений (дополнительные рисунки 2, 3). Для стабильности DF и Smax после ААД рассчитывали коэффициент вариации (COV) высокого DF и высокого Smax как стандартное отклонение, деленное на среднее значение:
Статистический анализ
Результаты
Влияние антиаритмических препаратов на волновую динамику мерцательной аритмии
 В целом (2 ААД класса IC и 3 ААД класса III, низкие и высокие дозы каждого препарата) ААД удлиняли продолжительность потенциала действия для 90% реполяризации (APD 90 , p <0,001) и среднюю продолжительность цикла ФП ( AFCL, p < 0,001) и снижали скорость проведения (CV, p = 0,007), но не изменяли Smax ( p = 0,899). DF ( p <0,001) и COV-DF ( p = 0,001, рис. 2) уменьшающие эффекты ААД класса III были более значительными, чем эффекты ААД класса IC (таблица 1).AAD дозозависимо изменяли APD 90 ( p < 0,001), AFCL ( p < 0,001) и CV ( p < 0,001), причем снижение DF было более выраженным при высоких дозах, чем при низких дозах. ( p < 0,001, табл. 1).
В целом (2 ААД класса IC и 3 ААД класса III, низкие и высокие дозы каждого препарата) ААД удлиняли продолжительность потенциала действия для 90% реполяризации (APD 90 , p <0,001) и среднюю продолжительность цикла ФП ( AFCL, p < 0,001) и снижали скорость проведения (CV, p = 0,007), но не изменяли Smax ( p = 0,899). DF ( p <0,001) и COV-DF ( p = 0,001, рис. 2) уменьшающие эффекты ААД класса III были более значительными, чем эффекты ААД класса IC (таблица 1).AAD дозозависимо изменяли APD 90 ( p < 0,001), AFCL ( p < 0,001) и CV ( p < 0,001), причем снижение DF было более выраженным при высоких дозах, чем при низких дозах. ( p < 0,001, табл. 1). Трехмерная карта доминирующей частоты (DF) показала, что средний DF был выше в областях PV. Электрограммы демонстрировали региональные изменения вольтажа в ЛВ и вне ЛВ. Коэффициент преобладающей частоты вариации (COV-DF) был выше в классе IC и PV области.
Трехмерная карта доминирующей частоты (DF) показала, что средний DF был выше в областях PV. Электрограммы демонстрировали региональные изменения вольтажа в ЛВ и вне ЛВ. Коэффициент преобладающей частоты вариации (COV-DF) был выше в классе IC и PV области. Влияние различных антиаритмических препаратов на легочную вену и внелегочные вены
Постантиаритмическое лекарственное средство Средняя доминантная частота в зависимости от Smax
 4, на основе предыдущего клинического исследования реституции предсердий человека (таблица 3). В таблице 3 мы использовали пороговое значение исходных значений Smax для исходного среднего DF и пороговое значение Smax после AAD для среднего DF после AAD. При Smax ≥1,4 средняя DF после AAD была значительно ниже, чем при Smax <1,4 ( p = 0,014, рис. 3). Паттерн более высокого среднего DF при Smax <1,4 был последовательным в области PV ( p = 0,039, рис. 3) и вне PV ( p = 0,002, рис. 3).Однако COV-DF не различались в зависимости от значения Smax. Кроме того, мы дифференцировали, в частности, таблицу 3 на подгруппы, как указано в дополнительной таблице 4. DF был выше у дронедарона 3 мкМ и амиодарона 5 мкМ при низком Smax.
4, на основе предыдущего клинического исследования реституции предсердий человека (таблица 3). В таблице 3 мы использовали пороговое значение исходных значений Smax для исходного среднего DF и пороговое значение Smax после AAD для среднего DF после AAD. При Smax ≥1,4 средняя DF после AAD была значительно ниже, чем при Smax <1,4 ( p = 0,014, рис. 3). Паттерн более высокого среднего DF при Smax <1,4 был последовательным в области PV ( p = 0,039, рис. 3) и вне PV ( p = 0,002, рис. 3).Однако COV-DF не различались в зависимости от значения Smax. Кроме того, мы дифференцировали, в частности, таблицу 3 на подгруппы, как указано в дополнительной таблице 4. DF был выше у дронедарона 3 мкМ и амиодарона 5 мкМ при низком Smax. Регионарные изменения вольтажа в легочных венах (ЛВ) и экстра-ЛВ областях были продемонстрированы на электрограммах.
Регионарные изменения вольтажа в легочных венах (ЛВ) и экстра-ЛВ областях были продемонстрированы на электрограммах. Прекращение или дефрагментация мерцательной аритмии в зависимости от доминантной частоты и коэффициента вариации доминантной частоты

Обсуждение
Основные выводы
 Реалистичное компьютерное моделирование ФП было подходящим подходом для изучения регионального эффекта ААД или электрофизиологических изменений.
Реалистичное компьютерное моделирование ФП было подходящим подходом для изучения регионального эффекта ААД или электрофизиологических изменений. Эффекты антиаритмических препаратов при фибрилляции предсердий на легочную вену или внелегочные вены
 , 2010). . По этой причине электрическая изоляция антрального отдела ЛВ является наиболее важной целью катетерной аблации ФП (Chen et al., 1999). Изоляция ЛВ блокирует не только триггеры от ЛВ, но и сердечные вегетативные нервы, расположенные в антральном отделе ЛВ, и снижает критическую массу предсердий. В этом исследовании AAD уменьшали среднюю DF и ее пространственную нестабильность (COV-DF) более значительно в области ЛВ, чем в области без ЛВ. Это свидетельствует о том, что анти-ФП эффект ААД в основном отвечает за более низкие и пространственно нестабильные ДФ в области ЛВ, чем в областях вне ЛВ. Изучение отдельных эффектов ААД на области ЛП может оказать существенное влияние на лечение ФП.
, 2010). . По этой причине электрическая изоляция антрального отдела ЛВ является наиболее важной целью катетерной аблации ФП (Chen et al., 1999). Изоляция ЛВ блокирует не только триггеры от ЛВ, но и сердечные вегетативные нервы, расположенные в антральном отделе ЛВ, и снижает критическую массу предсердий. В этом исследовании AAD уменьшали среднюю DF и ее пространственную нестабильность (COV-DF) более значительно в области ЛВ, чем в области без ЛВ. Это свидетельствует о том, что анти-ФП эффект ААД в основном отвечает за более низкие и пространственно нестабильные ДФ в области ЛВ, чем в областях вне ЛВ. Изучение отдельных эффектов ААД на области ЛП может оказать существенное влияние на лечение ФП. Механизмы мерцательной аритмии множественных вейвлетов или очаговых источников
 Гипотеза множественных вейвлетов объясняет механизм AF как спонтанные разрывы волн, которые постоянно генерируют случайно блуждающие дочерние вейвлеты.Эти разрывы волн сталкиваются, разрушаются, сливаются или порождают новые волны в самоподдерживающемся турбулентном процессе (Chen et al., 2000). Области с высоким DF использовались для локализации источника драйверов или роторов AF (Hwang et al., 2016), а области с высоким Smax представляют собой уязвимое состояние волн AF в механизме поддержания AF (Kalifa et al., 2006). Следовательно, DF является репрезентативным параметром для гипотезы фокального источника, а Smax поддерживает теорию множественных вейвлетов. Ву и др.(2002) сообщили, что фокальный источник и несколько вейвлетов взаимодействуют и поддерживают фибрилляцию в соответствии с состоянием ткани, таким как скорость проведения. Настоящее исследование впервые продемонстрировало, что Smax оказывает прямое влияние на динамику волны ДФ при ФП и анти-ФП механизмах. Хотя ААД не снижали Smax, механизм фокального источника, представленный DF, был преобладающим в поддержании ФП в ткани предсердий с низким Smax. При низком Smax средний DF был высоким как в области PV, так и вне PV, тогда как средний DF был низким, когда Smax был высоким.Таким образом, DF и Smax обнаруживают обратную зависимость.
Гипотеза множественных вейвлетов объясняет механизм AF как спонтанные разрывы волн, которые постоянно генерируют случайно блуждающие дочерние вейвлеты.Эти разрывы волн сталкиваются, разрушаются, сливаются или порождают новые волны в самоподдерживающемся турбулентном процессе (Chen et al., 2000). Области с высоким DF использовались для локализации источника драйверов или роторов AF (Hwang et al., 2016), а области с высоким Smax представляют собой уязвимое состояние волн AF в механизме поддержания AF (Kalifa et al., 2006). Следовательно, DF является репрезентативным параметром для гипотезы фокального источника, а Smax поддерживает теорию множественных вейвлетов. Ву и др.(2002) сообщили, что фокальный источник и несколько вейвлетов взаимодействуют и поддерживают фибрилляцию в соответствии с состоянием ткани, таким как скорость проведения. Настоящее исследование впервые продемонстрировало, что Smax оказывает прямое влияние на динамику волны ДФ при ФП и анти-ФП механизмах. Хотя ААД не снижали Smax, механизм фокального источника, представленный DF, был преобладающим в поддержании ФП в ткани предсердий с низким Smax. При низком Smax средний DF был высоким как в области PV, так и вне PV, тогда как средний DF был низким, когда Smax был высоким.Таким образом, DF и Smax обнаруживают обратную зависимость. Достаточные условия для дефрагментации или прекращения мерцательной аритмии
Ограничения
Заключение
Заявление о доступности данных
Заявление об этике
Вклад авторов
Финансирование
Конфликт интересов
Примечание издателя
Благодарности
Дополнительный материал
Сноски
Каталожные номера



 Если они отсутствуют, то установить их.
Если они отсутствуют, то установить их. Фармакотоксические методы. 1999; 42:11–20. [PubMed] [Google Scholar]
Фармакотоксические методы. 1999; 42:11–20. [PubMed] [Google Scholar]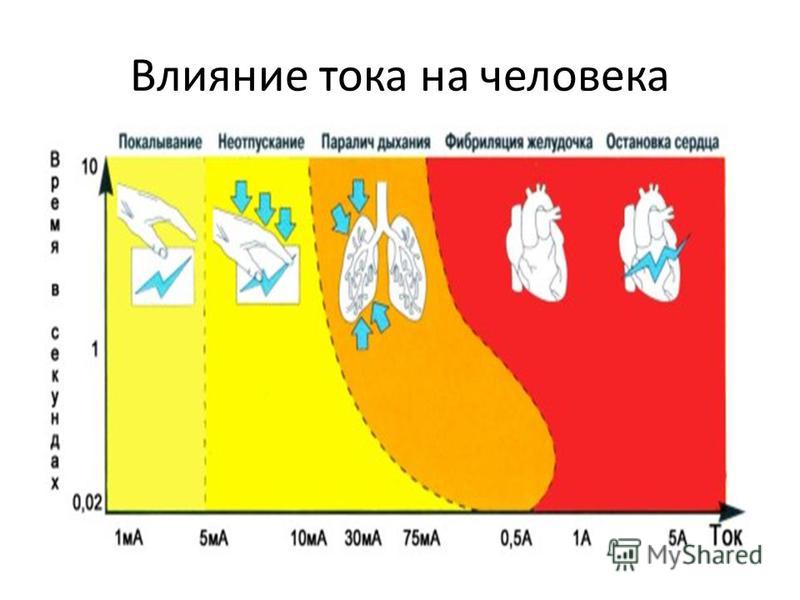 Болонья: Редакция Мондуцци; 2003. стр. 467–470. [Google Scholar]
Болонья: Редакция Мондуцци; 2003. стр. 467–470. [Google Scholar] Jpn Circ J. 1988; 52: 249–253. [PubMed] [Google Scholar]
Jpn Circ J. 1988; 52: 249–253. [PubMed] [Google Scholar] 1993; 88: 186–192. [PubMed] [Google Scholar]
1993; 88: 186–192. [PubMed] [Google Scholar] , Митамура Х., Такацуки С. и др. Постреполяризационная рефрактерность как потенциальный антифибрилляционный механизм пилсикаинида, чистого блокатора натриевых каналов с медленной кинетикой восстановления. Сердечно-сосудистые препараты Ther. 1998; 12: 475–482. [PubMed] [Google Scholar]
, Митамура Х., Такацуки С. и др. Постреполяризационная рефрактерность как потенциальный антифибрилляционный механизм пилсикаинида, чистого блокатора натриевых каналов с медленной кинетикой восстановления. Сердечно-сосудистые препараты Ther. 1998; 12: 475–482. [PubMed] [Google Scholar] Тираж. 1995; 92: 1954–1968. [PubMed] [Google Scholar]
Тираж. 1995; 92: 1954–1968. [PubMed] [Google Scholar] [PubMed] [Google Scholar]
[PubMed] [Google Scholar] Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic.