Атомы — урок. Химия, 8–9 класс.
Термин «атом» предложил Дж. Дальтон в начале \(19\) века. Он назвал атомами мельчайшие частицы, не изменяющиеся в химических реакциях.
Атомы — мельчайшие химически неделимые частицы, из которых состоят вещества.
На сегодняшний день известно \(118\) видов атомов. Более \(90\) из них существуют в природе, а остальные получены искусственно.
Атомы характеризуются:
- определёнными очень малыми размерами;
- определённой, тоже очень малой, массой;
- определённым строением.
Размеры атомов настолько малы, что увидеть их невозможно даже в самый мощный микроскоп. Радиусы атомов составляют \(0,046\)–\(0,25\) нм (\(1\) нм \(=\) 10−9 м). Самый маленький — атом гелия, а самый большой — франция.
Атомы гелия и франция
Массы атомов тоже ничтожно малы. Так масса атома водорода составляет всего 1,67⋅10−24 г.
До конца \(19\)-го столетия атомы считали неделимыми частицами. Но учёные доказали, что атом имеет сложное строение.
Согласно современным представлениям каждый атом состоит из положительно заряженного ядра и движущихся вокруг него электронов. Электроны имеют отрицательный заряд и нейтрализуют положительный заряд ядра.
Ядро намного меньше самого атома. Так, радиус атома водорода составляет \(0,046\) нм, а радиус его ядра — всего \(0,00000065\) нм. В его состав входят ещё более мелкие частицы: протоны (\(p\)) и нейтроны (\(n\)). Протоны заряжены положительно и определяют заряд ядра. Нейтроны — частицы без заряда.
Заряд протона равен по величине заряду электрона, а число протонов в ядре равно числу электронов в атоме. Поэтому атомы нейтральны.
Атомы различаются между собой строением (числом содержащихся в них частиц), а также массой и размерами.
Атом гелия

Атом кислорода
В химических реакциях атомы не изменяются, а только перегруппировываются — объединяются в новых комбинациях.
Атом — мельчайшая химически неделимая электронейтральная частица вещества, состоящая из положительного ядра и отрицательных электронов.
Атомы не изменяются в химических реакциях, но существуют ядерные реакции, при протекании которых их строение изменяется.
Атомы редко встречаются в изолированном виде. Обычно они соединяются друг с другом в молекулы или более крупные структуры. Число вариантов соединения атомов практически бесконечно, и их относительно небольшое число приводит к образованию огромного количества разнообразных веществ.
Пример:
атомы кислорода образуют два вещества. Когда они соединяются попарно, то образуется кислород.
Молекула кислорода
Если же три атома кислорода образуют молекулу, то образуется озон.
Молекула озона
В молекулах атомы соединены друг с другом химическими связями.
Вещество, атом, молекула
Согласно современным представлениям основные положения атомно-молекулярной теории сводятся к следующим тезисам:
- Частицы веществ непрерывно движутся.
- Между частицами вещества действуют силы взаимного притяжения и отталкивания.
- Между составляющими частицами вещества существуют расстояния, размер которых зависит от агрегатного состояния.
- Молекулы состоят из атомов.
- Молекулы сохраняются при физических явлениях и разрушаются во время химических реакций.
- Атомы во время химических процессов остаются неделимыми, но перегруппировываются, в результате чего образуются новые соединения.
- Разнообразие веществ в природе обусловлена различными сочетаниями атомов, благодаря чему могут возникать вещества с молекулярным или немолекулярным строением.
Важнейшие понятия атомно-молекулярного учения
Согласно атомно-молекулярному учению, главными объектами химии являются атомы, молекулы, химические элементы, простые и сложные вещества.
Атом
Атомы — химически неделимые частицы, которые сохраняются при химических реакциях, но при этом частично может меняться строение электронной оболочки. Однако атомы разрушаются в процессе ядерных реакций.
Атом — это наименьшая, химически неделимая, электронейтральная частица элемента, которая состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Атом — это система, состоящая из ядра и электронной оболочки. В состав атомного ядра, радиус которого в 10000 раз меньше (10-14 -10-15 м) радиуса атома (~ 10-10 м), входят ядерные частицы нуклоны.
Нуклоны — это положительно заряженные протоны и электронейтральные нейтроны. Электронная оболочка, размер которой определяет радиус всего атома — это совокупность электронов. Положительный заряд ядра определяется количеством протонов и равна по абсолютной величине отрицательному заряду электронной оболочки, который соответствует количеству электронов. Благодаря равенству по абсолютной величине зарядов протонов и электронов, атом электронейтрален. Протоны, нейтроны и электроны объединяются общим названием — субатомные частицы.
Массы протона и нейтрона практически одинаковы, а масса электрона в 1836 раз меньше, поэтому вся масса атома фактически сосредоточена в его ядре. По этой причине плотность вещества в ядре фантастически велика — порядка 1013 -1014 г / см3 . Массы атомов различных элементов колеблются от 1,67 · 10-27 кг (атом водорода) до 4,42 · 10-25 кг (атом мейтнерия — элемента № 109).
Количественными характеристиками атома является заряд ядра и относительная атомная масса Аr . Эти величины указываются в периодической системе элементов.
Заряд ядра атома равен порядковому номеру элемента (закон Мозли).
Поскольку массы атомов очень малы, в химии внедрена внесистемная единица измерения, называемая атомной единицей массы (а.е.м.) и равна одной двенадцатой массы атома изотопа углерода-12 (m (атома 12 С) = 19,92 · 10-27 кг):
Относительная атомная масса Аr — это физическая величина, равная отношению средней массы атома элемента к одной двенадцатой массы атома изотопа углерода-12:
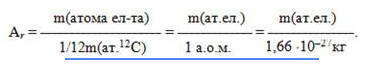
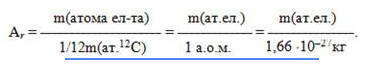
В системе измерений СИ Аr — безразмерная величина. Внесистемная единица измерения относительной атомной массы — а.е.м. Абсолютная масса атома равна произведению его относительной атомной массы на 1/12 массы атома углерода — 12 , например
m (ат.О) = А r (О) · 1,66 · 10— 27 = 16 · 1,66 · 10— 27 = 26,56 · 10— 27 кг.
Атом носителем химических свойств элемента . Вместе с этим у атомов одного элемента могут быть разные массы вследствие явления изотопии , при котором атомы одного элемента содержат одинаковое количество протонов в ядре, но разное количество нейтронов, что сказывается на их массе .
Молекула
Молекулы — это реально существующие природные объекты, что подтверждается многими экспериментально доказанными фактами.
Молекула — это наименьшая частица вещества, которая способна самостоятельно существовать и имеет все химические свойства вещества.
Как материальные частицы молекулы имеют размеры и массы. Размеры молекул колеблются в пределах 10-10 — 10-7 м. Масса отдельной молекулы чрезвычайно мала. Так, масса молекулы воды составляет 2,895×10-26 кг.
Молекула сохраняет химические свойства вещества. Известно, что вещество характеризуется определенными физическими и химическими свойствами. Физические свойства — это агрегатное состояние, плотность, температуры кипения и плавления, электропроводность, диэлектрическая проницаемость, цвет, запах, вкус и тому подобное. Понятно, что перечисленные свойства веществ могут быть присущи не одной молекуле, а достаточно большой их совокупности. Однако молекула имеет и собственные физические свойства: дипольный и магнитный моменты, способность к поляризации и тому подобное. А химические свойства вещества (способность вступать в химическое взаимодействие с другими веществами) в полной мере относятся и каждой отдельной молекуле.
Молекулы состоят из атомов, которые соединены между собой химическими связями в определенной последовательности и определенным образом ориентированы в пространстве. Количество атомов в молекуле колеблется от двух (Н2, О2, НСl) до нескольких тысяч (витамины, гормоны, белки). Атомы благородных газов (He, Ne, Ar, Kr, Xe, Rn) иногда называют одноатомными молекулами. Состав молекулы — важнейшая характеристика молекулы и вещества — описывается химическими формулами.
Схематическое модель молекулы Nh4
Между молекулами есть расстояния, обусловленные агрегатным состоянием вещества: в газах они составляют 10-8 — 10-7 м, в твердых телах — примерно 10-10 м.
При физических явлениях молекулы сохраняются, а при химических превращениях — разрушаются, образуя новые вещества.
Количественной характеристикой молекулы является относительная молекулярная масса Мr .
Относительная молекулярная масса Мr— это отношение средней массы молекулы вещества к 1/12 массы атома углерода-12.
В системе СИ относительная молекулярная масса Mr — безразмерная величина, а внесистемной единицей ее измерения является а.е.м.
Относительная молекулярная масса Мr равна сумме относительных атомных масс Аr элементов, входящих в состав молекулы, с учетом количества атомов каждого элемента , например:
M r (SO 2 ) = A r (S) + 2 A r (O) = 32 + 2 · 16 = 64 а.е.м.
Абсолютная масса молекулы определяется как произведение Мr на атомную единицу массы:
m (молекулы SO 2 ) = M r (SO 2 ) · 1,66 · 10 — 27 = 64 · 1,66 · 10 — 27 = 1,06 · 10 — 25 кг.
Молекулярное строение имеют органические соединения и часть неорганических веществ, но большинство неорганических веществ состоит из ионов, в которых носителями химических свойств является условные частицы — ассоциаты ионов. Поэтому к веществам ионной строения невозможно применять понятие «молекула» так же как и к металлов и их сплавов, кристаллическая решетка которых имеет свои специфические особенности. Таким образом, с современной точки зрения молекула — это наименьшая электронейтральна замкнутая совокупность атомов, образует определенную структуру с помощью химических связей.
Химический элемент
Сейчас известно 118 химических элементов: из них 89 обнаружены в природе, а другие получены искусственно при проведении ядерных реакций.
Химический элемент — это вид атомов с одинаковым зарядом ядра.
Каждый элемент имеет свое название и символ. Названия элементов с порядковыми номерами 104-109 утверждены советом IUPAC (1997.) Позже были названы другие элементы. Теперь элемент №104 имеет следующие название и символ: Резерфорд Rf, №105 — Дубний Db, №106 — Сиборгий Sg, №107 — Борий Bh, элемент №108 — Хассий Hs, №109 — Мейтнерий Mt, №110 — Дармштадтий Ds. Химические элементы №№111-118 еще не получили официальных названий, поэтому их пока называют по порядковым номерам, например: №111 — Унунуний Uuu (один, один, один) №112 — Унунбий Uub (один, один, два) и т.д.
Химический символ означает, во-первых, название элемента, во-вторых, — один атом этого элемента при записях формул химических реакций.
Носителем свойств химических элементов является атом. Входя в состав различных веществ, атомы каждого элемента придают им определенных свойств. Так, вещества NaCl, Na2S, Na2O имеют некоторые общие свойства благодаря наличию иона Na+ , но также и различия за счет ионов Cl— , S2 , O2.
Основной количественной характеристикой элемента является заряд ядра его атомов Z , совпадающей с порядковым номером элемента. В природе отсутствуют различные химические элементы, которые должны одинаковый заряд ядра, поэтому можно однозначно определить элемент с зарядом ядра его атома. Относительная атомная масса Аr тоже в определенной степени может служить количественной характеристикой элемента, но не исчерпывающей, так как по величине Аr невозможно определить элемент. Существуют атомы различных элементов с одинаковыми Аr — так называемые изобары. С другой стороны, как уже упоминалось, существуют атомы одного и того же элемента с различными Аr — изотопы.
Формулы изотопов конечно записывают с помощью символа химического элемента, отметив заряд ядра (слева снизу) и массового числа (слева сверху). Исключением являются изотопы элемента водорода, для которых наряду с традиционной символикой допускаются и индивидуальные названия и обозначения.
Простые и сложные соединения
Поскольку вещество — это любая совокупность атомов или молекул, то по составу все соединения можно разделить на простые и сложные.
Простыми веществами называются вещества, которые состоят из атомов одного элемента; простые вещества — это форма существования химического элемента в свободном состоянии.
Насчитывается более 500 простых веществ, а элементов известно всего 118. Такое расхождение объясняется явлением под названием аллотропия.
Аллотропия — это способность элемента образовывать несколько простых, отличающихся по свойствам веществ, которые называются аллотропными модификациями, или алотропамы.
Простые вещества могут иметь молекулярное и немолекулярное строение — атомное или металлическое. Молекулярное строение присуще кислороду, галогенам; атомное — благородным газам, алмазу, графиту; металлическое — металлам в разном состоянии.
Сложными веществами называются вещества, содержащие атомы различных элементов, то есть это форма существования элементов в связанном состоянии.
Сложные вещества могут иметь как молекулярное строение (Н2S, CH4, HCl, H2O), так и немолекулярное: ионное (NaCl, Na2O, NaOH) или металлическое (Fe3C — карбид железа).
Химические реакции, их классификация
Химическими реакциями являются процессы, при которых изменяется состав соединений вследствие разрушения связей в одних веществах и образования новых соединений.
Химические реакции — это явления, при которых происходят превращения одних веществ в другие без изменения состава атомных ядер.
Для условного записи химических реакций применяют уравнения химических реакций, где в левой части указывают формулы исходных веществ, а в правой — конечных продуктов, образовавшихся в результате реакции Перед формулами всех веществ проставляют необходимые стехиометрические коэффициенты — числа, с помощью которых сравнивают количества атомов каждого элемента слева и справа.
Итак, уравнение химической реакции — условный запись, в которой с помощью химических формул соединений и стехиометрических коэффициентов отмечают состав и количество исходных веществ и продуктов реакции .
Химические реакции всегда сопровождаются физическими эффектами, которые подтверждают протекание реакции. Визуальными признаками химических реакций обычно является выделение газа, выпадение осадка, изменение окраски реакционной среды или тепловой эффект.
Для химических реакций, проходящих между неорганическими реагентами, чаще всего используются такие классификации:
- По признаку изменения количества и состава исходных веществ и конечных продуктов все реакции делятся на типы:
- реакции разложения, в которых из одного сложного вещества образуется несколько продуктов. В общем виде:
- реакции соединения , в которых из нескольких веществ относительно простого состава образуется одна сложное вещество:
- реакции замещения, в которых простое вещество замещает составную часть сложного вещества, в результате чего образуются другие простая и сложная вещества: A + B C→ A B + CA+BC→AB+C.
- реакции обмена, в которых молекулы сложных веществ обмениваются своими составными частями: A B + CD → A D + B CAB+CD→AD+BC.
- По признаку изменения валентных состояний атомов выделяют:
- окислительно-восстановительные реакции, при которых происходит изменение степеней окисления у атомов одного или нескольких исходных веществ. Этот тип реакций подробно будет рассматриваться позже, а здесь мы ограничимся только примером окислительно-восстановительной реакции с указанием степеней окисления:
- реакции невалентных преобразований, в процессе которых меняется только состав веществ, а электронные оболочки отдельных атомов остаются неизменными, а значит и степени окисления в атомах всех элементов не изменяются. Типичными случаями реакций невалентных преобразований являются реакции обмена, а также некоторые реакции соединения и разложения.
- В зависимости от направления течения реакции делятся на:
- оборотные, при которых протекание реакций происходит как в прямом, так и в обратном направлении. Следует помнить, что при записи оборотных реакций вместо знаков равенства или стрелочки (= или →→) Ставят две стрелки, направленные в противоположные стороны (↔↔ или ⇔⇔).
- необратимые, идущие в одном направлении до полного расходования хотя бы одного из реагентов. Как правило, необратимые реакции имеют одну из следующих признаков: а) продукты, получаемые, выходят из реакционной среды в виде осадка или газа; b) образуются малодиссоциированные соединения (то есть слабые электролиты: вода, слабая кислота или слабое основание) с) выделяется большое количество теплоты (горение, взрыв).
- По агрегатному или фазовым состоянием реакции делятся на следующие группы:
- гомогенные, при которых вещества, содержащиеся в системе, не отделяются друг от друга поверхностью раздела фаз;
- гетерогенные, характеризующихся наличием поверхности раздела фаз, то есть хоть одно соединение находится в другом агрегатном состоянии, чем остальные веществ.
- По характеру энергетического воздействия выделяют следующие реакции:
- термохимические, которые сопровождаются тепловым эффектом, то есть энергия подводится или отводится в форме теплоты. По знаку тепловых эффектов реакции делятся на следующие типы:
- экзотермические, сопровождающиеся выделением теплоты;
- эндотермические, при которых теплота поглощается;
- фотохимические, которые происходят под действием света сопровождаются излучением световой энергии
- электрохимические, протекающих под действием электрической энергии или сами являются источником электрического тока. Электрохимические реакции происходят в гальванических элементах, при электролизе и при коррозии металлов.
- термохимические, которые сопровождаются тепловым эффектом, то есть энергия подводится или отводится в форме теплоты. По знаку тепловых эффектов реакции делятся на следующие типы:
- В зависимости от природы реагирующих частиц реакции могут быть:
- молекулярными, при которых взаимодействие между веществами проходит результате столкновения отдельных молекул реагирующих веществ;
- ионными, протекающих при взаимодействии между ионами;
- радикальными, при которых одной из взаимодействующих частиц является радикал. Радикалы при записи обозначают с помощью точки рядом с формулой (∙∙).
- При наличии постороннего влияния на скорость реакции они делятся на:
- каталитические, протекающих в присутствии катализаторов — специальных веществ, которые ускоряют реакцию;
- некаталитические, в которых ускоряющий влияние катализатора отсутствует.
Одна и та же реакция в зависимости от признака рассматриваемого может классифицироваться по-разному. Например, синтез NH3 с N2 и H2 в присутствии железного катализатора является реакцией сообщения и одновременно относится к окислительно-восстановительным, гомогенным, молекулярным, каталитическим, термохимическим и оборотным реакциям.
Что такое атом?
Атомом называют частицу вещества. Она имеет микроскопические размеры и массу, являясь наименьшей частью химического элемента и носителем его свойств.
Происхождение названия
В переводе с древнегреческого атом означает «неделимый, неразрезаемый». В качестве самой малой элементарной части материи данное понятие было сформулировано еще древнеиндийскими и древнегреческими учеными. Химики XVII–XVIII веков подтвердили идею атома экспериментально. Их опыты показали, что отдельные вещества не подвергаются дальнейшему расщеплению на составные элементы при использовании методов химии.
В XIX–XX веках были открыты уже субатомные частицы и структура атома. Определение термина принято в Карлсруэ в 1860 году во время Международного съезда химиков. Ученые установили, что атом является наименьшей составной частицей химического элемента.
Структура
Атом состоит из:
Электронов — самых легких составляющих с отрицательным зарядом и очень низкой массой 9,11⋅10−31, которую невозможно установить современными научными методами. Их размеры — не более 10−18м. Электроны притягиваются к ядру благодаря кулоновскому взаимодействию.
Протонов — положительно заряженных частиц, масса которых превышает соответствующее значение электрона в 1836 раз.
Нейтронов — их не содержит только водород-1. Они не имеют электрического заряда и тяжелее электрона в 1839 раз.
Согласно стандартной модели строения атома, протон и нейтрон состоят из элементарных частиц, которые называются кварками. Они обладают электрическим зарядом, кратным e/3, и не наблюдаются в свободном состоянии.
Центральным элементом является атомное ядро; в нем сосредоточена наибольшая часть массы. Оно обладает положительным зарядом, который и определяет тот химический элемент, к которому относится частица.
Размер
Атом не имеет выраженных границ. Размеры определяются по расстоянию между ядрами одних и тех же атомов, которые между собой вступили в химическую связь.
Атомы и молекулы
Атомы — это маленькие частицы, из которых состоит вещество. Невозможно даже представить себе, насколько они малы. Если сложить в цепочку сто миллионов атомов, у нас получится ниточка длиной всего лишь в 1 см. В тонком листе бумаги, наверное, не меньше миллиона слоев атомов. Науке известно более ста видов атомов; соединяясь друг с другом, они образуют все окружающие нас вещества.

 Представление об атомах
Представление об атомах
Мысль о том, что всё в природе состоит из атомов, возникла давно. Еще 2500 лет назад древнегреческие философы полагали, что вещество состоит из таких частиц, которые нельзя разделить. Само слово «атом» восходит к греческому слову «атомос», что значит «неделимый». В Древней Греции (см. статью «Загадочные жители Греции«) философы обсуждали гипотезу о том, что всё вещество в мире состоит из неделимых частиц. Правда, Аристотель в этом сомневался.

 Термин «атом» был впервые использован английским химиком Джоном Дальтоном (1766- 1844). В 1807 г. Дальтон выдвинул свою атомную теорию. Атомами он назвал составляющие всякое вещество малые частицы, которые не изменяются входе химических реакций. Согласно Дальтону, химическая реакция — это процесс, при котором атомы соединяются вместе или отделяются друг от друга. Атомная теория Дальтона лежит в основе представлений современных ученых.
Термин «атом» был впервые использован английским химиком Джоном Дальтоном (1766- 1844). В 1807 г. Дальтон выдвинул свою атомную теорию. Атомами он назвал составляющие всякое вещество малые частицы, которые не изменяются входе химических реакций. Согласно Дальтону, химическая реакция — это процесс, при котором атомы соединяются вместе или отделяются друг от друга. Атомная теория Дальтона лежит в основе представлений современных ученых.
В начале нашего столетия ученые начали строить модели атомов. Эрнест Резерфорд (1871 — 1937) показал, что отрицательно заряженные электроны обращаются вокруг положительно заряженного ядра. Нильс Бор (1885 — 1962) утверждал, что электроны обращаются по определенным орбитам. В 1932 г. Джеймс Чедвик (1891 — 1974) установил, что ядро атома состоит из частиц, которые он назвал протонами и нейтронами.

 Структура атома
Структура атома
Атомы состоят из еще меньших, чем они сами, частиц, называемых элементарными. Центром атома является его ядро. Оно состоит из элементарных частиц двух видов — протонов и нейтронов. Есть в атоме также другие элементарные частицы — электроны; они вращаются вокруг ядра. Существует множество разных элементарных частиц. Ученые считают, что протоны и нейтроны состоят из кварков. Элементарные частицы, входящие в состав атома, удерживаются вместе благодаря своим электрическим зарядам. Протоны заряжены положительно, а электроны — отрицательно. Нейтроны заряда не имеют, т.е. являются электрически нейтральными. Частицы, несущие противоположные электрические заряды, притягиваются друг к другу. Притяжение отрицательно заряженных электронов к положительно заряженным протонам, находящимся в атомном ядре, удерживает электроны на орбитах около этого ядра. В состав атома входит одинаковое число положительно заряженных протонов и отрицательно заряженных электронов, и атом электрически нейтрален.
Электроны в атоме находятся на разных энергетических уровнях, или оболочках. Каждая оболочка состоит из определенного числа электронов. Когда очередная оболочка заполняется, новые электроны попадают на следующую оболочку. Большую часть объема атома занимает пустое пространство между элементарными частицами. Отрицательно заряженные электроны удерживаются на своих энергетических уровнях силой притяжения к положительно заряженным протонам ядра.
Строение атома часто описывают строгой диаграммой, однако сегодня ученые полагают, что электроны существуют на своих орбитах в размытом состоянии. Это представление отражено на рисунке, где электронные орбиты представлены в виде «облаков». Так вы бы увидели молекулу под электронным микроскопом. Равными цветами показаны разные уровни плотности электронов. Бирюзовым цветом отмечена область наибольшей плотности.
Атомный номер и атомная масса
Атомный номер — это число протонов в атомном ядре. Как правило, в состав атома входит одинаковое число протонов и электронов, поэтому по атомному номеру можно судить и о том, сколько в атоме электронов. В разных атомах содержится разное количество протонов. В ядре атома фосфора 15 протонов и 16 нейтронов, значит, его атомный номер 15. В ядре атома золота 79 протонов и 118 нейтронов: следовательно, атомный номер золота 79.
Чем больше протонов и нейтронов имеет атом, тем больше его масса (величина, показывающая количество вещества в составе атома). Сумму числа протонов и числа нейтронов мы называем атомной массой. Атомная масса фосфора — 31. При исчислении атомной массы электроны в расчет не принимаются, так как их масса ничтожно мала по сравнению с массой атома. Существует особый прибор — масс-спектрометр. Он позволяет определить для каждого данного атома его массу.

 Изотопы
Изотопы
У большинства элементов существуют изотопы, атомы которых имеют несколько отличное строение. Количество протонов и электронов в атомах изотопов одного элемента всегда неизменно. Атомы изотопов различаются числом нейтронов в ядре. Следовательно, у всех изотопов одного элемента один и тот же атомный номер, но разная атомная масса. На этом рисунке вы видите три изотопа углерода. У изотопа С12 есть 6 нейтронов и 6 протонов. С13 имеет 7 нейтронов. В ядре изотопа С12 восемь нейтронов и 6 протонов.
Физические свойства изотопов различны, но они обладают одинаковыми химическими свойствами. Обычно большая часть атомов элемента (вещества, состоящего из атомов одного вида) принадлежит к одному изотопу, а другие изотопы встречаются в меньших количествах.
Молекулы
Атомы редко встречаются и свободном состоянии. Как правило, они связываются друг с другом и образуют молекулы либо другие, более массивные структуры. Молекула — это мельчайшая частица вещества, которая может существовать самостоятельно. Она состоит из атомов, удерживающихся вместе при помощи связей. Например, у молекулы воды два атома водорода связанны с атомом кислорода. Атомы удерживаются вместе благодаря электрическим зарядам частиц, из которых они состоят. Описывая строение молекул, ученые прибегают к помощи моделей. Как правило, они пользуются структурными и пространственными моделями. Структурные модели представляют связи, удерживающие атомы вместе, в виде палочек. В пространственных моделях атомы плотно соединены друг с другом. Конечно, модель не похожа на настоящую молекулу. Модели строятся для того, чтобы показать, из каких атомов та или иная молекула состоит.
Химические формулы
Химическая формула вещества показывает, сколько атомов каких элементов входит в состав одной молекулы. Каждый атом обозначается символом. Как правило, в качестве символа выбирается первая буква английского, латинского или арабского названия элемента. Например, молекула углекислою газа состоит из двух атомов кислорода и одного атома углерода, поэтому формула углекислого газа СО2. Двойка Атомы обозначает число атомов кислорода в молекуле.
Этот опыт продемонстрирует вам, что молекулы вещества удерживаются вместе силами притяжения. Наполните стакан водой до краев. Осторожно опустите в стакан несколько монет. Вы увидите, что над краями стакана приподнялся водяной купол. Сила, притягивающая молекулы воды друг к другу, может удержать некоторое количество воды над краями стакана. Эта сила называется силой поверхностного натяжения.
Из чего состоит атом? Инфографика | Инфографика
В 1913 году датский физик Нильс Бор предложил свою теорию строения атома. За основу он взял планетарную модель атома, разработанную физиком Резерфордом. В ней атом уподоблялся объектам макромира — планетарной системе, где планеты двигаются по орбитам вокруг большой звезды. Аналогично в планетарной модели атома электроны движутся по орбитам вокруг расположенного в центре тяжёлого ядра.
Бор ввёл в теорию атома идею квантования. Согласно ей, электроны могут двигаться только по фиксированным орбитам, соответствующим определённым энергетическим уровням. Именно модель Бора стала основой для создания современной квантово-механической модели атома. В этой модели ядро атома, состоящее из положительно заряженных протонов и не имеющих заряда нейтронов, тоже окружено отрицательно заряженными электронами. Однако согласно квантовой механике, для электрона нельзя определить какую-то точную траекторию или орбиту движения — есть только область, в которой находятся электроны с близким энергетическим уровнем.
Что находится внутри атома?
Атомы состоят из электронов, протонов и нейтронов. Нейтроны были открыты после того, как физиками была разработана планетарная модель атома. Лишь в 1932 году, проводя серию опытов, Джеймс Чедвик обнаружил частицы, не имеющие никакого заряда. Отсутствие заряда подтверждалось тем, что эти частицы никак не реагировали на электромагнитное поле.
Само ядро атома образуют тяжёлые частицы — протоны и нейтроны: каждая из этих частиц почти в две тысячи раз тяжелее электрона. Протоны и нейтроны также имеют схожие размеры, но протоны обладают положительным зарядом, а нейтроны не имеют заряда вообще.
В свою очередь, протоны и нейтроны состоят из элементарных частиц, называемых кварками. В современной физике кварки являются самой маленькой, основной частицей материи.
Размеры самого атома во много раз превышают размеры ядра. Если увеличить атом до размеров футбольного поля, то размеры его ядра могут быть сопоставимы с теннисным мячиком в центре такого поля.
В природе существует множество атомов, различающихся размерами, массой и другими характеристиками. Совокупность атомов одного вида называется химическим элементом. На сегодняшний день известно более ста химических элементов. Их атомы различаются размерами, массой, а также строением.
Электроны внутри атома
Отрицательно заряженные электроны двигаются вокруг ядра атома, образуя своего рода облако. Массивное ядро притягивает электроны, но энергия самих электронов позволяет им «убегать» дальше от ядра. Таким образом, чем больше энергия электрона, тем дальше от ядра он находится.
Значение энергии электронов не может быть произвольным, оно соответствует чётко определенному набору энергетических уровней в атоме. То есть энергия электрона изменяется скачкообразно от одного уровня к другому. Соответственно, и двигаться электрон может только в рамках ограниченной электронной оболочки, соответствующей тому или иному энергетическому уровню — в этом смысл постулатов Бора.
Получив больше энергии, электрон «перескакивает» в более высокий от ядра слой, потеряв энергию — наоборот, в более низкий слой. Таким образом, облако электронов вокруг ядра упорядочено в виде нескольких «нарезанных» слоев.
История представлений об атоме
Само слово «атом» происходит от греческого «неделимый» и восходит к идеям древнегреческих философов о наименьшей неделимой части материи. В средние века химики убедились в том, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы. Такие наименьшие частицы вещества и получили название атомов. В 1860 году на международном съезде химиков в Германии это определение было официально закреплено в мировой науке.
В конце XIX — начале XX века физиками были открыты субатомные частицы и стало ясно, что атом в действительности не является неделимым. Сразу же были выдвинуты теории о внутреннем строении атома, одной из первых среди которых стала модель Томсона или модель «пудинга с изюмом». Согласно этой модели, маленькие электроны находились внутри массивного положительно заряженного тела — как изюм внутри пудинга. Однако, практические эксперименты химика Резерфорда опровергли эту модель и привели того к созданию планетарной модели атома.
Развитие планетарной модели Бором наряду с открытием в 1932 году нейтронов сформировало основу для современной теории о строении атома. Следующие этапы в развитии знаний об атоме уже связаны с физикой элементарных частиц: кварков, лептонов, нейтринов, фотонов, бозонов и других.
Смотрите также:
Урок 3. Атом: характеристики, важные для биологии
С древних времён люди задавались вопросом: «Из чего состоит жизнь?». Философы Древней Греции и Индии предполагали, что мельчайшей частицей всякого вещества в мире, является атом, который, по их мнению, неделим. Истинная природа атома приоткрылась намного позже.
Чтобы понять, как организованы живые системы, мы должны узнать о природе атома, его устройстве, о том, как атомы собираются в молекулы и о способах, которыми эти молекулы соединяются в вещества. Только после этого можно будет говорить о структуре клеток, а затем и организмов. Поэтому знакомство с жизнью на Земле мы начинаем с вопросов биофизики и биохимии.
Во Вселенной любая субстанция, имеющая массу и занимающая место в пространстве, определяется как материя, существующая в форме вещества (физические тела) или в форме поля (свет, гравитация и т.д.). Вещество состоит из очень мелких частиц, называемых атомами. Атом – мельчайшая единица, на уровне которой совершаются основные химические реакции. Из-за их размеров атомы долгое время не могли изучать. Только в начале XVII века учёные смогли осуществить первые эксперименты, раскрывающие физическую природу атомов.
 Строение поваренной соли
Строение поваренной соли
Автор: OpenStax College, CC BY 3.0
Как устроен атом?
Объекты размером с атом можно «увидеть» только косвенно, используя сложную технологию, такую как туннельная микроскопия. Наглядно показав наличие электронов, Джозеф Джон Томсон впервые доказал, что атом состоит из субатомных частиц. В беседе он назвал модель атома «пудингом с изюмом», где роль изюминок выполняют электроны.
 Схема работы сканирующего туннельного микроскопа: control voltages of piezotube; piezoelectric tube with electrodes — трубка с электродами; tunneling current amplifier — амперметр для измерения величины туннельного тока; distance control and scanning unit — модуль для перемещения иглы и контроля расстояния игла-образец; tip — игла; sample — образец, карту рельефа которого требуется построить; tunneling voltage; data processing and display — модуль для обработки результатов измерений и вывода карты рельефа
Схема работы сканирующего туннельного микроскопа: control voltages of piezotube; piezoelectric tube with electrodes — трубка с электродами; tunneling current amplifier — амперметр для измерения величины туннельного тока; distance control and scanning unit — модуль для перемещения иглы и контроля расстояния игла-образец; tip — игла; sample — образец, карту рельефа которого требуется построить; tunneling voltage; data processing and display — модуль для обработки результатов измерений и вывода карты рельефа
Автор: Michael Schmid, CC BY-SA 2.0 at
Но эта точка зрения была опровергнута. Гипотеза, выдвинутая в 1913 году датским физиком Нильсом Бором, обеспечила хорошую отправную точку для понимания современной атомной теории.
Опираясь на модель Эрнеста Резерфорда, Бор предположил, что каждый атом обладает орбитальным облаком крошечных субатомных частиц, называемых электронами, вращающимися вокруг центра, как в миниатюрной Солнечной системе, и что они излучают и поглощают энергию, переходя с одного облака орбиты на другое.
 Электронная конфигурация атома углерода
Электронная конфигурация атома углерода
Автор: Alejandro Porto, CC BY-SA 3.0
В центре каждого атома – маленькое очень плотное ядро, сформированное из двух других видов субатомных частиц: протонов и нейтронов. Современные исследования доказали, что и протоны и нейтроны также не являются неделимыми. Они состоят из кварков.

Обзор физики элементарных частиц
Автор: Headbomb, Creative Commons Attribution-Share Alike 3.0 Unported
Атом и его заряд
Атомы различаются числом протонов в ядре, количество которых определяет атомный заряд, химические свойства и место элемента в периодической таблице Д. И. Менделеева. Внутри ядра скопление протонов и нейтронов удерживается силой, которая работает только на коротких субатомных расстояниях.
Каждый протон несёт положительный (+) заряд, а электрон – отрицательный (-), нейтрон же потому так и называется, что он нейтрален. Если количество электронов в атоме совпадает с количеством протонов, то атом в целом является электрически нейтральным. Химическое поведение атома обусловлено количеством и конфигурацией его электронов.
Атомная масса
Термины «масса» и «вес» часто используются как синонимы, но они имеют несколько разное значение. Масса относится к количеству вещества, а вес описывает силу тяжести, влияющую на субпозицию вещества. Объекты, имеющие одинаковую массу, находясь на Земле будут весить больше, чем если бы они были расположены на Луне, потому что гравитационная сила Земли больше, чем у Луны. Атомная масса равна сумме масс его протонов и нейтронов. Атомы, встречающиеся в природе Земли, содержат от 1до 92 протонов и до 46 нейтронов.
Масса атомов и субатомных частиц измеряется в единицах, называемых дальтонами (Да), или атомных единицах массы (а.е.м.), в химии – «моль». Они очень малы, 1 грамм содержит 602 миллиона миллионов миллиардов а.е.м. (6.02 × 10 23). Протон весит 1,007 Да, нейтрон – 1,009 Да. Электроны весят 1/1840 Да, поэтому они почти не влияют на массу атома.
 Сравнительный размер атома гелия и его ядра
Сравнительный размер атома гелия и его ядра
Автор: User:Murkt, CC BY-SA 3.0
Электроны
Положительные заряды ядра атома нейтрализуются или уравновешиваются отрицательно заряженными электронами, расположенными в облаках (орбиталях), лежащих на разном расстоянии вокруг ядра. Атомы с одинаковым числом протонов и электронов электрически нейтральны, то есть у них нет чистого заряда. Порядковый номер химического элемента в таблице Менделеева говорит о количестве электронов у его атома.
Электроны удерживаются на своих орбиталях притяжением положительно заряженного ядра. Иногда другие силы преодолевают это притяжение, и атом теряет один или несколько электронов. В других случаях атомы получают дополнительные электроны. Атомы, в которых число протонов не равно числу электронов, называются ионами – это заряженные частицы.
Атом, имеющий больше протонов, чем электронов, имеет положительный заряд и называется катионом. Для примера – атом натрия (Na), который потерял один электрон, становится ионом натрия (Na+) с зарядом +1. Атом, имеющий меньше протонов, чем электронов, несёт суммарный отрицательный заряд и называется анионом. Атом хлора (Cl), получивший один электрон, становится хлорид-ионом (Cl-) с зарядом -1.
Природа атома – изотопы
Хотя все атомы одного элемента имеют одинаковое количество протонов, они не могут иметь одинаковое количество нейтронов. Атомы одного элемента, которые обладают разным числом нейтронов, называют изотопами этого элемента.
Большинство элементов в природе существует в виде смеси различных изотопов. Например, углерод (C) имеет 3 изотопа, каждый из которых содержит 6 протонов. Более 99% углерода в природе существует как изотоп, содержащий 6 нейтронов. Общая масса этого изотопа составляет 12 Да (6 от протонов и 6 от нейтронов). Он называется углеродом-12 и обозначается 12 C.
Большая часть из оставшихся изотопов углерода естественного происхождения составляет углерод-13 – изотоп с 7 нейтронами. Редчайший изотоп углерода – углерод-14, с 8 нейтронами. В отличие от двух других изотопов углерод-14 нестабилен – это означает, что его ядро имеет тенденцию к распаду на элементы с более низкими атомными номерами.
Ядерный распад излучает значительное количество энергии и называется радиоактивным распадом, а изотопы, которые распадаются, называются радиоактивными изотопами. Некоторые радиоактивные изотопы более нестабильны, чем другие, они разлагаются легче. Однако любой изотоп распадается с постоянной скоростью. Обычно время распада выражается как период полураспада – время, необходимое для распада половины атомов в образце.
Углерод-14 часто используется для датировки ископаемых и других материалов, он имеет период полураспада в 5730 лет. Образец, содержащий 1 грамм углерода-14 сегодня, будет содержать 0,5 г углерода-14 через 5730 лет, 0,25 г через 11 460 лет, 0,125 г через 17 190 лет м и т. д.
 1: образование углерода-14 2: распад углерода-14 3: «равное» уравнение для живых организмов, а неравное-для мертвых организмов, в которых с-14 затем распадается
1: образование углерода-14 2: распад углерода-14 3: «равное» уравнение для живых организмов, а неравное-для мертвых организмов, в которых с-14 затем распадается
Автор: NikNaks, условия просмотра CC BY-SA 3.0
Соотнося различные изотопы углерода и другие элементы в биологических образцах и горных породах, учёные имеют возможность точно определять, когда эти материалы появились.
В современной биологии радиоактивность имеет широкое применение. Радиоактивные изотопы являются одним из способов метки или маркировки конкретной молекулы, чтобы исследовать её изменения, химические реакции в живых клетках и тканях. Недостаток этого метода в том, что энергетические субатомные частицы, испускаемые радиоактивными веществами, могут серьёзно повредить живой клетке, например, стать причиной её мутации, а в больших дозах и гибели. Поэтому доза безопасной радиации обязательно контролируется и регулируется.
Электроны определяют химическое поведение атомов
Ключ к химическому поведению атома лежит в числе и расположении на орбиталях его электронов. В модели Бора-Резерфорда показано, что отдельные электроны вращаются вокруг центрального ядра, но она не отражает реальности. Современная физика доказывает, что мы не можем точно определить положение любого отдельного электрона в заданное время.
 Форма и расположение в пространстве s-, p-, d- и f-орбиталей.
Форма и расположение в пространстве s-, p-, d- и f-орбиталей.
Автор: haade, CC BY-SA 3.0
На самом деле электрон может быть где угодно, как рядом с ядром, так и далеко от него. Но конкретный электрон вероятнее всего можно найти в определённой зоне атома. Орбиталь – это та область, где скорее всего содержится данный электрон. Некоторые электронные орбитали вблизи ядра сферические (S-орбитали), другие – в виде гантели (p-орбитали). Орбитали, более удалённые от ядра, могут иметь различную форму. Независимо от расположения, орбиталь не может содержать более 2 электронов.
Большая часть атома – пустое пространство. Если представить, что ядро размером с мяч для гольфа, то первый ближайший к нему электрон расположится не ближе чем 1,6 км. По этой причине ядра двух атомов никогда не подходят близко друг к другу. И электроны атома, а не его протоны и нейтроны определяют его химические свойства. Это объясняет, почему все изотопы элемента, имеющие одинаковое расположение электронов, химически ведут себя идентично.
Атом содержит дискретные энергетические уровни
Поскольку электроны притягиваются к положительно заряженному ядру, оно должно постоянно удерживать их на своих орбиталях, как нам нужно постоянно держать яблоко в кулаке, чтобы преодолевать силу притяжения Земли. Ядро атома содержит огромный потенциал, при его расщеплении высвобождается гигантское количество энергии, которую человек использует для работы атомных реакторов и атомного оружия.
Если мы отпустим яблоко, оно упадёт, так как уменьшится потенциал его энергии. Но если бы мы внесли яблоко на вершину здания, то увеличили бы потенциал энергии. Электроны тоже имеют потенциал собственной энергии, связанной с их положением. Противостоять притяжению ядра и переместить электрон на более отдалённую орбиту можно, только получив энергию от внешнего источника. В молекулах хлорофилла этим источником является энергия Солнца, она возбуждает электроны, и они отрываются от атома. Чем ближе электрон расположен к ядру, тем большая энергия ему понадобится для преодоления его силы тяжести.
Перемещение электрона в обратном направлении – ближе к ядру – имеет обратный эффект: энергия не поглощается, а выделяется в виде лучистой энергии (тепла и света), и электрону остаётся меньше потенциальной энергии.
 Испускание света
Испускание света
Автор: Volobuev Ilya, CC BY-SA 4.0
Таким образом, электроны в атоме имеют дискретные энергетические уровни. Эти уровни называют квантами (сингулярные, квантовые), означающими наличие определённого количества энергии. Если использовать аналогию с яблоком снова, то представьте, что оно может быть поднято только до определённого уровня этажей здания. Каждый атом демонстрирует лестницу потенциала – дискретный набор орбиталей с разным запасом энергии, зависящим от расстояния от ядра.
 Диаграмма атома фтора, показывающая степень эффективного ядерного заряда.
Диаграмма атома фтора, показывающая степень эффективного ядерного заряда.
Автор: Effective_Nuclear_Charge.svg, CC0
Электроны, которые расположены на одинаковом расстоянии от ядра, имеют одинаковую энергию, даже если они занимают разные орбитали. Говорят, что они занимают тот же энергетический уровень. Энергетические уровни обозначаются буквами К, L, М и т.д.
Когда электроны передаются от одного атома другому, они сохраняют свой потенциал энергии. В организмах химическая энергия хранится в высокоэнергетических электронах, которые передаются от одного атома к другому в реакциях, включающих окисление и восстановление. Чаще эти процессы соединены в комбинацию окислительно-восстановительной реакции.
Вам будет интересно
Конспект «Атомы, молекулы и ионы»
«Атомы, молекулы и ионы»
Ключевые слова конспекта: Атомно-молекулярное учение, атомы, молекулы и ионы, элементарные частицы, ядро, электрон, протон, нейтрон.
Древнегреческий философ Демокрит 2500 лет назад предположил, что все тела состоят из мельчайших, невидимых, неделимых, вечно движущихся частиц — атомов. В переводе «атом» означает «неделимый».
Учение о молекулах и атомах в основном было разработано в XVIII— XIX вв. Великий русский учёный М. В. Ломоносов утверждал, что тела в природе состоят из корпускул (молекул), в состав которых входят элементы (атомы). Многообразие веществ учёный объяснял соединением разных атомов в молекулах и различным расположением атомов в них.

Основоположником атомно-молекулярного учения принято считать известного английского учёного Джона Дальтона. Тем не менее некоторые представления об атомах и молекулах, высказанные Ломоносовым за полвека до Дальтона, оказались более достоверными, научными. Например, английский учёный отрицал возможность существования молекул, образованных одинаковыми атомами.
Атомно-молекулярное учение получило окончательное признание только в 1860 г. на Всемирном съезде химиков в Карлсруэ.
Молекулы
Каждое отдельно взятое вещество состоит из одинаковых молекул. Например, вещество вода состоит из молекул воды. Но размеры молекул воды очень малы, поэтому даже маленькая капелька воды содержит огромное количество молекул, которые имеют одинаковые состав и свойства.
Молекулы — это мельчайшие частицы многих веществ, состав и химические свойства которых такие же, как у данного вещества. При химических реакциях молекулы распадаются, то есть они являются химически делимыми частицами. Молекулы состоят из атомов.

Атомы
Следует иметь в виду, что существуют также вещества, состоящие из отдельных одинаковых атомов. Мельчайшими частицами, сохраняющими характерные химические свойства таких веществ, являются атомы. Так, из отдельных атомов состоят благородные газы — гелий, неон, аргон и др. Атомы в отличие от молекул в ходе химических реакций не делятся на более мелкие части.
Атомы — это мельчайшие химически неделимые частицы вещества.
Элементарные частицы
В конце XIX—начале XX в. было обнаружено, что атомы состоят из ешё более мелких частиц. Эти частицы были названы элементарными частицами. В центре атома находится положительно заряженное ядро, вокруг которого находятся отрицательно заряженные частицы — электроны. Заряд электрона принято считать равным —1.
Ядро атома, в свою очередь, также состоит из элементарных частиц. В состав ядер атомов входят положительно заряженные частицы — протоны и частицы, имеющие почти такую же массу, как протоны, но не имеющие заряда,— нейтроны. Заряд протона численно равен заряду электрона, но имеет противоположный знак (+1).
Например, атом водорода состоит из ядра, в котором находится только один протон и один электрон. Атом гелия состоит из ядра, в котором находятся 2 протона и 2 нейтрона, а также 2 электрона. Атом лития состоит из ядра, в котором находятся 3 протона, 4 нейтрона, а также 3 электрона.
Ионы
Одни атомы, взаимодействуя с другими атомами, могут терять или, наоборот, приобретать один или более электронов. В результате электрически нейтральный атом превращается в заряженную частицу — ион. Если атом теряет один или несколько электронов, его называют положительно заряженным ионом. Атом, дополнительно присоединивший один или несколько электронов, называют отрицательно заряженным ионом. Противоположно заряженные ионы притягиваются друг к другу. Подробнее электронно-ионная теория рассматривается в курсе физики (читать Конспект «Электронно-ионная теория»)

Конспект урока «Атомы, молекулы и ионы».
Следующая тема: «Простые и сложные вещества».
Что такое атом? | Живая наука
Атомы являются основными единицами материи и определяющей структурой элементов. Термин «атом» происходит от греческого слова «неделимый», потому что когда-то считалось, что атомы — самые маленькие объекты во Вселенной и не могут быть разделены. Теперь мы знаем, что атомы состоят из трех частиц: протонов, нейтронов и электронов, которые состоят из еще более мелких частиц, таких как кварков .
Атомы были созданы после Большого взрыва 13.7 миллиардов лет назад. Когда горячая и плотная новая Вселенная остыла, условия стали подходящими для образования кварков и электронов. Кварки объединились, чтобы сформировать протоны и нейтроны, и эти частицы объединились в ядра. Все это произошло в течение первых нескольких минут существования Вселенной, согласно CERN .
Вселенной потребовалось 380 000 лет, чтобы остыть достаточно, чтобы замедлить электроны, чтобы ядра могли захватить их и сформировать первые атомы. Согласно Jefferson Lab , самыми ранними атомами были в основном водорода и гелий , которые до сих пор являются самыми распространенными элементами во Вселенной.Гравитация в конечном итоге заставила облака газа слиться и образовать звезды, а более тяжелые атомы были (и все еще создаются) внутри звезд и отправлены по Вселенной, когда звезда взорвалась (сверхновая).
Атомные частицы
Протоны и нейтроны тяжелее электронов и находятся в ядре в центре атома. Электроны чрезвычайно легкие и существуют в облаке, вращающемся вокруг ядра. Электронное облако имеет радиус в 10 000 раз больше, чем ядро, согласно Лос-Аламосской национальной лаборатории .
Протоны и нейтроны имеют примерно одинаковую массу. Однако один протон примерно в 1835 раз массивнее электрона. Атомы всегда имеют равное количество протонов и электронов, и количество протонов и нейтронов также обычно одинаково. Добавление протона к атому создает новый элемент, а добавление нейтрона создает изотоп или более тяжелую версию этого атома.
Ядро
Ядро было открыто в 1911 году Эрнестом Резерфордом, физиком из Новой Зеландии.В 1920 году Резерфорд предложил название протон для положительно заряженных частиц атома. Он также предположил, что в ядре есть нейтральная частица, что Джеймс Чедвик, британский физик и ученик Резерфорда, смог подтвердить в 1932 году.
Согласно Chemistry, практически вся масса атома находится в его ядре. LibreTexts . Протоны и нейтроны, составляющие ядро, имеют примерно одинаковую массу (протон немного меньше) и имеют одинаковый угловой момент или спин.
Ядро удерживается вместе сильной силой , одной из четырех основных сил в природе. Эта сила между протонами и нейтронами преодолевает электрическую силу отталкивания, которая в противном случае раздвинула бы протоны в соответствии с законами электричества. Некоторые атомные ядра нестабильны, потому что сила связи различается для разных атомов в зависимости от размера ядра. Затем эти атомы распадаются на другие элементы, такие как углерод-14, распадающийся на азот-14.
Вот простой рисунок структуры атома.(Изображение предоставлено Shutterstock)
Протоны
Протоны — это положительно заряженные частицы, находящиеся в атомных ядрах. Резерфорд открыл их в экспериментах с электронно-лучевыми трубками, которые проводились между 1911 и 1919 годами. Протоны примерно на 99,86% массивнее нейтронов.
Число протонов в атоме уникально для каждого элемента. Например, атомов углерода, имеют шесть протонов, атомов водорода, атомов имеют один и атомов кислорода, атомов имеют восемь. Число протонов в атоме называется атомным номером этого элемента.Число протонов также определяет химическое поведение элемента. Элементы расположены в Периодической таблице элементов в порядке возрастания атомного номера.
Три кварка составляют каждый протон — два «верхних» кварка (каждый с положительным зарядом в две трети) и один «нижний» кварк (с отрицательным зарядом в одну треть) — и они удерживаются вместе другими субатомными частицами, называемыми глюоны, которые безмассовые.
Электроны
Электроны крошечные по сравнению с протонами и нейтронами, более чем в 1800 раз меньше, чем протон или нейтрон.Согласно Jefferson Lab , электроны примерно на 0,054% массивнее нейтронов.
Джозеф Джон (Дж.Дж.) Томсон, британский физик, открыл электрон в 1897 году, согласно Science History Institute . Первоначально известные как «корпускулы», электроны имеют отрицательный заряд и электрически притягиваются к положительно заряженным протонам. Электроны окружают атомное ядро путями, называемыми орбиталями. Эта идея была выдвинута австрийским физиком Эрвином Шредингером в 1920-х годах.Сегодня эта модель известна как квантовая модель или модель электронного облака. Внутренние орбитали, окружающие атом, имеют сферическую форму, но внешние орбитали намного сложнее.
Электронная конфигурация атома относится к расположению электронов в типичном атоме. Используя электронную конфигурацию и принципы физики, химики могут предсказать свойства атома, такие как стабильность, температура кипения и проводимость, согласно Лос-Аламосской национальной лаборатории .
Нейтроны
Согласно Американского физического общества , существование нейтрона было теоретизировано Резерфордом в 1920 году и обнаружено Чедвиком в 1932 году. Нейтроны были обнаружены в ходе экспериментов, когда атомы стреляли в тонкий лист бериллия . Были выпущены субатомные частицы без заряда — нейтрон.
Нейтроны — это незаряженные частицы, находящиеся во всех атомных ядрах (кроме водорода). Масса нейтрона немного больше массы протона.Как и протоны, нейтроны также состоят из кварков — одного кварка «вверх» (с положительным зарядом 2/3) и двух кварков «вниз» (каждый с отрицательным зарядом в одну треть).
История атома
Теория атома восходит, по крайней мере, к 440 году до нашей эры. Демокриту, греческому ученому и философу. Демокрит, скорее всего, построил свою теорию атомов на работах философов прошлого, согласно Эндрю Г. Ван Мелсену, автору книги «От атомоса к атому: история концепции атома» (Duquesne University Press, 1952).
Объяснение атома Демокритом начинается с камня. Разрезанный пополам камень дает две половинки одного и того же камня. Если бы камень резался непрерывно, в какой-то момент существовал бы кусок камня, достаточно маленький, чтобы его больше нельзя было разрезать. Термин «атом» происходит от греческого слова «неделимый», которое, по заключению Демокрита, должно быть точкой, в которой существо (любая форма материи) больше не может быть разделено.
Его объяснение включало идеи о том, что атомы существуют отдельно друг от друга, что существует бесконечное количество атомов, что атомы могут двигаться, что они могут объединяться вместе, чтобы создать материю, но не сливаются, чтобы стать новым атомом, и что их нельзя разделить, согласно Universe Today .Однако, поскольку большинство философов того времени — особенно очень влиятельный Аристотель — считали, что вся материя была создана из земли, воздуха, огня и воды, атомная теория Демокрита была отложена.
Джон Далтон, британский химик, опирался на идеи Демокрита в 1803 году, когда он выдвинул свою собственную атомную теорию, согласно данным химического факультета Университета Пердью . Теория Дальтона включала несколько идей Демокрита, например, атомы неделимы и неразрушимы, и что разные атомы образуются вместе, чтобы создать всю материю.Дополнения Дальтона к теории включали следующие идеи: что все атомы определенного элемента были идентичны, что атомы одного элемента будут иметь другой вес и свойства, чем атомы другого элемента, что атомы не могут быть созданы или разрушены и что материя образована атомы соединяются в простые целые числа.
Британский физик Томсон, открывший электрон в 1897 году, доказал, что атомы можно разделить, согласно Фонд химического наследия .Он смог определить существование электронов, изучая свойства электрического разряда в электронно-лучевых трубках. Согласно статье Томсона 1897 года, лучи отклонялись внутри трубки, что доказывало, что внутри вакуумной трубки было что-то отрицательно заряженное. В 1899 году Томсон опубликовал описание своей версии атома, широко известной как «модель сливового пудинга». Выдержка из этой статьи находится на сайте Chem Team . Модель атома Томсона включала большое количество электронов, подвешенных в чем-то, что производило положительный заряд, придающий атому общий нейтральный заряд.Его модель напоминала сливовый пудинг, популярный британский десерт с изюмом, подвешенным в круглом шаре, похожем на торт.
Следующим ученым, изменившим и усовершенствовавшим атомную модель, был Резерфорд, который учился у Томсона, согласно химическому факультету Университета Пердью . В 1911 году Резерфорд опубликовал свою версию атома, которая включала положительно заряженное ядро, вращающееся вокруг электронов. Эта модель возникла, когда Резерфорд и его помощники стреляли альфа-частицами в тонкие листы золота.По данным лаборатории Джефферсона, альфа-частица состоит из двух протонов и двух нейтронов, удерживаемых вместе одной и той же сильной ядерной силой, которая связывает ядро.
Ученые заметили, что небольшой процент альфа-частиц был рассеян под очень большими углами к первоначальному направлению движения, в то время как большая часть прошла сквозь них практически без помех. Резерфорд смог приблизительно определить размер ядра атома золота, обнаружив, что оно как минимум в 10 000 раз меньше, чем размер всего атома, причем большая часть атома представляет собой пустое пространство.Модель атома Резерфорда по-прежнему является основной моделью, которая используется сегодня.
Несколько других ученых продвинули модель атома, в том числе Нильса Бора (построенного на модели Резерфорда для включения свойств электронов на основе спектра водорода), Эрвина Шредингера (разработал квантовую модель атома), Вернера Гейзенберга (заявил, что не может знать одновременно положение и скорость электрона), а также Мюррей Гелл-Манн и Джордж Цвейг (независимо разработали теорию о том, что протоны и нейтроны состоят из кварков).
Дополнительные ресурсы:
Эта статья была обновлена 10 сентября 2019 г. участником Live Science Трейси Педерсен.
.
Атом, полный атомов — ScienceDaily
Что находится внутри атома, между ядром и электроном? Обычно ничего нет, но почему не могло быть и других частиц? Если электрон вращается вокруг ядра на большом расстоянии, между другими атомами остается много места. Может быть создан «гигантский атом», заполненный обычными атомами. Все эти атомы образуют слабую связь, создавая при низких температурах новое экзотическое состояние вещества, называемое «ридберговскими поляронами».
Группа исследователей представила это состояние в журнале Physical Review Letters .Теоретическая работа проводилась в Венском техническом университете (Вена) и Гарвардском университете, эксперимент проводился в университете Райса в Хьюстоне (Техас).
Ультрахолодная физика
В этом исследовательском проекте были объединены две очень специальные области атомной физики, которые можно изучать только в экстремальных условиях: конденсаты Бозе-Эйнштейна и ридберговские атомы. Конденсат Бозе-Эйнштейна — это состояние вещества, созданное атомами при ультрахолодных температурах, близких к абсолютному нулю. Атомы Ридберга — это атомы, в которых один единственный электрон переведен в высоковозбужденное состояние и вращается вокруг ядра на очень большом расстоянии.
«Среднее расстояние между электроном и его ядром может достигать нескольких сотен нанометров — это более чем в тысячу раз больше радиуса атома водорода», — говорит профессор Иоахим Бургдёрфер. Вместе с профессором Шухей Йошидой (оба — TU Wien, Вена) он много лет изучал свойства таких ридберговских атомов. Идея нового исследовательского проекта возникла в результате длительного сотрудничества с Университетом Райса в Хьюстоне.
Сначала был создан конденсат Бозе-Эйнштейна с атомами стронция.С помощью лазера энергия передавалась одному из этих атомов, превращая его в ридберговский атом с огромным атомным радиусом. В этом атоме вызывает недоумение то, что радиус орбиты, по которой электрон движется вокруг ядра, намного больше, чем типичное расстояние между двумя атомами в конденсате. Следовательно, электрон вращается не только вокруг своего атомного ядра, но и множество других атомов также находятся внутри его орбиты. В зависимости от радиуса ридберговского атома и плотности конденсата Бозе-Эйнштейна огромная электронная орбита может охватывать до 170 дополнительных атомов стронция.
Нейтральные атомы не нарушают орбиту электрона
Эти атомы практически не влияют на путь этого ридберговского электрона. «Атомы не несут никакого электрического заряда, поэтому они оказывают минимальную силу на электрон», — говорит Шухей Йошида. Но в очень небольшой степени электрон все же ощущает присутствие нейтральных атомов на своем пути. Он рассеивается на нейтральных атомах, но очень незначительно, не покидая своей орбиты. Квантовая физика медленных электронов допускает такое рассеяние, которое не переводит электрон в другое состояние.
Как показывает компьютерное моделирование, этот сравнительно слабый вид взаимодействия снижает полную энергию системы, и таким образом создается связь между ридберговским атомом и другими атомами внутри электронной орбиты. «Это в высшей степени необычная ситуация, — говорит Шухей Ёсида. «Обычно мы имеем дело с заряженными ядрами, связывающими электроны вокруг себя. Здесь у нас есть электрон, связывающий нейтральные атомы».
Эта связь намного слабее, чем связь между атомами в кристалле. Следовательно, это экзотическое состояние вещества, называемое ридберговскими поляронами, может быть обнаружено только при очень низких температурах.Если бы частицы двигались быстрее, связь разорвалась бы. «Для нас это новое, слабосвязанное состояние материи — захватывающая новая возможность исследования физики ультрахолодных атомов», — говорит Иоахим Бургдёрфер. «Таким образом можно исследовать свойства конденсата Бозе-Эйнштейна в очень малых масштабах с очень высокой точностью».
История Источник:
Материалы предоставлены Венским технологическим университетом . Примечание. Содержимое можно редактировать по стилю и длине.
.
Материя: определение и пять состояний материи
Материя — это «вещество», из которого состоит Вселенная; все, что занимает пространство и имеет массу, является материей.
Вся материя состоит из атомов , которые, в свою очередь, состоят из протонов, нейтронов и электронов.
По данным Вашингтонского государственного университета , атомы объединяются в молекулы, которые являются строительными блоками для всех типов материи. И атомы, и молекулы удерживаются вместе с помощью формы потенциальной энергии, называемой химической энергией.В отличие от кинетической энергии , которая представляет собой энергию движущегося объекта, потенциальная энергия — это энергия, запасенная в объекте.
Пять фаз материи
Существует четыре естественных состояния материи: твердые тела, жидкости, газы и плазма. Пятое состояние — это искусственные конденсаты Бозе-Эйнштейна.
Твердые тела
В твердом теле частицы плотно упакованы друг в друга, поэтому они мало двигаются. Электроны каждого атома постоянно находятся в движении, поэтому атомы имеют небольшую вибрацию, но они зафиксированы в своем положении.Из-за этого частицы в твердом теле имеют очень низкую кинетическую энергию.
Твердые тела имеют определенную форму, а также массу и объем и не соответствуют форме контейнера, в который они помещены. Твердые вещества также имеют высокую плотность, что означает, что частицы плотно упакованы вместе.
Жидкости
В жидкости частицы упакованы более свободно, чем в твердом теле, и могут обтекать друг друга, придавая жидкости неопределенную форму.Таким образом, жидкость будет соответствовать форме емкости.
Как и твердые тела, жидкости (большинство из которых имеет более низкую плотность, чем твердые тела) невероятно трудно сжимать.
Газы
В газе частицы имеют большое пространство между собой и высокую кинетическую энергию. У газа нет определенной формы или объема. Если не ограничен, частицы газа будут распространяться бесконечно; если он ограничен, газ расширится, чтобы заполнить свой контейнер.Когда газ подвергается давлению за счет уменьшения объема контейнера, пространство между частицами уменьшается, и газ сжимается.
Плазма
Плазма не является обычным состоянием материи здесь, на Земле, но, по данным лаборатории Джефферсона , это может быть наиболее распространенное состояние материи во Вселенной. Звезды — это, по сути, перегретые шары плазмы.
Плазма состоит из сильно заряженных частиц с чрезвычайно высокой кинетической энергией.Благородные газы (гелий, неон, аргон, криптон, ксенон и радон) часто используются для создания светящихся знаков с помощью электричества для ионизации их до состояния плазмы.
Конденсат Бозе-Эйнштейна
Конденсат Бозе-Эйнштейна (BEC) был создан учеными в 1995 году. Используя комбинацию лазеров и магнитов, Эрик Корнелл и Карл Вейман, ученые Объединенного института лабораторной астрофизики ( JILA) в Боулдере, штат Колорадо, охладил образец рубидия с точностью до нескольких градусов от абсолютного нуля.При такой чрезвычайно низкой температуре движение молекул почти прекращается. Поскольку кинетическая энергия почти не передается от одного атома к другому, атомы начинают слипаться. Больше нет тысяч отдельных атомов, есть только один «суператом».
BEC используется для изучения квантовой механики на макроскопическом уровне. Кажется, что свет замедляется при прохождении через BEC, что позволяет ученым изучать парадокс частицы / волны. БЭК также обладает многими свойствами сверхтекучей жидкости или жидкости, которая течет без трения.BEC также используются для моделирования условий, которые могут существовать в черных дырах.
Прохождение фазы
Добавление или удаление энергии из материи вызывает физическое изменение, когда материя перемещается из одного состояния в другое. Например, добавление тепловой энергии (тепла) к жидкой воде превращает ее в пар или пар (газ). А удаление энергии из жидкой воды превращает ее в лед (твердое тело). Физические изменения также могут быть вызваны движением и давлением.
Плавление и замерзание
Когда твердое тело нагревается, его частицы начинают вибрировать быстрее и отдаляться друг от друга.Когда вещество достигает определенной комбинации температуры и давления, его точка плавления , твердое вещество начинает плавиться и превращаться в жидкость.
Когда два состояния вещества, например твердое и жидкое, находятся при равновесной температуре и давлении, дополнительное тепло, добавленное в систему, не приведет к увеличению общей температуры вещества, пока весь образец не достигнет одинакового физического состояния. Например, если вы положите лед в стакан с водой и оставите его при комнатной температуре, лед и вода в конечном итоге достигнут одинаковой температуры.Поскольку лед тает от тепла, исходящего от воды, он будет оставаться при 0 градусах Цельсия, пока весь кубик льда не растает, а затем продолжит нагреваться.
Когда тепло отводится от жидкости, ее частицы замедляются и начинают оседать в одном месте внутри вещества. Когда вещество достигает достаточно прохладной температуры при определенном давлении, точке замерзания, жидкость становится твердой.
Большинство жидкостей сжимаются при замерзании. Вода, однако, расширяется, когда замерзает в лед, заставляя молекулы раздвигаться дальше и уменьшать плотность, поэтому льда плавает поверх воды .
Добавление дополнительных веществ, таких как соль в воду, может изменить температуру плавления и замерзания. Например, добавление соли в снег снизит температуру замерзания воды на дорогах, что сделает его более безопасным для водителей.
Существует также точка, известная как тройная точка , где твердые тела, жидкости и газы существуют одновременно. Вода, например, существует во всех трех состояниях при температуре 273,16 Кельвина и давлении 611,2 Па.
Большинство жидкостей сжимаются при замерзании, но вода расширяется, делая ее менее плотной, когда она становится льдом.Эта уникальная характеристика позволяет льду плавать в воде, как этот массивный айсберг в Антарктиде. (Изображение предоставлено NASA / Operation Icebridge)
Сублимация
Когда твердое вещество превращается непосредственно в газ, минуя жидкую фазу, этот процесс известен как сублимация. Это может происходить либо при быстром повышении температуры образца выше точки кипения (мгновенное испарение), либо при «лиофилизации» вещества путем охлаждения в условиях вакуума, чтобы вода в веществе подвергалась сублимации и удалялась из пример.Некоторые летучие вещества претерпевают сублимацию при комнатной температуре и давлении , например замороженный диоксид углерода или сухой лед.
Испарение
Испарение — это превращение жидкости в газ, которое может происходить либо при испарении, либо при кипении.
Поскольку частицы жидкости находятся в постоянном движении, они часто сталкиваются друг с другом. Каждое столкновение также вызывает передачу энергии, и когда достаточно энергии передается частицам вблизи поверхности, они могут быть полностью выбиты от образца в виде свободных частиц газа.Жидкости охлаждаются по мере испарения, потому что энергия, передаваемая поверхностным молекулам, вызывающая их утечку, уносится вместе с ними.
Жидкость закипает, когда к жидкости добавляется достаточно тепла, чтобы вызвать образование пузырьков пара под поверхностью. Эта точка кипения — это температура и давление, при которых жидкость становится газом.
Конденсация и осаждение
Конденсация происходит, когда газ теряет энергию и объединяется с образованием жидкости.Например, водяной пар конденсируется в жидкую воду .
Осаждение происходит, когда газ превращается непосредственно в твердое тело, минуя жидкую фазу. Водяной пар превращается в лед или иней, когда воздух, соприкасающийся с твердым телом, например травинкой, холоднее, чем остальной воздух.
Дополнительные ресурсы:
Эта статья была обновлена 21 августа 2019 г. автором Live Science Рэйчел Росс.
.
Chem4Kids.com: Атомы
Что такое атом? Атомы — строительные блоки. Если вы хотите создать язык, вам понадобится алфавит. Если вы хотите построить молекулы, вам понадобятся атомы из разных элементов. Элементы — это алфавит на языке молекул.
Каждый элемент немного отличается от остальных. В английском языке вы знаете, что «B» отличается от «C.» В химии «B» также отличается от «C», потому что бор (B) и углерод (C) — это разные элементы с атомами, которые имеют разную структуру.Атомы определяются как наименьшие единицы материи, которые обладают свойствами отдельного элемента.
Существуют ли частицы материи меньше атома? Конечно. Атомы состоят из более мелких и даже более мелких частиц вещества. Однако эти более мелкие частицы не обладают свойствами элемента. Электроны в атоме золота (Au) такие же, как электроны в атоме неона (Ne). В химии нам нравится изучать атомы, потому что Вселенная вращается вокруг свойств элементов, а не обязательно свойств электрона или протона.
Например, у вас есть слиток золота. Вы знаете, что этот стержень состоит из материи, потому что все состоит из материи. Поскольку это чистое золото, в слитке есть только атомы золота. Если бы у вас в руке был только один атом золота, он имел бы те же свойства, что и любой другой атом золота в этом слитке. Но что, если бы у вас был только один электрон от атома золота? Этот электрон больше не обладал бы свойствами золота. Это был бы просто электрон, занимающийся электронными вещами. Атом — это наименьшая единица, обладающая свойствами элемента.
Мы можем рассказать вам об общей структуре атома, но вам нужно изучить атомы из разных элементов, чтобы действительно узнать, как атомы работают.
Давайте снова поработаем с идеей алфавита. Если вы читаете книгу, вы найдете слова на каждой странице. Эти слова составляют буквы. В английском языке всего двадцать шесть букв, но мы можем составить тысячи слов. В химии вы работаете почти со 120 элементами. Когда вы их объединяете, вы можете получить миллионы разных молекул.
Молекулы — это группы атомов, точно так же, как слова — это группы букв. «А» всегда будет «А», независимо от того, в каком слове он находится. Атом натрия (Na) всегда будет атомом натрия, независимо от того, в какой молекуле он находится. Хотя атомы разных элементов имеют разные массы и структуры, все они построены из одинаковых деталей. Электроны, протоны и нейтроны являются основными субъединицами всех атомов во Вселенной.
Если вы хотите немного подумать, представьте мельчайшие частицы материи.Сверхмалые субатомные частицы используются для создания частей атомов. Протоны, нейтроны и электроны могут затем организовать атомов . Затем атомы используются для создания молекул вокруг нас. Как мы только что узнали, в известных нам молекулах содержится почти 120 элементов. Более мелкие молекулы могут работать вместе и строить макромолекул . Это просто продолжается. Все, что вы видите или представляете, построено на чем-то другом.
Можно начать с малого…
— Частицы материи
— Атомы
— Молекулы
— Макромолекулы
— Органеллы клетки
— Ячейки
— Салфетки
— Органы
— Системы
— Организмы
— Население
чел.
— Экосистемы
— Биомы
— Планеты
— Системы со звездами
— Галактики
— Вселенная
…И финиш действительно большой.
Вау! Все это возможно благодаря атомам.
Звезда выворачивается наизнанку (видео НАСА)
.



