Электродные потенциалы и электродвижущие силы. Что такое эдс в химии
Электродвижущая сила (эдс) гальванического элемента
Причиной возникновения электрического тока в гальваническом элементе является разность электродных потенциалов двух окислительно-восстановительных систем. Эту разность обозначают символом ∆Е и называют электродвижущей силой (ЭДС) гальванического элемента. Поскольку ЭДС - величина положительная, её находят кАк разность между большим (катод) и меньшим (анод) значениями электродных потенциалов:
∆Е = Е(катода) – Е(анода).
Таблица стандартных окислительно-восстановительных потенциалов
Чаще всего в таких таблицах полуреакции восстановления приводятся не в порядке увеличения значений Ео, а группируются по признаку содержания в них определённых элементов, например, соединения азота, марганца, хрома и т.д. Обратите внимание на следующее. В таблице, в соответствии с рекомендациями ИЮПАК, все полуреакции записаны в виде процессов восстановления, хотя в ходе любой ОВР полуреакция восстановления всегда сочетается с полуреакцией окисления. Запомните, что из двух полуреакций восстановления слева направо всегда протекает полуреакция с бóльшим значением Ео. Другая полуреакция с меньшим значением Ео всегда протекает в обратном направлении и является фактически полуреакцией окисления. Поэтому при составлении уравнений ОВР полуреакцию с меньшим значением Ео нужно «превратить» в полуреакцию окисления. Для этого в соответствующем уравнении необходимо поменять местами окисленную и восстановленную формы, оставив электроны в левой части, но перед их числом изменить знак с «плюса» на «минус». Учтите, что при этом знак электродного потенциала не меняется!
Используя значения электродных или окислительно-восстановительных потенциалов полуреакций, можно выполнить следующие операции:
1. Оценить окислительно-восстановительные свойства веществ.
Из нескольких веществ более сильными восстановительными свойствами обладает то вещество, которому соответствует полуреакция с более низким значением потенциала. И наоборот: более сильными окислительными свойствами обладает то вещество, которому соответствует полуреакция с более высоким значением потенциала.
2. Предсказать принципиальную возможность осуществления реакции в
указанном направлении.
Протекание окислительно-восстановительной реакции в данном направлении возможно лишь тогда, когда потенциал полуреакции с участием используемого окислителя будет больше потенциала полуреакции с участием используемого восстановителя.
3. Определить направление протекания реакции.
Любая ОВР всегда протекает в том направлении, в котором осуществляется полуреакциия с более высоким значением потенциала. Этому направлению соответствует положительное значение ЭДС реакции. Однако необходимо помнить, что в данном направлении реакция протекает практически необратимо при ЭДС, большей либо равной 0,4 В. Если же разность потенциалов оказывается меньше 0,4 В, то ОВР протекает обратимо и направление реакции определяется условиями ее проведения.
4. Выбрать наиболее вероятную реакцию из нескольких возможных.
Из всех возможных ОВР наиболее вероятной будет та реакция, которой соответствует максимальное значение (ЭДС).
3. Окислительно-восстановительные процессы с участием электрического тока. Электролиз расплавов и водных растворов электролитов. Электролиз с инертными и активными электродами. Схемы процессов на электродах. Получение неорганических веществ и их очистка при помощи электрического тока. Химические источники тока.
1. с. 155-159; 2. с. 285-295; 3. с. 350-358; 4. с. 236; 6. с. 285-287.
Э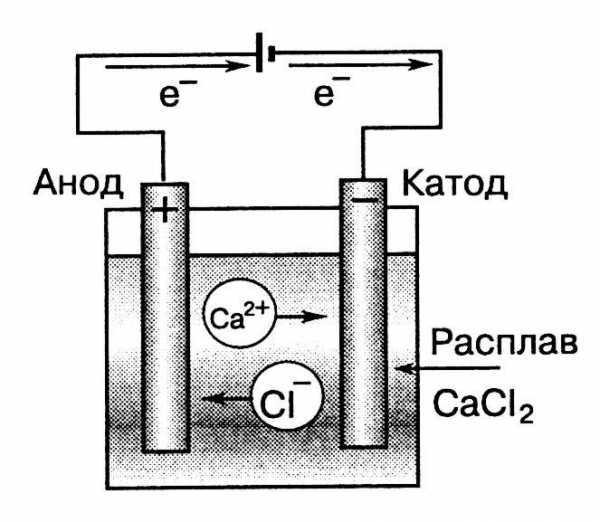 лектролиз – электрохимический окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплавы или растворы электролитов.
лектролиз – электрохимический окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплавы или растворы электролитов.
При электролизе энергия электрического тока превращается в химическую энергию и при этом осуществляется процесс, обратный происходящему в гальваническом элементе.
О
Рис.5.
Схема процесса электролиза расплава хлорида кальция
братите внимание, что заряды электродов при электролизе противоположны зарядам электродов в гальваническом элементе. Поэтому:Катод – отрицательно заряженный электрод, соединённый с отрицательным полюсом источника тока. Катод при электролизе является восстановителем. На его поверхности протекают процессы катодного восстановления. Катод всегда изготавливается из инертных материалов (графит, платина, золото, иридий и др.)
Анод – положительно заряженный электрод, который при электролизе является окислителем. На его поверхности всегда протекают процессы анодного окисления. Анод может быть изготовлен как из инертных материалов («инертный» или «нерастворимый» анод), так и из металлов, способных в ходе электролиза переходить в раствор («растворимый анод»).
При пропускании электрического тока через расплав или раствор электролита содержащиеся в нём ионы принимают направленное движение: положительно заряженные катионы направляются к отрицательно заряженному катоду, а отрицательно заряженные анионы – к положительно заряженному катоду (Рис. 6).
Процессы на катоде.
В расплавах электролитов на катоде всегда происходит восстановление катионов металлов по схеме: Меn+ + ne- = Me0 .
В водных растворах электролитов характер процессов на катоде определяется природой катионов:
а) катионы H+ : 2Н+ + 2е- = Н2.
б) катионы [Li+ – Al3+ ] и катионы Nh5+: 2Н2О + 2е- = Н2 + 2ОН-.
в) катионы [Bi3+ – Au3+]: Меn+ + ne- = Me0 .
г) катионы [Mn2+ – Pb2+]: одновременно восстанавливаются катионы металлов и молекулы воды.
Процессы на инертном аноде.
В расплавах электролитов.
а) анионы ОН-: 4ОН- - 4е- = О2 + 2Н2О;
б) галогенид-анионы: 2Гал- -2е- = Гал20;
в) сульфид- и селенид-анионы: Э2- - 2е- = Э0;
В водных растворах электролитов.
а) анионы ОН-: 4ОН- - 4е- = О2 + 2Н2О;
б) анионы Гал- кроме F-: 2Гал- -2е- = Гал20;
в) сульфид- и селенид-анионы: Э2- - 2е- = Э0;
г) анионы кислородсодержащих неорганических кислот и анионы F-:
2h3O – 4e- = O2 + 4H+
д) анионы карбоновых кислот: 2RCOO- -2e- = R2 + 2CO2.
При электролизе с растворимым анодом происходит его окисление по схеме:
Ме0 – ne- = Men+.
Образующиеся при этом катионы переходят в раствор и восстанавливаются на катоде. Таким образом, электролиз с растворимым анодом заключается в переносе металла с анода на катод.
Пример. С оставим схемы процессов, протекающих на электродах при электролизе раствора хлорида натрия и общее уравнение процесса.
оставим схемы процессов, протекающих на электродах при электролизе раствора хлорида натрия и общее уравнение процесса.
П ример. Составим схемы процессов, протекающих на электродах при электролизе раствора сульфата меди(II) и общее уравнение процесса.
ример. Составим схемы процессов, протекающих на электродах при электролизе раствора сульфата меди(II) и общее уравнение процесса.
Пример. Составим схемы процессов, протекающих на электродах при электролизе раствора сульфата калия и общее уравнение процесса.
studfiles.net
Электродные потенциалы и электродвижущие силы
Если при проведении окислительно-восстановительной реакции процессы окисления и восстановления разделить в пространстве, а переход электронов от восстановителя к окислителю проводить по внешней цепи, то полученное устройство называется гальваническим элементом(Г.Э.).
Обычно Г.Э. составляется из двух разнородных металлов, погруженных в растворы одноименных с этими металлами солей. Растворы сообщаются друг с другом через пористые перегородки. Генерация постоянного электрического тока осуществляется за счет различия природы металлов, из которых составлен Г.Э. Система «металл-раствор соли» называетсяэлектродом. Электрод, на котором идет процесс восстановления, называетсякатодом, на котором идет процесс окисления, называетсяанодом.
Существуют Г.Э., в которых генерация постоянного электрического тока осуществляется за счет различия в концентрациях растворов соли металла. В этом случае электроды состоят из одного и того же металла, погруженного в растворы соли металла различной концентрации. Такие Г.Э. называют концентрационными.
Если внешняя цепь в Г.Э. разомкнута, то электрический ток не вырабатывается, а на каждом электроде устанавливается динамическое равновесие, формируется двойной электрический слой между поверхностью металла и раствором соли. Таким образом, на поверхности каждой из пластинок создается определенная электрическая напряженность (т.е. имеет место скачок потенциала). Абсолютная величина этого скачка остается неизвестной, поэтому пользуются относительными значениями электродных потенциалов.
Стандартным электродным потенциаломметалла называют электродный потенциал этого металла, возникающий при его погружении в раствор одноименной с ним соли с молярной концентрацией солиСм(Men+)= 1 моль/л, измеренный по отношению кстандартному водородному электроду, потенциал которого при 25ºС принят равным нулюЕº(2Н+|Н2)= 0 В.
Если все металлы расположить в ряд по мере возрастания их стандартных электродных потенциалов (Еº), то получится «ряд напряжений» (или ряд активности, или ряд стандартных электродных потенциалов).
Положение того или иного металла в ряду активности характеризует его активность (т.е. восстановительную способность, как главное химическое свойство металлов). Чем меньше значение Еº(Меn+|Me), тем больше его активность (восстановительная способность).
Если пластинка металла погружена в раствор соли металла с концентрацией раствора отличной от 1 моль/л, то величина скачка потенциала на границе металл-раствор, рассчитывается по формуле Нернста:
,
где Еº– стандартный электродный потенциал (см. табл. 15) металла;n– число электронов, принимающих участие в процессе;См(Меn+)– молярная концентрация катионов металла в растворе соли.
Если обе металлические пластинки соединить проводником через гальванометр или через потребителя (например, электрическую лампочку), то по внешней цепи будет осуществляться ток электронов от более активного металла к менее активному. Таким образом, более активный металл является анодом, отдавая электроны менее активному металлу – катоду.
Гальванические элементы принято записывать схемой:
(анод) Me1|Me1n+|| Ме2m+|Ме2(катод),
Me1– более активный металл, Ме2– менее активный металл. Вертикальная линия обозначает поверхность раздела между металлом и раствором его соли, а двойная линия – пористую перегородку между растворами двух солей. Для такого Г.Э. при прохождении тока осуществляются следующие процессы:
Ме1–nē →Me1n+(анод – процесс окисления)
Ме2m++mē →Me2(катод – процесс восстановления)
Электродвижущая сила (ЭДС) Г.Э. – максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента. Реальное напряжение всегда меньше ЭДС, т.к. работа обратима, только если процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала.
Пример. Записать уравнения анодного и катодного процессов, происходящих при работе Г.Э., составленного из пластинок магния и никеля, погруженных в растворы одноименных с ними солей с концентрациямиCM(Mg2+) = 0,01MиCM(Ni2+) = 0,001M. Найти ЭДС данного элемента и записать суммарное уравнение процесса, проходящего в данном Г.Э.
Схема (Г.Э.): (анод) Mg|Mg2+||Ni2+|Ni(катод).
Магний является анодом, т.к. он имеет меньший стандартный электродный потенциал. Таким образом, уравнения катодного и анодного процессов будут выглядеть следующим образом:
Mg– 2ē →Mg2+(анод – окислениеMg)
Ni2++ 2ē →Ni(катод – восстановлениеNi2+)
Для расчета ЭДС (ΔЕ) следует иметь в виду, что ЭДС не может быть отрицательной величиной, поэтому:
ΔЕ = Е(кат.) – Е(ан.).
Электродные потенциалы катода и анода рассчитываются по уравнению Нернста:
ΔЕ = Е(кат.) – Е(ан.) =–0,339В–(–2,459В) = 2,120В.
Уравнение ОВР, характеризующей работу данного Г.Э., получаем, сложив два электронных уравнения, подобно тому как складываются полуреакции (если необходимо, умножить уравнения на соответствующие множители для сокращения электронов):
Mg+Ni2+→Mg2++Ni.
Суммарное уравнение в молекулярном виде может быть таким:
Mg + NiSO4 = Ni + MgSO4.
studfiles.net
Химик.ПРО - ЭДС гальванического элемента
Разберите работу гальванического элемента. Напишите электронные уравнения анодного и катодного процессов, составьте суммарное ионное уравнение окислительно-восстановительной реакции в гальваническом элементе и вычислите ЭДС гальванического элемента.
Мn | MnSO4 || FeSO4 | Fe,
СMn2+=10-2моль/л, СFe2+= 10-2 моль/л.
Решение задачи
ЭДС гальванического элемента
Гальванический элемент (ГЭ) – это устройство, в котором энергия химической реакции превращается в электрическую. В основе работы гальванического элемента лежит ОВР.
Мn | MnSO4 || FeSO4 | Fe,
СMn2+=10-2моль/л, СFe2+= 10-2 моль/л.
Пользуясь уравнением Нернста, вычисляем значения электродных потенциалов марганца и железа в растворах заданной концентрации:
E (Mn2+/Mn0) < E (Fe2+/Fe0), следовательно, более активным металлом является марганец, он будет отрицательным электродом – анодом, а железо – катодом.
Таким образом, Mn – анод (А) и Mn – восстановитель, Fe – катод.
(-)Мn | MnSO4 || FeSO4 | Fe (+)
Электроны двигаются от марганеца к железу. ЭДС гальванического элемента
Запишем электронные уравнения процессов, протекающих на электродах, и составим суммарное уравнение.
(-) (А) Mn0 – 2e = Mn2+ – процесс окисления;(+)(K) Fe2+ + 2e = Fe0 – процесс восстановления.
Mn0+ Fe2+= Mn2+ + Fe0
Записываем молекулярное уравнение окислительно-восстановительной реакции, лежащей в основе работы гальванического элемента:Mn0+ FeSO4→ MnSO4+ Fe0↓
Рассчитываем ЭДС гальванического элемента:
Ответ:
ЭДС гальванического элемента 0,75 Вольт.
Похожие задачи по химии
himik.pro
Утверждаю
8
Ректор университета
____________А.В. Лагерев
«____»____________2008 г.
ХИМИЯ
ОПРЕДЕЛЕНИЕ ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
И ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА МЕТАЛЛА
Методические указания
к выполнению лабораторной работы
для студентов всех форм обучения
всех специальностей
БРЯНСК 2008
УДК 541.8
Химия. Определение ЭДС гальванического элемента и электродного потенциала металла: методические указания к выполнению лабораторной работы для студентов всех форм обучения всех специальностей. – Брянск: БГТУ, 2008. - 8 с.
Разработали: Е.В. Удовенко, асс.,
О.Г. Казаков, к.х.н., доц.,
О.Ф. Котелович, к.х. н., доц..
И.В. Ильина, к.б.н.
Рекомендованы кафедрой «Безопасность жизнедеятельности и химия» БГТУ (протокол № 5 от 22.01.08)
Научный редактор О.Г. Казаков
Редактор издательства Л.И. Афонина Компьютерный набор Е.В.Удовенко
Темплан 2008 г., п. 64
Подписано в печать Формат 60x84 1/16. Бумага офсетная. Офсетная печать. Усл. печ.л. 0,46. Уч.-изд.л. 0,46. Тираж 40 экз. Заказ Бесплатно.
Брянский государственный технический университет.
241035, Брянск, бульвар 50-летия Октября, 7, БГТУ. 58-82-49. Лаборатория оперативной полиграфии БГТУ, ул. Харьковская, 9.
1. Цель работы
Цель работы – ознакомиться с механизмом образования двойного электрического слоя, электродного потенциала и работой гальванического элемента.
Продолжительность работы – 4 часа.
2. Теоретическая часть
1.1. Механизм образования двойного электрического слоя
и электродного потенциала
При погружении металла в раствор собственной соли часть катионов, расположенных в поверхностном слое, под действием тепловой энергии и поляризующего действия молекул растворителя выходит в раствор. Вышедшие в раствор катионы взаимодействуют с молекулами растворителя - сольватируются (в случае водных растворов - гидратируются).
По мере увеличения концентрации катионов в растворе часть из них под действием электрического поля отрицательно заряженной поверхности будет возвращаться к поверхности и встраиваться в решетку металла. Через определенное время скорости процесса растворения металла и его кристаллизации уравняются. В результате наступит динамическое равновесие.
Большая часть вышедших в раствор катионов будет расположена вблизи поверхности металла. В этом случае силы притяжения катиона к поверхности будут равны силам, способствующим уходу катиона вглубь раствора. Таким образом, образуется двойной электрический слой на границе металл-электролит
Ме(к) + хН2О → Меn+.xh3O(водн) + ne-(к).
Обычно при записи уравнения равновесного процесса гидратацию не учитывают
Ме(к) → Меn+(водн) + ne-(к).
Скачок потенциала между противоположно заряженными поверхностью металла и раствором называют электродным потенциалом. Зависимость электродного потенциала от природы металла, температуры, концентрации потенциалопределяющих ионов выражается формулой Нернста
где φ0Ме/Меn+ - стандартное значение электродного потенциала; F- число Фарадея; n – величина заряда катиона; R – универсальная газовая постоянная; Т – температура.
При Т=2980К 2,3.RT/F=0,059.
studfiles.net
Окислительно-восстановительные потенциалы Электродвижущая сила химических источников тока.
Электродные потенциалы полуэлементов часто называют окислительно-восстановительными потенциалами. Принято указывать окислительно-восстановительные потенциалы в виде восстановительных потенциалов. Это означает, что равновесные полу-реакции должны записываться так, чтобы восстановление было прямой реакцией:
Окисленные частицы + ze = Восстановленные частицы
Окислительно-восстановительный потенциал является мерой способности восстановительного процесса к самопроизвольному протеканию.
В табл. 10.5 указаны стандартные окислительно-восстановительные потенциалы для ряда нолуреакций. Их значения находятся в пределах от — 3 В до + 3 В. Чем положительнее окислительно-восстановительный потенциал, тем легче должно происходить восстановление. Чем менее положительным или более отрицательным является окислительно-восстановительный потенциал, тем легче должно происходить окисление.
ЭЛЕКТРОДВИЖУЩАЯ СИЛА ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА
Как мы уже указывали, химический источник тока состоит из двух полуэлементов. Каждый полуэлемент характеризуется собственным электродным потенциалом. Когда эти два полуэлемента соединены и замкнуты внешней цепью, происходят два важных явления.
Во-первых, в источнике тока начинает протекать окислительно-восстановительная реакция. Эта реакция представляет собой сумму двух полуреакций. В результате нарушается равновесие в каждом из двух полуэлементов.
По мере протекания окислительно-восстановительной реакции концентрация окисленных частиц в анодном полуэлементе возрастает. Одновременно с этим концентрация окисленных частиц в катодном полуэлементе уменьшается. В конце концов окислительно-восстановительная реакция достигнет положения равновесия. Когда это произойдет, батарея истощится.
Во-вторых, когда два полуэлемента соединены и замкнуты внешней цепью, в ней возникает электрический ток, который течет от отрицательного электрода-анода к положительному электроду катоду. Причиной возникновения электрического тока является разность потенциалов полу элементов. Во внешней цепи этот ток представляет собой поток электронов. В двух полуэлементах электрический ток переносится ионами. По мере протекания тока концентрация окисленных частиц возрастает, а концентрация восстановленных частиц уменьшается. Следовательно, разность потенциалов между двумя электродами уменьшается. Когда будет достигнуто равновесие, разность потенциалов между двумя электродами (полуэлементами) станет равной нулю.
Максимальное значение разности потенциалов между двумя электродами называется электродвижущей силой (э.д.с.) химического источника тока. Это значение разности потенциалов гальванический элемент имеет в тот момент, когда он еще не использован для получения тока. Ниже будет рассказано, как можно определить э.д.с. гальванического элемента. Под стандартной э.д.с. химического источника тока Е° понимают его э.д.с. при стандартных условиях, указанных выше.
Оглавление:
www.himikatus.ru
Изучение электродвижущих сил гальванических элементов
Изучение причин и механизма возникновения и природы электродвижущих сил гальванических элементов было одним из важных направлений развития электрохимии.
Одна группа ученых во главе с Вольта видела в контакте различных металлов основную и единственную причину действия вольтова столба. Другая группа исследователей считала, что «гальванический процесс является химическим».
Это привело к появлению двух противоположных представлений о причинах возникновения электрического тока в вольтовом столбе — «химической» и «контактной» теорий, между сторонниками которых завязался длительный научный спор. Этот спор уже не раз привлекал к себе внимание историков науки и получил хорошее освещение в литературе.
Еще на заре возникновения электрохимии ученые обратили внимание на связь «электрического возбуждения», т. е. электродвижущей силы, с природой веществ, составляющих гальванический элемент, что послужило в дальнейшем сильной поддержкой химической теории гальванизма.
Так, в 1800 г. итальянский ученый Фаброни отстаивал мысль о том, что химические процессы являются энергетическим источником действия гальванических элементов.
И. В. Риттер установил в это же время факт фундаментального значения, что ряд напряжения металлов не отличается от их ряда окисления. Металлы расположены в ряду напряжения в том же порядке, в котором они вытесняют друг друга из растворов их солей (например, Zn, Сu, Аg и т. д.). Дэви, особенно в своих первых электрохимических работах, выступал как сторонник химической теорий. Процессы окисления цинка, протекающие при работе вольтова столба, Дэви считал важным аргументом в пользу теории, согласно которой химический процесс является источником и причиной электродвижущей силы элемента. В последующих работах Дэви отошел от такой односторонней трактовки. Он пришел к заключению, что химические процессы сами по себе не могут полностью объяснить вольтовых явлений так же, как и простой контакт элементов не может быть единственной причиной возникновения электродвижущих сил. По словам Рассела, «гений Дэви проявился в том, что оп взял обе противостоящие теории, сплавил их вместе и показал, как необходимы с некоторыми изменениями каждая из них и как одна дополняет другую».
Первоначально к сторонникам химической теории гальванических элементов принадлежал Берцелиус. Он считал, что одного контакта разных металлов без учета процессов их окисления недостаточно для возникновения тока. В 1810 г. Берцелиус сформулировал свои возражения против теории Вольта следующим образом:
- Если все условия Вольта выполнены, электрического тока не будет, если в столбе не происходит окисления.
- Ток возникает не из-за взаимодействия металлов, а только вследствие процесса окисления, который происходит в столбе.
По Берцелиусу, интенсивность заряда должна быть тем большей, чем «больше кислорода за данное время отдает жидкость металлу».
Впоследствии Берцелиус отказался от ряда своих утверждений (в том числе и от последнего) и встал на совершенно правильную точку зрения. Он считал, что ток в гальванической батарее возникает в результате контакта различных металлов, с одной стороны, и протекающих химических процессов, совершающихся в гальваническом элементе, с другой.
В «Ежегоднике» за 1830 г. Берцелиус по поводу своих ранних воззрений писал: «Я описал взгляды па причину возникновения электричества в столбе в статье под заголовком: «Теория электрического столба»,— но благодаря опытам, поставленным позднее, и в конце концов убедился, что… все же ток не возникает только с помощью химического действия».
Примечательно, что к подобному взгляду о двух причинах возникновения электродвижущей силы привела его электрохимическая теория. Приведем малоизвестное высказывание Берцелиуса по этому вопросу. В 1842 г. в очередном «Ежегоднике» Берцелиус писал: «Вопрос о действии электричества как химического агента и об его отношении к химическому сродству еще является предметом противоречивых обсуждений… Я осмеливаюсь утверждать, что тот, кто принимает электрохимическую теорию, отбрасывая контактное электричество, и выводит гидроэлектрические явления из химического действия, не может иметь последовательного представления об электрохимической теории в ее целостности, которая, наделяя противоположные электрические отношения тел химическим сродством, предполагает, что эти противоположные отношения проявляются и действуют только при соприкосновении тел. Стало своего рода модой отбрасывать опыты Вольта по контактному электричеству как приводящие к неправильным результатам…
Подобное отношение к важнейшим пунктам научных учений происходит тогда, когда не пытаются исследовать существо вопроса, а ищут только доказательств в пользу мления, на которое натолкнулись и которое полностью хотят оправдать…
Меня всегда удивляет, что те, кто пытается опровергнуть эти взгляды, большей частью никогда не рассматривают их в общей химической и физической целостности, а часто задерживаются на одном вопросе, согласованность которого с теоретическим взглядом они не могут увидеть. Но ничто меня так сильно не удивляло, как те исследования, которые одновременно принимают электрохимическую теорию и оспаривают контактное электричество, не понимая, что одно не может существовать без другого».
В России сторонником химической теории был В. В. Петров. Он считал, что: 1) контакт двух металлов не является причиной работы вольтова столба, так как крайние кружки, т. е. медный и цинковый, являющиеся только проводниками тока, можно удалить; 2) химические процессы, протекающие в элементе, играют решающую роль в возникновении электродвижущей силы.
Другим убежденным сторонником химической теории был профессор Г. Ф. Паррот (1767—1852) в Дернте. Приведем здесь некоторые малоизвестные высказывания Паррота, характеризующие его электрохимические взгляды.
Изучением химического действия гальванического электричества Паррот занялся с 1801 г. Им был опубликован ряд статей, в которых развивалась химическая теория вольтова столба. Электрохимические работы Паррота были в 1802 г. удостоены награды Гарлемского общества естествоиспытателей. Каковы же были доводы Паррота в пользу химической теории гальванических элементов? Разбирая действие сухого столба, построенного Цамбони, Паррот пришел к выводу, что «необходимость присутствия жидкости для образования электрического явления показывает, что причиной образовавшегося в вольтовом столбе электричества является химический процесс. Мои опыты покалывают, что наличие воды для действия столба Цамбони так же определенно и обязательно, как необходимо давление воздуха, чтобы поднять ртуть в барометре»,— писал Паррот.
Электролит в вольтовом столбе, по Парроту, необходим для процесса окисления металла; этот процесс и лежит в основе возникновения гальванического электричества. Подробно эта теория была изложена Парротом в его «Основах теоретической физики» (1811). Наряду с ошибочными представлениями о роли электричества и сил химического сродства в процессе электролиза и механизме разложения воды Паррот высказал ряд оригинальных и интересных для своего времени общих электрохимических гипотез.
Согласно Парроту: «1) …Электрические «вещества» в вольтовом столбе те же, каковые они и у обычного электричества. 2) Основное различие между гальваническими и обыкновенными электрическими явлениями происходит от различия в способах их получения. 3) Электрические материи способны к различным модификациям, имеющим свое происхождение в весомых материях… Электричество ничего не производит, кроме изменения формы веществ».
В статье «Новые эксперименты по химической теории электричества» он писал: «Физики знают, что с начала существования вольтова столба было две теории для объяснения действий этого столба. Первая — самого Вольта, известная под названием теории контакта, вторая — моя, известная под названием химической теории. Авторитет изобретателя электрода, конденсатора и столба возносил его в продолжении 28 лет во мнении физиков, пока де ля Рив… не подтвердил во всех положениях результаты моих опытов». Паррот отмечал, что «не существует никакого электрического контакта и что электричество столба происходит единственно от окисления металла». Это было, конечно, одностороннее мнение.
Изучение зависимости «силы» вольтова столба от свойств металла и промежуточной жидкости могло перейти от качественных наблюдений к количественным определениям только после того, как были найдены способы измерения силы тока, напряжения и сопротивления. Эти понятия в первой четверти XIX в. еще не были точно определены, и зависимость между ними не была установлена. Большим событием поэтому явились работы немецкого ученого Г. Ома и, в особенности, установление им в 1826 г. известного закона, позволяющего строго научно подходить к изучению электропроводности растворов.
В 1830 г. Омом, а за ним Фехнером были разработаны методы измерения электродвижущей силы различных элементов.
До 1833 г. для измерения силы тока употреблялись мультипликаторы Швейгера и Нобили. Это были весьма несовершенные приборы, ибо закон, связывающий величину углового отклонения магнитной стрелки с величиной силы тока, оставался неизвестным. Профессор Гельсингфоргского университета Нервандер опубликовал в 1833 г. описание первого гальванометра, в котором тангенсы углов отклонения магнитной стрелки были пропорциональны силам токов, отклонявшим эту стрелку.
В 1836 г. последовало изобретение Даниэлем элемента, нашедшего широкое применение в практике электрохимических исследований.
Изобретение Даниэлем элемента в 1836 г. «надобно поставить,— писал русский электрохимик Савельев,— наряду самых важных открытий в области гальванизма: постоянная батарея этого физика, устранив существенное неудобство цепей гидроэлектрических, представила возможность в мерительных гальванических исследованиях достигать такой точности, какая до того времени была решительно невозможна».
Создание постоянного гальванического элемента положило начало систематическому исследованию энергетики электрохимических процессов. Спор сторонников химической и контактной теории имел немалое значение для развития электрохимии, так как он способствовал усиленному изучению внутренних процессов. происходящих в гальваническом элементе.
Прежде всего, электрохимики занялись выяснением причин поляризация электрода, вызывающей изменение его потенциала. Явление поляризации впервые было открыто Риттером и независимо от него Готеро в 1803 г.
Для того, чтобы объяснить падение электродвижущей силы в работающем гальваническом элементе, в первой половине XIX в. была высказана гипотеза, что при переходе электрического тока из жидкости в металл существует часто механическая преграда.
Такого взгляда придерживались такие физики, как Г. Фехнер, де ля Рив и др. Де ля Рив сравнивал понижение проводимости на границе металл — раствор с отражением света «при переходе его из одной среды в другую. Совершенно новые представления о влиянии продуктов электролиза на величину электродвижущей силы элемента развил Шенбейн в 1839 г. Он показал, что в гальванических элементах поляризуются сами металлы, в результате чего возникает ток обратного направления. Теория гальванической поляризации была затем развита в трудах Поггендорфа, Ленца, Савельева и др.
Э. X. Ленц в работе «О законах выделения тепла гальваническим током» (1843) пришел к выводу, что для изучения природы прохождения тока через границу раствор — металл необходимо учитывать поляризацию электрода. «Мы — писал Ленц,— будем поступать последовательно и с большим соответствием с другими явлениями, если явления так называемого переходного сопротивления припишем одной только поляризации пластин и таким образом вычеркнем термин: «сопротивление перехода из номенклатуры гальванического тока».
В 1847 г. в работе, проведенной совместно с Савельевым, Ленц установил, что сила тока влияет на поляризацию. Исследователи обнаружили, что большей силе соответствует большая величина поляризации. Поляризация, как это заметил Ленц еще в работе 1843 г., зависит от природы электродов и состава раствора. В 1873 г. Ф. Кольрауш пришел к заключению, что величина электродвижущей силы поляризации пропорциональна количеству газов, выделившихся на электродах.
Электрохимические исследования Фарадея с неизбежностью заставили его принять участие в споре об источнике силы вольтова столба.
«Теория соприкосновения,— писал Фарадой в 1839 г.,— принимает, что из ничего может возникнуть сила, могущая преодолевать громадные сопротивления, например, плохих и хороших проводников, по которым проходит ток, и сопротивление электролитного действия, производящего разложение тела; что без всякого изменения в природе действующего вещества или без всякой затраты действующей силы можно получить ток, который будет продолжать действовать безостановочно, наперекор постоянным препятствиям и прекратится только, как в вольтовых столбах, в силу окончательного разложения, которое он произведет на своем пути, как гальванический ток. Это было бы поистине сотворением движущей силы из ничего, отличной от всякой другой силы в природе. У нас есть много способов изменять проявление данной силы, так что можно сказать, будто существует переход одной силы в другую. Мы ионием, например, превратить химические силы в электрический ток и обратно. Прекрасные опыты Зеебека и Пельтье показывают взаимные переходы теплоты и электричества, а из опытов Эрстеда и моих вытекает взаимная превращаемость электричества и магнетизма. И нет такого случая, не исключая даже электрического угря и ската, где бы родилась или возникла сила без соответственных затрат на это чего-нибудь другого».
Эти слова сказаны Фарадеем в 1839 г. до появления сочинения Роберта Майера «О силах неорганическом природы» и первых опытов Джоуля над механическим эквивалентом тепла.
После открытия закона сохранения и превращения энергии особое внимание в электрохимии было обращено па изучение вопроса о том, сколько внутренней работы способны передавать току разные химические реакции, совершающиеся в гальванических элементах. В работах Джоуля (1841), Гельмгольца (1847) и В. Томсона (1851) было развито положение, согласно которому электродвижущая сила гальванического элемента пропорциональна тепловому эффекту происходящей в нем реакции. Это положение представлялось как следствие закона сохранения энергии.
В связи с этим было обращено большое внимание на изучение взаимосвязи и взаимопереходов между злектродвижующей силой (ЭДС) гальванического элемента и теплотой, выделяющейся при химической реакции.
Соотношение, существующее между ЭДС и химической теплотой, было впервые исследовано Э. Беккерелем. После работ Беккереля и других ученых получило распространение положение, что ЭДС элемента пропорциональна тепловому эффекту протекающего в нем химического процесса. Эти представления проводились в то время во многих руководствах и учебниках физики и химии. «Уверенность в том,— писал М. Планк,— что электродвижущая сила цепи эквивалентна соответствующему ей химическому тепловому действию, была тогда, по-видимому, весьма широко распространена». Однако уже в 1854−1857 гг. из работ Фавра и Боша вытекал вывод, что не вся химическая теплота переходит в гальваническую, а некоторая ее часть расходуется в самом элементе. Исследования Рауля по этому вопросу подтвердили результаты, полученные Фавром.
Эдлунд в 1869 г. также утверждал, что потребляемое электродвижущей силой тепло не находится в простом отношении к тому количеству тепла, которое дают совершающиеся в гальваническом элементе химические процессы, и потому электродвижущая сила не может быть вычислена из термохимических величин. К таким же выводам пришел Браун.
Таким образом, были найдены факты, противоречащие простой термохимической теории электродвижущих сил. Было, в частности, найдено, что в цепи тока наблюдаются, кроме выделения джоулевой теплоты, также и другие термические эффекты, в частности эффект Пельтье (выделение пли поглощение тепла при прохождении тока через границу двух сред).
Первое правильное, термодинамически обоснованное решение вопроса о соотношении между электродвижущей силой и энергией химического процесса в гальваническом элементе было дано в трудах Д. Гиббса и Г. Гельмгольца.
В 1877 г. Гельмгольц, исследуя концентрационные цепи, составленные из одинаковых электродов и из электролита, представляющего собой раствор какой-либо соли, имеющей различную концентрацию у одного и другого электрода, пришел к выводу, что электродвижущая сила такой цепи зависит от логарифма концентраций:
E = a∙lg(C2/C1)
Только недостаточное развитие теории растворов не дало Гельмгольцу возможности определить коэффициент а перед логарифмом отношения концентраций. Это сделал позднее В. Нернст, который нашел выражение для электродвижущей силы такой цепи.
В 1882 г. в записках Берлинской академии наук была опубликована работа Гельмгольца: «Термодинамика химических процессов». В первой части этой работы Гельмгольц установил следующий общий принцип: согласно закону Карyо−Клаузиуса, направление и сила химической реакции в данной системе реагирующих веществ определяются не изменением величины полной энергии системы при переходе ее из начального состояния в конечное (как было принято, согласно принципу наибольшей работы Бертло), но только изменением тон ее части, которая способна непосредственно превращаться в механическую работу или иную форму энергии, кроме тепловой; эту часть полной энергии Гельмгольц назвал свободной в отличие от несвободной или связанной, которая может проявиться только в форме теплоты».
Когда химическая реакция происходит при постоянной температуре, свободная энергия изменяется всегда только в одном направлении, она убывает. Направление реакций определяется выделением наибольшего количества свободной энергии. Гельмгольц характеризовал свободную энергию как способность химических процессов производить механическую работу, а связанную энергию — как скрытую теплоту. Применение понятия свободной энергии дало возможность определять условия превращения химической энергии в работу.
Вместе с установлением закона сохранения энергии выведенное Гельмгольцем соотношение для свободной энергии показало, что термохимическая теория сродства должна уступить место термодинамической: «Если считать, что закон Клаузиуса имеет неограниченную применимость,— писал Гельмгольц,— то тогда именно значения свободной энергии, а не значения энергии, появляющейся путем выделения тепла, будут определять, в каком направлении может действовать химическое сродство».
Вопрос о соотношении между электродвижущей силой и химическим сродством нашел дальнейшее развитие в трудах Вант-Гоффа.
В письме к С. Аррениусу от 4.VIII 1885 г. Вант-Гофф писал: «Электродвижущая сила, которая может вызвать превращение, если оно осуществляется в гальваническом элементе, измеряет работу, которую может выполнить сродство, стремящееся произвести превращение».
В соответствии с идеями Гельмгольца о свободной энергии Вант-Гофф в своих теоретических положениях исходил из того, что работа сродства и тепловой эффект реакции не идентичны. Он установил следующую математическую зависимость между работой сродства, тепловым эффектом и абсолютной температурой химического процесса:
A = q(P-T)/P.
«Работа (А), выраженная в калориях, которую может произвести сродство при химическом превращении, равна теплоте (q), выделяющейся при этом превращении, деленной на абсолютную температуру точки перехода (Р) и умноженной на разность этой последней и рассматриваемой температуры». Отсюда следует, что только при температуре абсолютного нуля работа, которую сродство производит при химическом превращении, становится равной теплоте, выделяющейся при этом превращении.
Таким образом, теплота химических реакций не является мерой сродства веществ, принимающих участие в этих реакциях, ибо тепло реакции есть сумма различных тепловых изменений, причем некоторые из них носят скорее физический, чем химический характер; я если бы были произведены определения количеств чисто химической энергии, превращающейся в тепловую энергию при химических реакциях, эти определения не дали бы меры сродства реагирующих веществ, ибо сродство — это лишь один из факторов химической энергии, подобно тому, как количество тепла является одним из факторов тепловой энергии.
Вант-Гофф мог прийти к удачному решению проблемы химического сродства благодаря тому, что он нашел правильную меру для выражения химического сродства в единицах других видов движения: механического, электрического и т. д.
С этой точки зрения установление меры химического сродства является дальнейшим развитием основного закона превращения энергии. Если ранее была установлена мера для взаимного перехода механического, теплового и электрического видов движения, то химическая энергия оставалась в стороне. Вант-Гофф установил взаимную связь химического сродства как с механической, так и с электрической энергиями.
В отличие от своих предшественников, Вант-Гофф определяет химическое сродство не в единицах силы, т. е. в килограммах, атмосферах и т. д., а в единицах работы, т. е. килограммометрах, калориях и т. п. Таким образом, не сила, а величина работы избирается мерой сродства; благодаря этому становится возможным сравнение сродства с механическими, электрическими и термическими величинами.
Вант-Гофф дал точный, свободный от всяких натяжек, метод измерения сродства химических процессов через максимальную работу, какую они могут совершить. Эта мысль, как было сказано выше, содержалась уже в работах Гельмгольца. Однако надо отметить, что химики того времени мало что смогли извлечь из способа изложения Гельмгольца и приведенных им примеров. Только благодаря исследованиям Вант-Гоффа, особенно оригинальным по своей простоте, эта основная мысль получила важное значение для физической химии.
Особого внимания заслуживало положение Вант-Гоффа, по которому электродвижущая сила является мерой химического сродства. При этом Вант-Гофф указал на неправильность тех воззрений, которые принимали существование эквивалентности между теплотой реакции и электродвижущей силой. Эти представления получили дальнейшее плодотворное развитие в трудах В. Нернста, много сделавшего для выяснения вопроса о месте возникновения электродвижущих сил и о причинах и механизме их возникновения. В 1888 г. Нернст опубликовал статью, в которой, развив теорию (диффузии, установил связь между подвижностью ионов и коэффициентам диффузии электролита.
Понимая важность изучения явления диффузии для обоснования теории электролитической диссоциации и для объяснения механизма осмотического давления, Нернст в 1888 г. приступил к разработке теории диффузии электролитов. На основе теории Вант-Гоффа, согласно которой диффузия происходит под действием различного осмотического давления ионов в растворах разной концентрации, Нернст вычислил коэффициент диффузии в различных ионов. Зная величины осмотического давления и трения, испытываемого ионами при движении в растворе, Нернст определял значение D для различных солей при большом разбавлении по формуле:
D = [2UV/(U+V)]∙RT
где U и V — абсолютные скорости катионов и анионов;
R — газовая постоянная;
Т — абсолютная температура раствора.
Невозможность разделения диффузией ионов в растворе, движущихся с разными скоростями, Нернст объяснил следующим образом. Если ионы одного знака в силу большей скорости проникли из раствора электролита в среду растворителя, то образуется слой, заряженный противоположно раствору, так как в растворе остался избыток ионов другого знака. В результате возникает электрическое притяжение, которое и задерживает дальнейшее движение быстрых ионов в растворитель до тех пор, пока медленные ионы не проникнут в тот же слой. Таким образом, разность скорости движения ионов препятствует диффузионному разделению их.
Диффузия электролита (и неэлектролита) обусловливается, прежде всего, осмотическим давлением, а затем силами электростатической) характера, возникающими вследствие различий скорости ионов. Под воздействием обоих факторов ионы диффундируют одновременно и, следовательно, диффузией их разделить нельзя.
Теория Нернста впервые позволила количественно связать такие величины, как скорость диффузии растворенных веществ, электропроводность и осмотическое давление. «Одно из наиболее важных применений теории электролитической диссоциации,— писал Аррениус,— сделано Нернстом, а именно, вычисление скорости диффузии…».
В 1890 г. М. Планк термодинамически обосновал теорию диффузии, развитую Нернстом93. «Я обратил внимание,— писал Планк,— на весьма плодотворную теорию, предложенную В. Нернстом в Геттингене, согласно которой электрические напряжения, появляющиеся в растворах электролитов с неоднородной концентрацией, образуются от взаимодействия электрической силы, вызываемой зарядами, с осмотическим давлением. На основании этой теории мне удалось вычислить разность потенциалов двух электролитических растворов. Моя формула, как мне письменно сообщил Нернст, была подтверждена его измерениями».
Теория диффузии Нернста явилась основой его теории электродвижущих сил, развитой в следующем, 1889 г.
31 января 1889 г. Аррениус писал Тамману: «…у Нернста процветают его научные успехи, причем оп с поистине чудесной храбростью разрешает одну загадку за другой».
В 1889 г. Нернст показал термодинамически, что разность потенциалов между раствором и металлом по формуле (RT/nF)lg(P/p) определяется концентрацией ионов металла в растворе.
В растворах солей ионы металлов находятся под определенным осмотическим давлением, пропорциональным концентрации Р. Таким образом, Р и р — это давления, под действием которых ионы металла стремятся покинуть соответственно металл и раствор. При соприкосновении металла с раствором его соли оба давления действуют противоположно, он отношение величин Р и р определяет, растворяется ли металл в электролите или наоборот — его ионы осаждаются из электролита на металл. Зависимость электродвижущей силы гальванического элемента от концентрации Нернст выразил формулой:
E = RTlg(c1/c2).
Однако эта формула оказалась пригодной только для идеальных разбавленных растворов. Для реальных растворов применима формула Гиббса, совпадающая с формулой Нернста только при больших разбавлениях.
Нернcт считал, что если упругость растворения металла превышает осмотическое давление, то ионы металла переходят в раствор, и последний получает положительный заряд, а на металле остается отрицательный; при постоянной убыли ионов в растворе образуется ток. Эта правильная в сущности концепция не учитывала, как было обнаружено впоследствии, ошибочности представления об электродных потенциалах металлов.
Теория Нернста, как показали последующие работы электрохимиков, основывалась на ошибочном отождествлении электродного процесса и обратимых переходов ионов из металла в раствор и на ошибочном отождествлении электродного потенциала и разности электрических потенциалов на границе раздела фаз: металл−раствор.
В последующих работах (Фольмера, Фрумкина и др.) была подмечена существенная ошибка в теории Нернста, заключающаяся в том, что электрод, не имеющий заряда, обладает определенным потенциалом. Согласно же теории Нернста такой электрод имеет потенциал, равный нулю.
В работах Нернста, Оствальда и других ученых вопрос о природе разностей потенциалов, о механизме их возникновения, о факторах, определяющих поведение металла в растворе, оставался нерешенным.
Кая показали последующие работы, упругость растворения металла электрода не является постоянной величиной и зависит от природы растворителя и природы двойного слоя.
В 1891 г. Нернст, совместно с Тамманом, опубликовал работу «О наибольшей (максимальной) упругости, с которой водород вытесняется металлами из растворов». Авторы нашли, что металлы по уменьшению «минимальной упругости» располагаются в ряд, аналогичный ряду по уменьшению электродвижущей силы.
В работе «О химическом равновесии, электродвижущей силе и электролитическом осаждении смесей металлов» Нернст показал, что электролитическое осаждение металлов зависит от концентрации их ионов. Изучение электродвижущих сил дало ценный метод для определения концентрации одного вида ионов в присутствии других ионов или молекул посредством электрических измерений их потенциалов.
24 мая 1897 г. Нернст на заседании Немецкого химического общества сделал доклад «Электролитическое разложение водных растворов», в котором обобщил свои работы, а также работы других ученых, в особенности М. Леблана и Г. Яна по теории электродвижущих сил.
Нернст писал, что «электродвижущие силы являются мерою явлений, происходящих внутри растворов; таким же образом упругость растворения ионов «обусловливает процессы», происходящие на электродах, как-то: гальваническое происхождение тока, электролитическое осаждение и термические явления. В заключение,— пишет далее Нернст,— я не хотел бы оставить без обсуждения один пробел, который обращает на себя наше внимание в области электролиза. Мы заставляем ионы отлагаться на электродах, но каким образом они отдают свой заряд?.. Есть ли у нас средство… определить количество свободных электрических зарядов?.. Какой бы ответ ни был дан на этот вопрос, придется или нет допускать заряды средств, свободные от материи, подобно свободным ионам, все равно, природа указывает нам здесь великие цели. Я хотел бы (закончить указавшем, что разработка этих задач приводит нас к физической задаче о металлической проводимости, физико-химическому вопросу о природе электрических зарядов сродства и к химической загадке о большой разнице между металлами и металлоидами».
Теория электродвижущих сил Нернста впервые дала возможность довольно просто вычислить электродвижущую силу гальванических элементов и величину электродных потенциалов и наглядно представить механизм образования тока в гальваническом элементе. Из его теории вытекало, что ряд напряжений определяется не только электролитической упругостью растворения, но и концентрацией раствора. Незнанием этого факта и объяснялись противоречия в многочисленных рядах напряжений, предлагавшихся в течение почти 100 лет со времени работ Вольта.
Теоия Нернста явилась своеобразным синтезом химической и контактной теории гальванических элементов.
Значение теории Нернста заключается не только в том, что она дает связь между электродвижущей силой и составом раствора, а еще и в том, что процесс, протекающий в гальваническом элементе, представляется как две независимые электродные реакции, из которых одна всегда связана с приобретением электрона (восстановление), а другая — с его отдачей (окисление).
Современные электрохимические исследования (А. Н. Фрумкин и др.) показали, что в отсутствие двойных ионных слоев, т. е. в отсутствие зарядов на электродах, вольтова контактная разность потенциалов металлов, служащих электродами, близка к разности работ выхода электрона из соответствующих металлов. В реальных условиях, когда электрод находится в электролите, к контактной разности потенциалов прибавляется разность потенциалов, создаваемая двойными ионными слоями.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.
khimie.ru
Электродвижущая сила ЭДС - Справочник химика 21
На поверхности контакта двух проводящих фаз электрохимической системы (различной химической природы, агрегатного состояния и типа проводимости) наблюдаются скачки потенциала. Сумма скачков потенциала на всех границах раздела фаз равновесной электрохимической системы называется электродвижущей силой (ЭДС) элемента или цепи. Она может быть непосредственно измерена как разность потенциалов фаз, находящихся на концах цепи. Для электрохимических систем характерны три основные типа скачков потенциала скачки потенциала металл — раствор, раствор — раствор и металл — металл. [c.280] Основная характеристика гальванического элемента — электродвижущая сила (эдс) равна разности его электродных потенциалов [c.135]Стандартные потенциалы металлов, расположенные в порядке возрастания их алгебраической величины, образуют так называемый ряд напряжений металлов, или ряд стандартных электродных потенциалов. Для определения электродвижущей силы (ЭДС) гальванического элемента следует из стандартного потенциала с большей алгебраической величиной вычесть стандартный потенциал с меньшей алгебраической величиной. Так, ЭДС медно-цинкового гальванического элемента составляет (см. приложение V) [c.126]
Электродвижущая сила (ЭДС) химического источника тока равна разности электродных потенциалов катода, и анода. Существует большое количество гальванических элементов, важнейшие из которых приведены в табл. 96. [c.155]
ЭНЕРГЕТИКА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ И СОЗДАНИЕ ЭЛЕКТРОДВИЖУЩЕЙ СИЛЫ (ЭДС) [c.227]
Таким образом, разность потенциалов на концах равновесной электрохимической цепи однозначно связана с изменением свободной энергии Гиббса в ходе соответствующей химической реакции. Величина Е, т. е. разность потенциалов на концах равновесной электрохимической цепи, называется ее электродвижущей, силой (ЭДС). Если же на отдельных фазовых границах (хотя бы на одной) равновесие не устанавливается, то разность потенциалов на концах цепи не равна ЭДС и уравнение (VI.19) оказывается неприменимым. Величина пРЕ характеризует максимальную электрическую работу, которую можно получить при помощи электрохимической цепи. Уравнение (VI.19) служит основой для расчета АО различных химических реакций. Часто электрохимический метод определения изобарного потенциала имеет существенные преимущества перед термохимическим методом. [c.118]
Основной характеристикой электрохимической системы является электродвижущая сила (ЭДС) — разность потенциалов между двумя металлическими электродами, измеряемая при протекании обратимых процессов в системе. [c.314]
Разность потенциалов электродов гальванического элемента называется его электродвижущей силой ЭДС( ). При расчете значения Е принято из значения потенциала фз электрода, записанного в обозначении состава гальванического элемента справа, вычесть значение потенциала ф1 электрода, записанного в обозначении состава слева, в начале записи Е = = Ф2—Ф1- [c.188]
Разность электродных потенциалов — это электродвижущая сила (ЭДС) гальванического элемента. Так как водородный электрод служит электродом сравнения, для которого о=ОВ, то измеряемая ЭДС рассматриваемого элемента — это потенциал медного электрода по отношению к водородному. Ниже значения электродных потенциалов будем обозначать символом Е (иногда пользуются символом ф), как и ЭДС электродных реакций. Таким образом, потенциалы металлов можно сравнивать по ЭДС гальванической цепи с водородным электродом. [c.326]
Потенциометрические методы основаны на измерении потенциалов различных электродов или, точнее, электродвижущих сил (ЭДС) различных цепей, поскольку экспериментально измеряется именно ЭДС, являющаяся разностью потенциалов. [c.240]
Электрохимическая цепь находится в равновесии, если на всех межфазных границах достигнуто равновесие и исключен диффузионный потенциал. В этом случае разность потенциалов между концами проводников первого рода, присоединенных к электродам, называется электродвижущей силой (ЭДС) гальванического элемента. [c.218]
Если в цепи 1 > Уз, то ток всегда течет от к Уд для того чтобы цепь была замкнутой, ток внутри электрической батареи — источника тока — должен течь в обратную сторону, т. е. от отрицательного электрода к положительному. Это осуществляется за счет так называемой электродвижущей силы (ЭДС), уравновешивающей разность потенциалов во внешней цепи и падение потенциала на внутреннем сопротивлении Ло батареи [c.185]
Разность электродных потенциалов Е — это электродвижущая сила (эдс) гальванического элемента. Так как водородный электрод служит электродом сравнения, для которого °н /н2 = = 0, то измеряемая эдс рассматриваемого элемента — это потенциал медного электрода по отношению к водородному. [c.261]
Определение энергии Гиббса процесса. Подобно энтальпии ЛЯ и энтропии 5 величину ЬС физико-химических процессов можно определить экспериментально. Один из широко применяемых методов определения ДС окислительно-восстановительных реакций заключается в проведении их в гальваническом элементе и измерении его электродвижущей силы (эдс). Рассмотрим этот метод определения ДС7 на примере реакции вытеснения цинком меди из раствора сульфата меди [c.203]
Электродвижущая сила (ЭДС) этой цепи при протекании какой-либо химической реакции в стандартных условиях (температура 25°С, давление 1 атм, концентрации всех веществ в ячейках- [c.163]
По табл. 93 находим, что для С1 - -С1 о= 1,359 В, а для SOi S05 o = = 0,17 В. Разность стандартных потенциалов ионов, участвующих в реакции, называется электродвижущей силой (ЭДС) реакции. Чем больше ЭДС, тем энергичнее протекает реакция. Для реакции окисления сульфит-иона ЭДС равна [c.150]
Вертикальные черточки здесь обозначают поверхности раздела фаз. В случае положительной электродвижущей силы (ЭДС) слева располагают отрицательный электрод, справа — положительный. Для того чтобы учесть соединение меди и цинка (непосредственное или с помощью промежуточных металлов), про- [c.232]
Соединение электродов металлическим проводником приводит к возникновению электрического тока. Следовательно, в этой системе возникает электродвижущая сила — ЭДС элемента. 3)та ЭДС способна совершать работу по переносу электрона по металлическому проводнику (а следовательно, и любые виды работы, в которые можно преобразовать энергию электрического тока) за счет химической реакции окисления — восстановления. Таким образом, гальванический элемент представляет собой устройство, в котором уменьшение термодинамического потенциала в результате окислительно-восстановительной реакции преобразуется в энергию электрического тока. [c.294]
Электродвижущая сила элемента. Электрическая работа равна произведению разности потенциалов на количество электричества. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода элемента. Если на электродах превращается один моль эквивалентов вещества, то по закону Фарадея через систему протекает один фарадей электричества, при превращении одного моля вещества — п фарадеев электричества, равное числу молей эквивалентов в одном моле вещества. Таким образом, максимальная электрическая работа гальванического элемента при превращении одного моля вещества равна [c.194]
Устройство, схематически изображенное на рис. 6.1, называют гальваническим элементом, а каждый из сосудов, содержащий раствор и платиновую пластину, — электродом или полуэлемеитом, хотя собственно электродом часто называют платиновую или другую пластину, служащую проводником электронов. При проведении реакции в гальваническом элементе химическая энергия превращается в электрическую. Электродвижущая сила ЭДС гальванического элемента может быть измерена с помощью потенциометра. Она непосредственно характеризует способность электронов данного восстановителя переходить к данному окислителю. [c.105]
Что называется электродвижущей силой (ЭДС) гальванического элемента [c.74]
Если теперь пластинку любого металла, погруженную в раствор его соли, содержащий 1 моль ионов металла в 1000 г воды, соединить с водородным электродом, как показано на рис. 5.7, то получится гальванический элемент, электродвижущую силу (ЭДС) которого легко измерить. Эта ЭДС, измеренная при 25 С, и называется стандартным электродным потенциалом данного металла (обычно обозначается ). [c.158]
Теплоемкость Коэффициент диффузии Плотность вещества Электродвижущая сила (ЭДС) Напряжение разложения Тепловое напряжение разложения Электрон [c.4]
Напряжением разложения разл в ваннах и электродвижущей силой (ЭДС) в ХИТ называют разность равновесных потенциалов системы [c.11]
Величина электродвижущей силы (ЭДС) различных термопар при температуре холодного спая С° [c.473]
Электродвижущая сила (ЭДС) этой реакции имеет положительное значение [c.148]
Электродвижущая сила (эдс) химического источника тока представляет собой разность потенциалов положительного и отрицательного электродов [c.18]
По определению условный (относительный) окислительно-восстановительный потенциал редокс-пары (эмектродпый потенциал редокс-пары) — это электродвижущая сила (ЭДС) гальванической цепи, составленной из данного окислительно-восстановительного электрода и стандартного водородного электрода При этом в схеме записи гальва- [c.149]
Элeктpoxимичe кaя цепь является равновесной при условии, что электрохимическое равновесие имеет место на каждой из ее фазовых границ. Разность потенциалов на концах такой цепи называется электродвижущей силой (ЭДС) цепи. Рассмотрим цепь а (рис. 2.1) и предположим, что электрод М1 — цинковый, электрод М2 — хлорсеребряный, а раствором электролита служит 2пС12- В этом случае, как следует из рисунка, [c.80]
Назовем потенциалом реакции Е, или электродвижущей силой (ЭДС) реакции величину, равную ра шости окислительно-восстановительных потенциалов редокс-пар (т. е. их электродных потенциалов). В рассматриваемом случае [c.154]
При стандартных условиях, т. е. при 298,15 К,/)Н2 = 1,013 -10 Па и Смп04- = Смпг+—Сн+ =1 моль/л, электродвижущая сила (эдс) этого элемента равна 1,51 В, Значит, стандартный электродный потенциал Мп04 /Мп составляет 1,51 В. Аналогично определяют стандартный электродный потенциал системы Ы0з / Ы02 он равен -(-0,94 В. [c.330]
Если замкнуть внешнюю цепь на сопротивление, то будет происходить лишь выделение бесполезной теплоты, затрачиваемой на нагревание сопротивления, при этом полезная работа Л не производится (см. (2.19)]. Соединив же гальванический элемент с электромотором, робратная электродвижущая сила (эдс) практически уравновесит эдс элемента, получим иной результат тепловая потеря станет минимальной, а раСюта, нао рот, достигнет предельного значения К тому же [c.204]
НлО+ -1-е-=Н-1-Н20 Если пластинку металла, погруженную в раствор его соли с активностью ионов, равной единице, соединить со стандартным водородным электродом, как показано на рис. 62, то получится гальванический элемент (электрохимическая цепь), электродвижущую силу (ЭДС) которого легко измерить. ЭДС, измеренная при 25 °С, и будет величиной стандартного электродного потенциала металла. Стандартный электродньсй потенциал обычно обозначают Е°. [c.230]
Если на одном и том же электроде могут осуществляться две реакции и более, то предпочтительней оказывается та, для протекания которой требуется наименьщая электродвижущая сила (ЭДС). [c.166]
Важнейшей количественной характеристикой электрохимического элемента является электродвижущая сила (ЭДС, обозначаемая в дальнейшем буквой ), которая равна равновесной разности потенциалов между двумя полуэлемен-тами. [c.238]
Внутренние потенциалы отдельных фаз ср е и ф , к сожалению, экспериментально измерить нельзя. Любая попытка подключить раствор с помощью провода к измерительному прибору вызывает появление новой поверхности соприкосновения фаз поверхность соприкосновения провода с раствором, на которой возникает свойственное ей редоксиравновесие. Например, если провод сделан из меди, возникает равновесие Си " + 2е Си. Следовательно, при попытке подключить раствор к измерительному прибору возникает новый электрод со своей разностью потенциалов фаз. Из обоих электродов образуется гальванический элемент, электродвижущая сила (ЭДС) которого алгебраически складывается из разностей потенциалов отдельных электродов. ЭДС такого гальванического элемента можно измерить. [c.89]
Как осуществляется взаимодер]ствие двух окисли-Тельно-Босстаиовительных систем при работе гальванического элемента н что называют его электродвижущей силой (ЭДС) [c.258]
chem21.info
Видеоматериалы
Опыт пилотных регионов, где соцнормы на электроэнергию уже введены, показывает: граждане платить стали меньше
Подробнее...С начала года из ветхого и аварийного жилья в республике были переселены десятки семей
Подробнее...Более 10-ти миллионов рублей направлено на капитальный ремонт многоквартирных домов в Лескенском районе
Подробнее...Актуальные темы
ОТЧЕТ о деятельности министерства энергетики, ЖКХ и тарифной политики Кабардино-Балкарской Республики в сфере государственного регулирования и контроля цен и тарифов в 2012 году и об основных задачах на 2013 год
Подробнее...Предложения организаций, осуществляющих регулируемую деятельность о размере подлежащих государственному регулированию цен (тарифов) на 2013 год
Подробнее...
КОНТАКТЫ
360051, КБР, г. Нальчик
ул. Горького, 4
тел: 8 (8662) 40-93-82
факс: 8 (8662) 47-31-81
e-mail:
Этот адрес электронной почты защищен от спам-ботов. У вас должен быть включен JavaScript для просмотра.