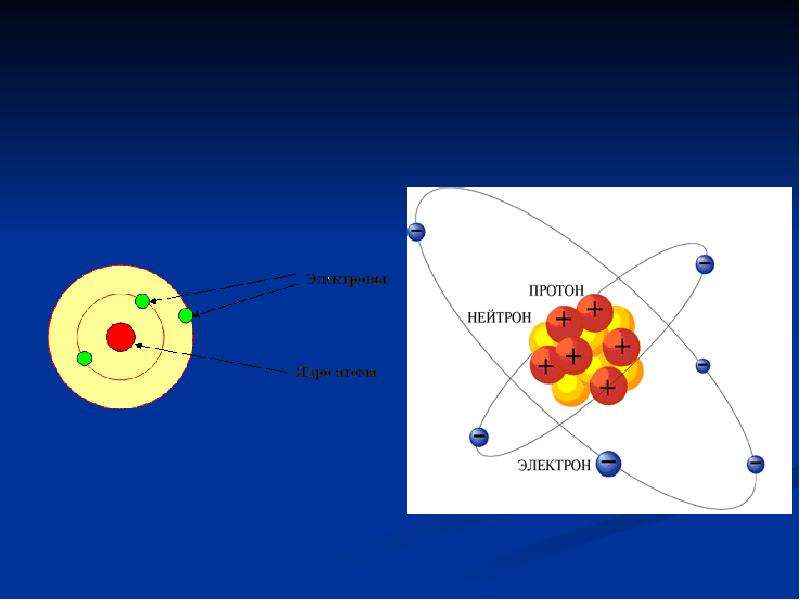
Решение задач по химии на строение атома и периодический закон
Важно знать! Как научиться решать задачи по химии.
Задача 3-1. Определите состав атома фтора
Решение.
Атом состоит из ядра и электронов. Судя по обозначению
массовое число ядра , число протонов в ядре , число нейтронов . Атом электронейтрален, поэтому число отрицательно заряженных электронов равно числу положительно заряженных протонов: .
Ответ: 9 протонов, 10 нейтронов, 9 электронов.
Задача 3-2. Определите состав атомов и . Укажите сходство и отличие этих атомов.
Решение.
Состав атомов определим так же, как и в предыдущей задаче. Для сравнения атомов составим таблицу:
| Атом | ||
|---|---|---|
| Массовое число A | 35 | 37 |
| Число протонов Z | 17 | 17 |
| Число нейтронов N | 18 | 20 |
| Заряд атома | 0 | 0 |
| Заряд ядра | +17 | +17 |
| Число электронов | 17 | 17 |
Из таблицы видно, что атомы двух изотопов хлора отличаются только массовым числом и числом нейтронов.
Задача 3-7. Напишите электронную конфигурацию иона магния. Назовите один отрицательный ион, который имеет такую же конфигурацию.
Решение.
Электронная конфигурация атома магния: . Ион магния образуется при удалении двух валентных электронов с внешнего подуровня и имеет электронную конфигурацию: . В этой конфигурации полностью заселены два энергетических уровня — первый и второй.
Такую же электронную конфигурацию могут иметь неметаллы 2-го периода, если к их атомам добавить электроны до полного заселения второго энергетического уровня. Атому фтора () до завершения второго уровня не хватает одного электрона. Если атом фтора примет этот электрон, он превратится в отрицательный ион , который имеет электронную конфигурацию .
Ответ: . Ион
Задача 3-8. Определите значения квантовых чисел, характеризующих валентный электрон в атоме натрия.
Решение.
Натрий — первый элемент 3-го периода — имеет электронную конфигурацию с одним валентным электроном на орбитали .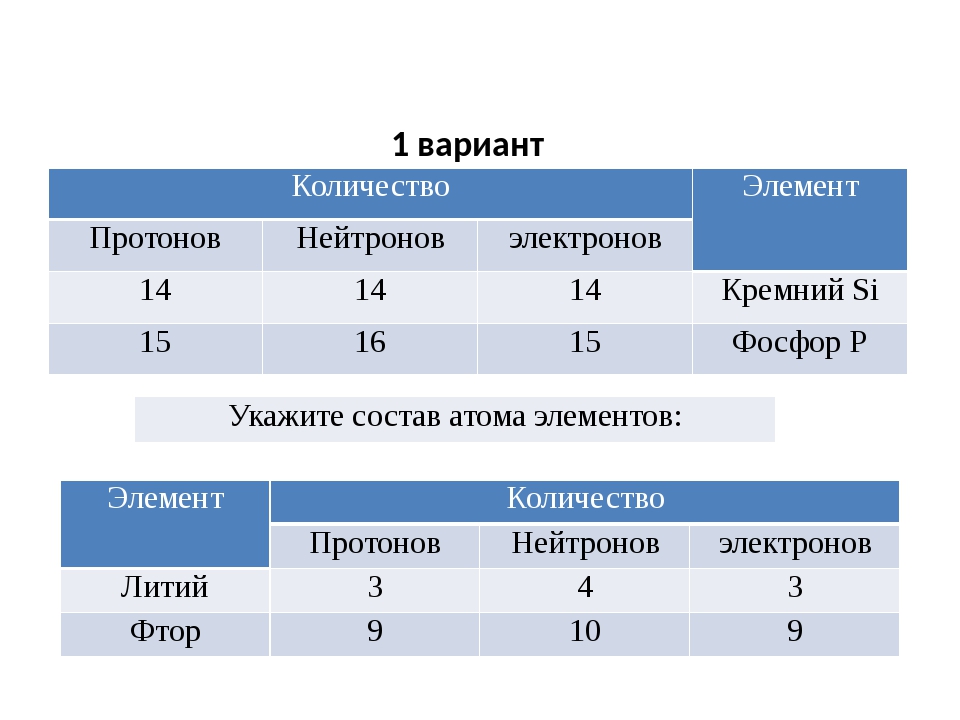 Эта орбиталь находится на третьем энергетическом уровне, поэтому главное квантовое число . Для любой s-орбитали побочное квантовое число , магнитное квантовое число . Спин электрона , проекция спина может принимать любое из двух значений:
Эта орбиталь находится на третьем энергетическом уровне, поэтому главное квантовое число . Для любой s-орбитали побочное квантовое число , магнитное квантовое число . Спин электрона , проекция спина может принимать любое из двух значений:
Ответ:
[Сборник задач и упражнений по химии: Школьный курс / В.В. Еремин, Н.Е. Кузьменко]
Поделитесь с друзьями:
Краткосрочный план урока в 11 классе «Современные представления о строении атома»
План урока
Современные представления о строении атома
Ссылка:
Учебная программа, КТП
Общие цели:
Расширить и углубить представления учащихся о строении атома с точки зрения современных теорий
Результаты обучения:
Умеют описывать строение атомов химических элементов
Ключевые идеи:
Вовлечение учащихся в процесс обучения через развитие речи, памяти и мышления на основе подходов стратегий 7 модулей
Ресурсы:
Листы формата А3, маркеры, презентация, учебник, карточки с заданиями, лестница успеха
Содержание урока
Деятельность учителя
Деятельность учеников
Организационный момент
(1 мин)
Режим работы, общие требования к тетрадям, правила поведения
Распределение в группы
Психологический настрой «Круг пожеланий» (НП)
Высказывают пожелания, передавая друг другу стимул-предмет
Мотивация
(3 мин)
Задание 1
Групповая дискуссия (КМ, НП), Взаимопомощь (ОдО)
Слайд №1: фотография атома водорода. Сделанного с помощью фотоионизационного микроскопа
Сделанного с помощью фотоионизационного микроскопа
Учащиеся определяют тему и цель урока
Ученики посмотрев на слайд, высказывают свои предположения, обсуждают с другими группами, называют тему урока
Запись в тетради числа и темы урока
Определение целей и задач урока
(1 мин)
Задание 2
(КМ, УиЛ, ТиО, ВО, НП, ОдО)
Таблица «Три З»
Обсуждение в группе, заполнение таблицы, уточнение темы и целей
Реализация
(20 мин)
Кейс-стади. (КМ, УиЛ, ТиО, ВО, НП, ИКТ, ОдО и ОО)
1. Прочитайте § 1.2, 1.3. Заполните таблицу «История атома»:
2. Дайте определения понятиям: протон, нейтрон, электрон, ядерные силы, изотопы, элемент, электронное облако, орбиталь, энергетический уровень, главное квантовое число. Запишите определения своими словами в тетрадь.
3. Составьте в группе постер «Атом. Современные представления»
Современные представления»
Распределяют обязанности в паре и группе, внимательно читают материал учебника, делают записи
Защищают свой постер
Взаимооценивание (команды оценивают работу других групп)
(3 мин)
Физминутка «Танцевальная зарядка»
Выполняют упражнения (презентация)
Подведение итогов
(7 мин)
Задание 4 Заполнение таблицы «Три З» (ОО)
Самооценка
Рефлексия
(3 мин)
Возвращение к таблице «Три З»
Все ли поставленные цели достигнуты?
Удовлетворены ли вы своей работой на уроке?
«Лестница»
Читают цели и поясняют их достижение.
Оправдалась ли ваше желание по работе на уроке
Домашнее задание
(2 мин)
Параграфы:1.2, 1.3, письменно с 12, вопросы 5, 6, 7; с 14, вопросы 5, 6, 8
Готовиться к самостоятельной работе
учёный | открытие |
Дж. | 1897 г — электрон |
А. Беккерель | радиоактивность |
Супруги Кюри, Э. Резерфорд | ά-β-γ-лучи |
Э. Резерфорд | Планетарная модель атома 1911 г |
Г. Мозли | Заряд ядра = № элемента |
Э. Резерфорд | 1920 г — протоны |
Дж. Чедвик | 1932 г — нейтроны |
Д.Д. Иваненко Е.Н.Гапон | 1932 г – протонно-нейтронная теория Z+N=A |
Нильс Бор | 1913 г – квантовая теория строения атома |
Л. Де Бройль, В. Гейзенберг, Э. Шредингер | Электрон – частица и волна (корпускулярно-волновая двойственность) |
Самое грандиозное шоу на Земле: доказательства эволюции читать онлайн Ричард Докинз (Страница 18)
Радиоактивные “часы”
Теперь перейдем к радиометрическому датированию. Нам есть из чего выбирать: радиоактивные “часы” отмеряют время от веков до миллиардов лет. У каждых есть погрешность, обычно не превышающая 1 %. Таким образом, если вы измеряете возраст горной породы в миллиардах лет, то должны принимать в расчет погрешность в десятки миллионов лет. Если определяете возраст породы, которой сотни миллионов лет, погрешность не будет превышать миллиона лет. Если породе десятки миллионов лет, делайте поправку на сотни тысяч лет.
Нам есть из чего выбирать: радиоактивные “часы” отмеряют время от веков до миллиардов лет. У каждых есть погрешность, обычно не превышающая 1 %. Таким образом, если вы измеряете возраст горной породы в миллиардах лет, то должны принимать в расчет погрешность в десятки миллионов лет. Если определяете возраст породы, которой сотни миллионов лет, погрешность не будет превышать миллиона лет. Если породе десятки миллионов лет, делайте поправку на сотни тысяч лет.
Чтобы понять, как работают радиоактивные “часы”, необходимо прежде узнать, что такое радиоактивный изотоп. Материя состоит из химических элементов, как правило, химически связанных с другими элементами. Всего существует около ста элементов (чуть больше, если прибавить элементы, которые существуют только в лабораторных условиях, и чуть меньше, если сосчитать только элементы, встречающиеся в природе): углерод, железо, азот, алюминий, магний, фтор, аргон, хлор, натрий, уран, свинец, кислород, калий, олово и так далее. Атомная теория строения вещества, с которой, думаю, согласны даже креационисты, утверждает, что каждому элементу соответствует собственный атом, являющийся самой маленькой частицей, на которую возможно разделить элемент без утраты им своих свойств. Как выглядит атом свинца, меди или углерода? Безусловно, не как медь, свинец или уголь. Он вообще никак не выглядит, поскольку слишком мал для того, чтобы броситься вам в глаза, каким бы мощным микроскопом вы ни пользовались. Поэтому мы прибегаем к аналогиям или моделям. Самая известная была предложена великим датским физиком Нильсом Бором. Модель Бора, сегодня уже устаревшая, похожа на Солнечную систему. Вместо Солнца — ядро, вокруг которого обращаются электроны, играющие роль планет. Как и в Солнечной системе, практически вся масса атома содержится в ядре (“Солнце”), а практически весь объем занят пространством между электронами (“планетами”). Каждый из электронов в сравнении с размером ядра пренебрежимо мал, а расстояние от него до ядра намного больше размеров самого ядра. Известная аналогия — ядро атома, как муха в центре футбольного стадиона. Тогда ядро соседнего атома будет мухой в центре соседнего стадиона. Электроны кружат по орбитам вокруг мух, они меньше самых мелких мошек, слишком маленькие для того, чтобы увидеть их в одном масштабе с мухами.
Как выглядит атом свинца, меди или углерода? Безусловно, не как медь, свинец или уголь. Он вообще никак не выглядит, поскольку слишком мал для того, чтобы броситься вам в глаза, каким бы мощным микроскопом вы ни пользовались. Поэтому мы прибегаем к аналогиям или моделям. Самая известная была предложена великим датским физиком Нильсом Бором. Модель Бора, сегодня уже устаревшая, похожа на Солнечную систему. Вместо Солнца — ядро, вокруг которого обращаются электроны, играющие роль планет. Как и в Солнечной системе, практически вся масса атома содержится в ядре (“Солнце”), а практически весь объем занят пространством между электронами (“планетами”). Каждый из электронов в сравнении с размером ядра пренебрежимо мал, а расстояние от него до ядра намного больше размеров самого ядра. Известная аналогия — ядро атома, как муха в центре футбольного стадиона. Тогда ядро соседнего атома будет мухой в центре соседнего стадиона. Электроны кружат по орбитам вокруг мух, они меньше самых мелких мошек, слишком маленькие для того, чтобы увидеть их в одном масштабе с мухами. Когда мы берем в руки кусок металла или камня, мы на самом деле смотрим на предмет, состоящий в основном из пустоты. Мы ощущаем его как плотное и непрозрачное тело потому, что наши органы чувств и мозг находят удобным воспринимать этот объект как твердый и непрозрачный. Наш мозг находит это удобным потому, что мы не можем пройти сквозь камень. “Твердый” — это характеристика, которую мы присваиваем веществам и материалам, через которые не можем пройти или в которые не можем провалиться из-за электромагнитных взаимодействий между их атомами. “Непрозрачный” — воспринимаемая нами картина света, отражающегося от поверхности объекта и не проходящего сквозь него.
Когда мы берем в руки кусок металла или камня, мы на самом деле смотрим на предмет, состоящий в основном из пустоты. Мы ощущаем его как плотное и непрозрачное тело потому, что наши органы чувств и мозг находят удобным воспринимать этот объект как твердый и непрозрачный. Наш мозг находит это удобным потому, что мы не можем пройти сквозь камень. “Твердый” — это характеристика, которую мы присваиваем веществам и материалам, через которые не можем пройти или в которые не можем провалиться из-за электромагнитных взаимодействий между их атомами. “Непрозрачный” — воспринимаемая нами картина света, отражающегося от поверхности объекта и не проходящего сквозь него.
Согласно модели Бора, в состав атома входят три вида частиц. С электронами мы уже знакомы. Две другие частицы, существенно превосходящие по размеру электрон, но по-прежнему настолько малые, что мы не можем увидеть их, называются протон и нейтрон. Они почти одинакового размера. Число протонов в атоме любого химического элемента постоянно и равно числу электронов. Оно называется атомным числом и является уникальным свойством химического элемента. Нет никаких промежутков в последовательности атомных чисел в знаменитой периодической таблице элементов [Легенда, гласящая, что химик Дмитрий Менделеев увидел ее во сне, может быть ошибочной.]. Каждый номер в ряду соответствует одному и только одному химическому элементу. Элемент с атомным числом 1 — водород, 2 — гелий, 3 — литий, 4 — бериллий, 5 — бор, 6 — углерод, 7 — азот, 8 — кислород, и так далее.
Оно называется атомным числом и является уникальным свойством химического элемента. Нет никаких промежутков в последовательности атомных чисел в знаменитой периодической таблице элементов [Легенда, гласящая, что химик Дмитрий Менделеев увидел ее во сне, может быть ошибочной.]. Каждый номер в ряду соответствует одному и только одному химическому элементу. Элемент с атомным числом 1 — водород, 2 — гелий, 3 — литий, 4 — бериллий, 5 — бор, 6 — углерод, 7 — азот, 8 — кислород, и так далее.
Протоны и электроны несут электрические заряды противоположных знаков — мы называем их положительными и отрицательными. Эти заряды становятся важными, когда элементы составляют химические соединения. Основными проводниками взаимодействий являются электроны. Нейтроны в атомах связаны в ядре с протонами. В отличие от протонов, они не имеют заряда и не участвуют в химических реакциях.
Протоны, нейтроны и электроны любого химического элемента ничем не отличаются от таких же частиц, составляющих атомы других элементов. Никаких “золотых” протонов, “медных” электронов и “калиевых” нейтронов не существует. Атом меди делает атомом меди только наличие 29 протонов и электронов. Все, что мы привыкли считать свойствами меди, — вопрос химии. Химия — нескончаемый танец электронов. Все химические реакции — взаимодействие атомов при помощи электронов. Химические связи сравнительно легко образуются и распадаются, поскольку обмениваются или отделяются только электроны. Силы взаимного притяжения, образующие ядро атома, преодолеть существенно сложнее. Вот почему термин деление атома имеет зловещую окраску. Однако оно возможно, и в результате начинаются ядерные реакции — в противоположность химическим. На этом и основана работа радиоактивных “часов”.
Никаких “золотых” протонов, “медных” электронов и “калиевых” нейтронов не существует. Атом меди делает атомом меди только наличие 29 протонов и электронов. Все, что мы привыкли считать свойствами меди, — вопрос химии. Химия — нескончаемый танец электронов. Все химические реакции — взаимодействие атомов при помощи электронов. Химические связи сравнительно легко образуются и распадаются, поскольку обмениваются или отделяются только электроны. Силы взаимного притяжения, образующие ядро атома, преодолеть существенно сложнее. Вот почему термин деление атома имеет зловещую окраску. Однако оно возможно, и в результате начинаются ядерные реакции — в противоположность химическим. На этом и основана работа радиоактивных “часов”.
Масса электрона пренебрежимо мала, поэтому общая масса атома — его массовое число — равна суммарному числу протонов и нейтронов в ядре. Как правило, массовое число чуть более чем вдвое превосходит порядковый номер элемента, поскольку нейтронов обычно чуть больше, чем протонов. В отличие от числа протонов, число нейтронов не определяет, к какому элементу относится атом. Атомы любого элемента могут существовать в различных вариантах, именуемых изотопами, у которых одинаковое число протонов, но разное число нейтронов. У некоторых элементов, например фтора, имеется только один природный изотоп. Фтор — элемент с порядковым номером 9 и массовым числом 19. Отсюда следует, что ядро атома фтора состоит из девяти протонов и десяти нейтронов. Другие элементы, однако, имеют множество изотопов. У свинца пять широко распространенных изотопов. Все они имеют одно и то же число протонов и электронов (82 — атомное число свинца) и массовое число (от 202 до 208). Углерод имеет три природных изотопа. Углерод-12 — самый распространенный, он имеет по шесть протонов и нейтронов. Реже встречается углерод-13. Углерод-14 тоже редок, но его все же достаточно для использования в датировании образцов органического происхождения.
В отличие от числа протонов, число нейтронов не определяет, к какому элементу относится атом. Атомы любого элемента могут существовать в различных вариантах, именуемых изотопами, у которых одинаковое число протонов, но разное число нейтронов. У некоторых элементов, например фтора, имеется только один природный изотоп. Фтор — элемент с порядковым номером 9 и массовым числом 19. Отсюда следует, что ядро атома фтора состоит из девяти протонов и десяти нейтронов. Другие элементы, однако, имеют множество изотопов. У свинца пять широко распространенных изотопов. Все они имеют одно и то же число протонов и электронов (82 — атомное число свинца) и массовое число (от 202 до 208). Углерод имеет три природных изотопа. Углерод-12 — самый распространенный, он имеет по шесть протонов и нейтронов. Реже встречается углерод-13. Углерод-14 тоже редок, но его все же достаточно для использования в датировании образцов органического происхождения.
Одни изотопы стабильны, другие — нет. Свинец-202 нестабилен. Стабильными являются: свинец-204, свинец-206, свинец-207 и свинец-208. Нестабильность означает, что атомы данного изотопа спонтанно распадаются с образованием других атомов. Распадаются они с известной скоростью, но момент начала распада непредсказуем. Именно предсказуемость скорости распада служит основой радиоактивных “часов”. Нестабильные изотопы иначе называют радиоактивными. Существует несколько видов радиоактивного распада, каждый из которых имеет ценность в качестве “часов”. Нам не требуется понимание этих механизмов, но я постараюсь объяснить их, чтобы показать замечательный уровень детализации, которого физики достигли в ходе изучения этого вопроса. Этот уровень детализации придает комический оттенок попыткам креационистов доказать ненадежность радиометрического метода датирования и сохранить Землю вечно молодой, как Питер Пэн.
Стабильными являются: свинец-204, свинец-206, свинец-207 и свинец-208. Нестабильность означает, что атомы данного изотопа спонтанно распадаются с образованием других атомов. Распадаются они с известной скоростью, но момент начала распада непредсказуем. Именно предсказуемость скорости распада служит основой радиоактивных “часов”. Нестабильные изотопы иначе называют радиоактивными. Существует несколько видов радиоактивного распада, каждый из которых имеет ценность в качестве “часов”. Нам не требуется понимание этих механизмов, но я постараюсь объяснить их, чтобы показать замечательный уровень детализации, которого физики достигли в ходе изучения этого вопроса. Этот уровень детализации придает комический оттенок попыткам креационистов доказать ненадежность радиометрического метода датирования и сохранить Землю вечно молодой, как Питер Пэн.
Все механизмы радиоактивности зависят от поведения нейтронов. Первый тип представляет собой превращение нейтрона в протон. Это означает, что массовое число не изменяется (поскольку масса протонов и нейтронов, как мы помним, одинакова), а атомное число увеличивается на единицу. Таким образом, атом превращается в другой элемент, на один дальше в периодической таблице. Например, атом натрия-24 становится атомом магния-24. В другом механизме протон превращается в нейтрон. Массовое число не изменяется, а атомное уменьшается на единицу, и в периодической таблице атом перемещается на клетку назад. Третий механизм, когда свободный нейтрон ударяет в ядро атома, выбивает один протон и занимает его место, приводит к такому же результату. Массовое число не изменяется, атомный номер уменьшается на единицу.
Таким образом, атом превращается в другой элемент, на один дальше в периодической таблице. Например, атом натрия-24 становится атомом магния-24. В другом механизме протон превращается в нейтрон. Массовое число не изменяется, а атомное уменьшается на единицу, и в периодической таблице атом перемещается на клетку назад. Третий механизм, когда свободный нейтрон ударяет в ядро атома, выбивает один протон и занимает его место, приводит к такому же результату. Массовое число не изменяется, атомный номер уменьшается на единицу.
Более сложный тип распада связан с испусканием ядром альфа-частицы, состоящей из двух протонов и двух нейтронов. При альфа-распаде, таким образом, массовое число уменьшается на четыре, а атомное — на два. Атом переходит в химический элемент, находящийся на две позиции позади в периодической таблице. Примером такого распада может служить превращение радиоактивного изотопа уран-238 (92 протона, 146 нейтронов) в торий-234 (90 протонов, 144 нейтрона).
Подходим к сути. Все нестабильные изотопы распадаются с постоянной, хорошо известной скоростью. Более того, скорость распада некоторых изотопов существенно меньше, чем у других. Распад во всех случаях описывается экспонентой. Это значит, что если в начале эксперимента есть 100 г радиоактивного изотопа, то за единицу времени в другой химический элемент будет превращаться не фиксированное количество изотопа (скажем, 10 г), а строго определенная доля оставшегося количества. Здесь следует сказать о так называемом периоде полураспада — времени, за которое распадается половина атомов радиоактивного изотопа. Период полураспада не изменяется в зависимости от того, сколько атомов распалось прежде — это и означает, что процесс идет экспоненциально. Естественно, что при таком последовательном “ополовинивании” мы никогда не узнаем наверняка, что атомов начального элемента не осталось. Тем не менее, мы можем сказать, что спустя некоторое достаточно долгое время — например, десять периодов полураспада — останется так мало атомов исходного элемента, что в практических целях этим количеством можно пренебречь.
Все нестабильные изотопы распадаются с постоянной, хорошо известной скоростью. Более того, скорость распада некоторых изотопов существенно меньше, чем у других. Распад во всех случаях описывается экспонентой. Это значит, что если в начале эксперимента есть 100 г радиоактивного изотопа, то за единицу времени в другой химический элемент будет превращаться не фиксированное количество изотопа (скажем, 10 г), а строго определенная доля оставшегося количества. Здесь следует сказать о так называемом периоде полураспада — времени, за которое распадается половина атомов радиоактивного изотопа. Период полураспада не изменяется в зависимости от того, сколько атомов распалось прежде — это и означает, что процесс идет экспоненциально. Естественно, что при таком последовательном “ополовинивании” мы никогда не узнаем наверняка, что атомов начального элемента не осталось. Тем не менее, мы можем сказать, что спустя некоторое достаточно долгое время — например, десять периодов полураспада — останется так мало атомов исходного элемента, что в практических целях этим количеством можно пренебречь.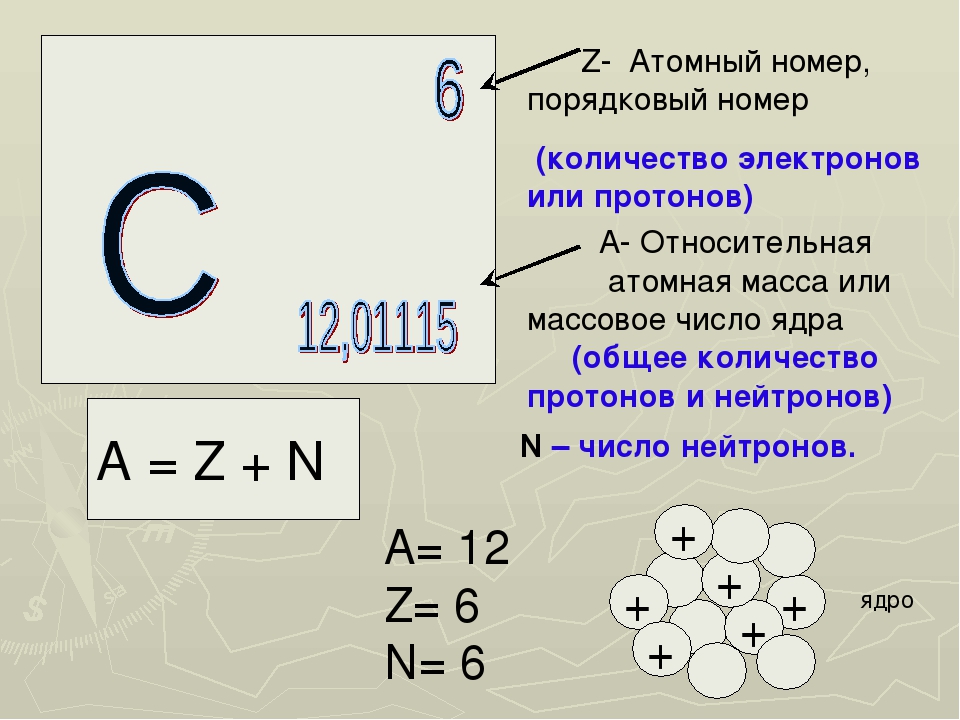 Например, период полураспада углерода-14 составляет 5730±40 лет. Следовательно, для ископаемых образцов старше 50–60 тысяч лет радиоуглеродное датирование не подходит, и необходимо пользоваться более медленными “часами”.
Например, период полураспада углерода-14 составляет 5730±40 лет. Следовательно, для ископаемых образцов старше 50–60 тысяч лет радиоуглеродное датирование не подходит, и необходимо пользоваться более медленными “часами”.
Фтор – информация об элементе, свойства и применение
Стенограмма: Химия в ее стихии: фтор(Промо) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Крис Смит На этой неделе это не сильная кислота, но она определенно смертоносна. Кира Дж. Вайсман 37-летний техник пролил себе на колени всего несколько сотен миллилитров или около того во время обычного палеонтологического эксперимента. В отличие от своих близких родственников, соляной и бромистоводородной кислот, HF является слабой кислотой. Это, в сочетании с его небольшим молекулярным размером, позволяет ему проникать в кожу и быстро мигрировать в более глубокие слои тканей. Пройдя через эпидермис, HF начинает диссоциировать, высвобождая высокореактивный ион фтора. Свободный фтор прочно связывается как с кальцием, так и с магнием, образуя нерастворимые соли, которые осаждаются в окружающих тканях. Лишившись своих кофакторов, важные метаболические ферменты больше не могут функционировать, клетки начинают умирать, ткани разжижаются, а кости разрушаются.И если потеря кальция происходит достаточно быстро, такие мышцы, как сердце, перестают работать. HF имеет долгую историю деструктивного поведения, унесшего жизни нескольких химиков в 1800-х годах, в том числе бельгийца Полена Луйе и француза Жерома Никлеса. Эти смелые ученые боролись за то, чтобы первыми выделить элементарный фтор (F 2 ) из его различных соединений с помощью электролиза.Однако в 1886 году это удалось соотечественнику Никлеса, Анри Муассану. Чтобы совершить этот подвиг, Муассану пришлось бороться не только с HF — предпочтительным электролитом в таких экспериментах, — но и с самим фтором, сильно реакционноспособным газом. Его ключевое нововведение заключалось в том, чтобы сконструировать аппарат из платины, одного из немногих металлов, способных противостоять агрессивному воздействию, при этом электролитический раствор охлаждался до -50 °C для ограничения коррозии. Подвиг Муассан принес ему Нобелевскую премию по химии 1906 года, но празднование было недолгим. По иронии судьбы, хотя элементарный фтор явно вреден для здоровья, атомы фтора содержатся примерно в 20% всех фармацевтических препаратов. Самый продаваемый антидепрессант Prozac, препарат для снижения уровня холестерина Lipitor и антибактериальный Cipro — все они обязаны своим успехом фтору. Как это возможно? Потому что обратной стороной чрезвычайной реакционной способности фтора является прочность связей, которые он образует с другими атомами, особенно с углеродом.Это свойство делает фторорганические соединения одними из самых устойчивых и инертных веществ, известных человеку. Особый статус фтора также связан с «фактором фтора», способностью этого маленького атома точно регулировать химические свойства всей молекулы. Например, замена водорода фтором может защитить лекарства от деградации метаболическими ферментами, продлевая их активное время жизни в организме. Большинство из нас также обязаны фтору своими сияющими улыбками. Агенты, борющиеся с кариесом в зубной пасте, представляют собой неорганические фториды, такие как фторид натрия и монофторфосфат натрия. Фтор не только уменьшает количество растворяющей эмаль кислоты, вырабатываемой бактериями зубного налета, но и помогает в процессе восстановления зубов, проникая в эмаль, образуя еще более твердую поверхность, которая сопротивляется дальнейшему воздействию.И на этом список медицинских приложений не заканчивается. Усыпление вызывает немного меньше беспокойства благодаря фторированным анестетикам, таким как изофлуран и десфлуран, которые заменили легковоспламеняющиеся и взрывоопасные альтернативы, такие как диэтиловый эфир и хлороформ. Фторохимикаты также являются основой промышленности. Одним из самых известных является полимер политетрафторэтилен, более известный как тефлон, который носит звание самого скользкого твердого вещества в мире. Обладая высокой термостойкостью и водонепроницаемостью, он используется в качестве покрытия для кастрюль и сковородок, в спреях для выпечки, а также для отталкивания пятен на мебели и коврах. Нагрев и растяжение превращают тефлон в Gore-tex, пористую мембрану, известную как спортивная одежда. Поры Gore-tex достаточно малы, чтобы удерживать капли воды, но при этом позволяют водяному пару (то есть поту) выходить. Фтор давно известен как «тигр химии». И хотя элемент, безусловно, сохраняет свою дикую сторону, мы можем обоснованно утверждать, что приручили его. Поскольку когда-либо было обнаружено всего несколько встречающихся в природе фторорганических соединений, некоторые могут утверждать, что мы теперь используем фтор лучше, чем даже сама природа. Крис Смит Итак, тефлон признан самой скользкой вещью в мире, и я держу пари, что здесь есть один или два политикана, которые благодарят фтор за это.Спасибо также Кире Вейсманн из Заарландского университета в Германии. Next week.ouch Steve Mylon Я не могу себе представить, что это все, что кто-то мог бы сказать, если бы ему не повезло заболеть одноименной болезнью. Ой-ой болезнь. Заболевание возникает в результате чрезмерного отравления кадмием и впервые было зарегистрировано в маленьком городке примерно в 200 милях к северо-западу от Токио. Рис, выращенный на загрязненных кадмием почвах, содержал в 10 раз больше кадмия, чем обычный рис.Ох-о-о-о-о-о-о-о-о-о-сть этой болезни была следствием слабых и ломких костей, подверженных разрушению из-за высокой пористости. Крис Смит И вы можете узнать об очень важном факторе со Стивом Майлоном, когда он раскроет историю кадмия в выпуске «Химия в его элементах» на следующей неделе. (Акция) (Конец акции) |
Сколько нейтронов содержит фтор
Сколько нейтронов содержит фтор
Сколько протонов, нейтронов и электронов содержит фтор 19?
| Этот изотоп фтора имеет 9 протонов, 9 электронов и 10 нейтронов.
Сколько протонов, нейтронов и электронов у фтора?
фтор название
2 3
3
| 18998 | 18 998 | ||||||
| Количество протонов | 9 | Количество нейтронов | десять | Количество электронов | 9 |
Во-вторых, каков атомный номер фтора 19?
9Проще говоря, сколько протонов, нейтронов и электронов содержится в нейтральном атоме фтора-19?
Это означает, что у него 18 протонов и 18 электронов.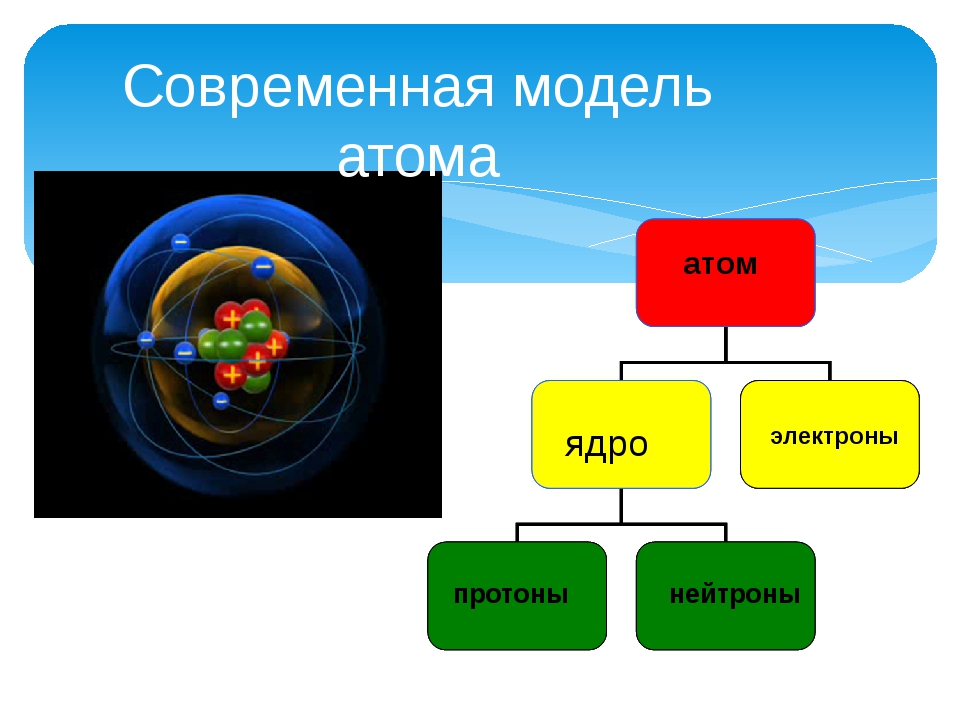
Сколько электронов у фтора?
9 электронов
Как найти нейтроны?
Чтобы найти количество нейтронов в атоме, просто вычтите количество протонов из массового числа. Обратите внимание, что атомное ядро состоит из протонов и нейтронов. А количество частиц, присутствующих в ядре, называется массой языков (также называемой атомной массой).
Как найти электроны?
Строение атома. Количество протонов, нейтронов и электронов в атоме можно определить с помощью простого набора правил.Количество протонов в атомном ядре равно атомному номеру (Z). Количество электронов в нейтральном атоме равно количеству протонов.
Сколько нейтронов у азота?
7 нейтронов
Сколько нейтронов содержит магний?
Все атомы магния имеют в ядре 12 протонов. Они характеризуются только тем, что атом с массой 24 Mg имеет в ядре 12 нейтронов, атом с массой 25 Mg – 13 нейтронов, а атом с массой 26 Mg – 14 нейтронов.
Как определяются валентные электроны?
В случае нейтральных атомов число валентных электронов равно числу главных групп в атоме. Номер группового названия элемента находится в столбце периодической таблицы. Например, углерод находится в группе 4 и имеет 4 валентных электрона. Кислород принадлежит к группе 6 и имеет 6 валентных электронов.
Номер группового названия элемента находится в столбце периодической таблицы. Например, углерод находится в группе 4 и имеет 4 валентных электрона. Кислород принадлежит к группе 6 и имеет 6 валентных электронов.
Сколько электронов у протонов и нейтронов в хлоре?
Хлорное имя
3
| атомная масса | 35,453 атомные массовые агрегаты | |||||||
| Количество протонов | 17 ° | 17 ° | Количество нейтронов | 18 ° | Количество электронов | 17 ° |
У фтора 10 нейтронов?
Ответ и объяснение: Какая информация имеется 9 о фториде? У фтора 9 протонов.Мы знаем, что атомный номер атома определяется количеством протонов. Таким образом, атомный номер фтора равен 9. В нейтральном атоме количество протонов равно количеству электронов, но не дается никакой информации о том, является ли атом нейтральным.
Сколько нейтронов содержится в атоме алюминия 27?
14 нейтронов
Что такое атомные массовые числа?
Массовое число (символ А, от немецкого слова atomic weight (атомный вес)), также называемое числом атомной массы или числом нуклеиновой кислоты, представляет собой общее число протонов и нейтронов (совместно называемых нуклонами) в анатомическом ядре. Массовое число различно для каждого изотопа химического элемента.
Массовое число различно для каждого изотопа химического элемента.
Сколько протонов у нейтронов и электронов в магнии?
A: Магний в своей основной форме имеет 12 протонов и 12 электронов. У нейтронов другое дело. Средняя атомная масса магния составляет 24 305 атомных единиц массы, но ни один атом магния не имеет точно такой массы.
Является ли фтор нейтральным атомом?
Когда атомы собирают электроны, они становятся отрицательными ионами или анионами. Возьмем пример фтора (см. иллюстрацию ниже).Атом фтора имеет девять протонов и девять электронов, поэтому он электрически нейтрален. Когда атом фтора принимает электрон, он становится ионом фтора с электрическим зарядом 1.
Что такое атомный номер 9?
Химия: Список элементов периодической таблицы, отсортированный по: атомному номеру
Что такое 9 протонов и 10 нейтронов?
Флюорин название
3
8
| атомная масса | 18 998 атомных массовых массовых агрегатов | ||||||
| Количество протонов | Количество нейтронов | Количество нейтронов | Количество электронов | 9 |
Какова плотность фтора?
фтор
| Фаза для STP | Газ |
| Точка плавления | 53. 48К?(-219,67 °С, -363,41 °F) |
| температура кипения | 85.03К?(-188,11°C, -306,60°F) |
| Плотность (по СТП) | 1696 г/л |
5 20920 How Many Neutrons 0 Fluorine Does0
Сколько протонов у фтора
Сколько протонов у фтора
Сколько протонов, нейтронов и электронов содержит фтор-18?
Фтор18
Вообще
| протона | 9 | ||
| 8 | |||
| 9 | |||
| Натуральная полнота | RadioisoTope |
Сколько протонов, нейтронов и электронов именно фторид?
Fluoro name
3
| 180102 | 18 998 | |||||||
| Количество протонов | 9 | Количество нейтронов | Количество электронов | Количество электронов | 9 |
Как сколько нейтронов в 19 F кроме вышеперечисленных?
10 нейтронов Мы также спрашиваем, сколько протонов электронов и нейтронов следующий изотоп 18 ext f {} 18 F -?
содержать.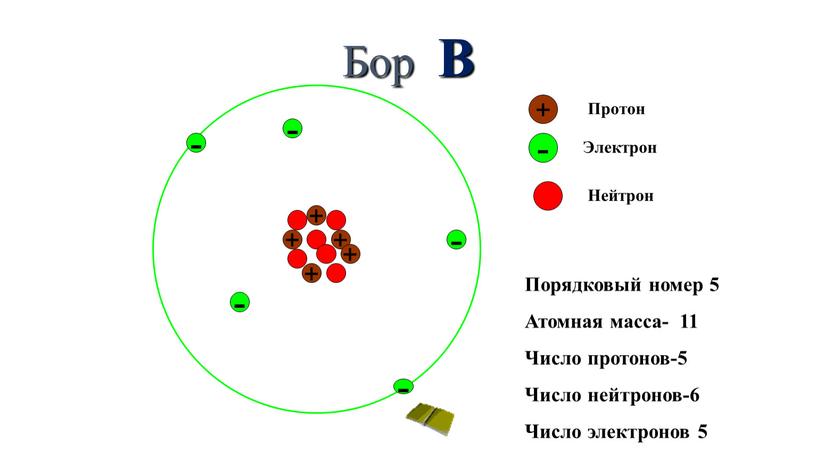 Все изотопы фтора имеют девять протонов, поэтому 9 — это атомный номер и идентичность элемента. Чтобы уравновесить девять положительных зарядов, нейтральный атом фтора должен иметь такое же количество электронов. Почти весь природный фтор представляет собой 10-нейтронный изотоп (19·9).
Все изотопы фтора имеют девять протонов, поэтому 9 — это атомный номер и идентичность элемента. Чтобы уравновесить девять положительных зарядов, нейтральный атом фтора должен иметь такое же количество электронов. Почти весь природный фтор представляет собой 10-нейтронный изотоп (19·9).
Сколько электронов содержит ион 18f?
Количество электронов: На 9 протонов в нейтральном атоме фтора должно приходиться 9 электронов. Но мы получаем ион фтора (т.е.
Ф?
), так что у него есть еще один электрон, так что всего 10 электронов.
Какой элемент имеет 9 протонов и 10 нейтронов?
Фтор
Сколько нейтронов содержит магний?
Название магния
3
| 2 | 24, 305 атомные массовые агрегаты | |||
| Количество протонов | 12 ° | |||
| Количество нейтронов | 12 | Количество электронов | 12 ° |
Сколько нейтронов у азота?
7
Как найти электроны?
Количество электронов в нейтральном атоме равно количеству протонов. Массовое число атома (М) равно сумме протонов и нейтронов в ядре. Количество нейтронов равно разнице между атомным номером (М) и атомным номером (Z).
Массовое число атома (М) равно сумме протонов и нейтронов в ядре. Количество нейтронов равно разнице между атомным номером (М) и атомным номером (Z).
Сколько электронов у f?
Сколько электронов у AR?
2.8.8
Сколько электронов у f2?
Слева атом фтора с семью валентными электронами. Справа молекула F2. Двухатомная молекула фтора (F2) содержит одну пару отдельных электронов.Каждый атом F также имеет три пары электронов, которые не являются общими с другим атомом.
Сколько протонов у f?
9
Что представляет собой диаграмма Бора для фтора?
На приведенной ниже диаграмме показана модель Бора для фтора. Ядро фтора имеет 9 протонов. Вокруг ядра фтора находится 9 электронов. На второй орбите 7 электронов.
Сколько протонов и электронов у F?
Как найти количество электронов в изотопе?
Число нейтронов равно массовому числу атома минус атомный номер.Атомный номер и средняя атомная масса (средневзвешенное значение массового числа для всех изотопов) указаны в периодической таблице. Число электронов в атомах и нейтральных изотопах равно числу протонов.
Число электронов в атомах и нейтральных изотопах равно числу протонов.
Как найти нейтроны?
Это означает, что вы узнаете количество нейтронов и вычтете количество протонов из массового числа. В периодической таблице атомный номер — это число протонов, а атомная масса — это массовое число.
Сколько нейтронов у фтора-18?
Fluorine18 (18F) — это радиоизотоп фтора, который является важным источником позитронов.Он имеет массу 18 000 9 380 (6) часов, а его период полураспада составляет 109 771 (20) минут. Фтор18.
Каков самый высокий энергетический уровень фтора?
Фтор имеет семь из восьми возможных электронов на внешнем энергетическом уровне, энергетическом уровне II.
Какова атомная масса фтора?
Является ли фтор нейтральным атомом?
Ответ: Когда атомы поглощают электроны, они становятся отрицательными ионами или анионами. Атом фтора имеет девять протонов и девять электронов, поэтому он электрически нейтрален.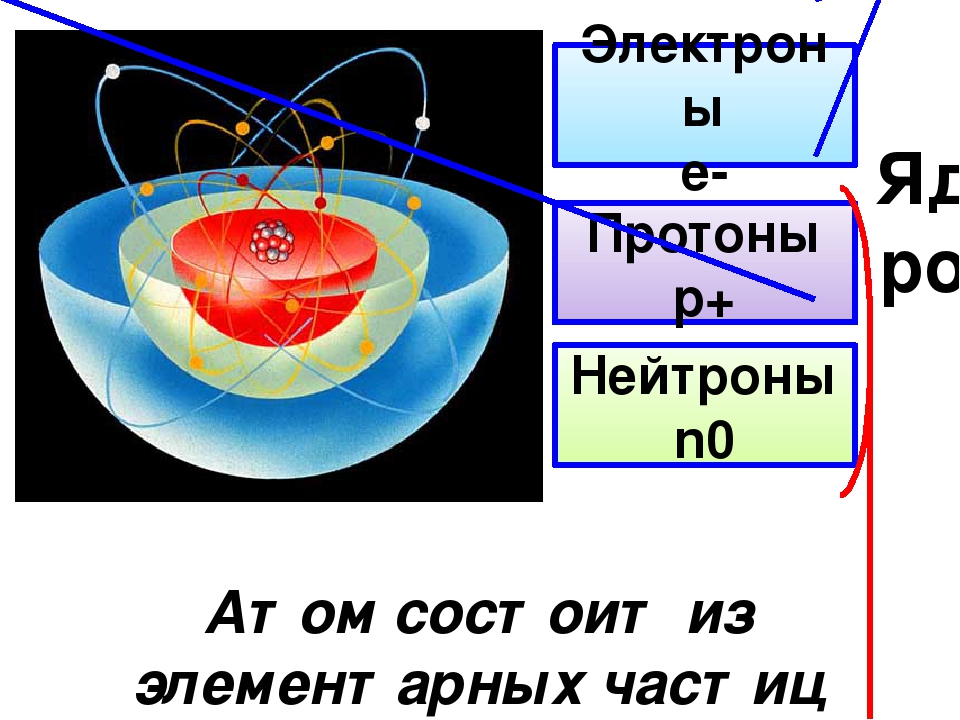 Когда атом фтора принимает электрон, он становится фторидом с электрическим зарядом 1,
Когда атом фтора принимает электрон, он становится фторидом с электрическим зарядом 1,
.
Фтор это металл?
Сколько протонов у фтора
Химия фтора (Z=9) — Химия LibreTexts
Фтор (F) — первый элемент в группе галогенов (группа 17) в периодической таблице. Его атомный номер 9, атомный вес 19, и это газ при комнатной температуре. Это самый электроотрицательный элемент, учитывая, что он является высшим элементом в группе галогенов, и поэтому очень реактивен.Это неметалл и один из немногих элементов, которые могут образовывать двухатомные молекулы (F2). Он имеет 5 валентных электронов на уровне 2p. Его электронная конфигурация: 1s 2 2s 2 2p 5 . Обычно он образует анион F — , поскольку он чрезвычайно электроотрицательный и является сильным окислителем. Фтор является кислотой Льюиса в слабой кислоте, что означает, что он принимает электроны при реакции. У фтора много изотопов, но единственный стабильный изотоп, встречающийся в природе, — это F-19.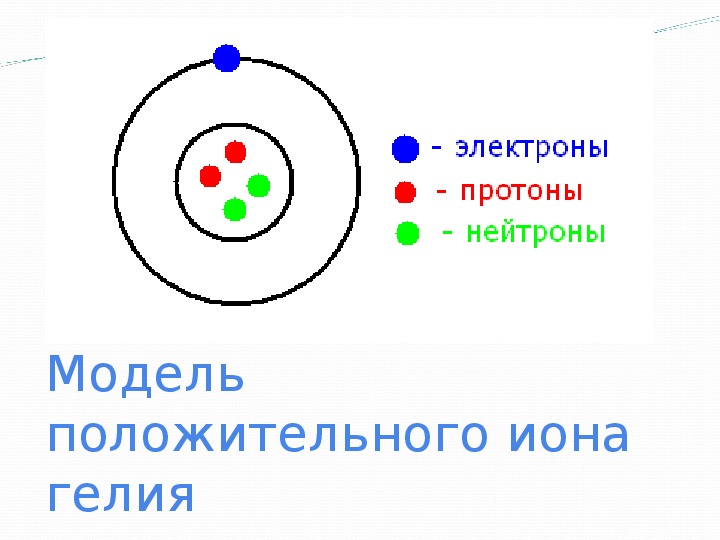
Краткая история
В конце 1600-х годов минералы, которые, как мы теперь знаем, содержат фтор, использовались для травления стекла.Открытие элемента было вызвано поисками химического вещества, способного разъедать стекло (это HF, слабая кислота). Ранняя история выделения и работы с фтором и фтористым водородом полна несчастных случаев, поскольку оба они чрезвычайно опасны. В конце концов, электролиз смеси KF и HF (тщательно следя за тем, чтобы образовавшийся водород и фтор не соприкасались) в платиновом аппарате дал элемент.
Рисунок 1: Изображение предоставлено Википедией.
Фтор был открыт в 1530 году Георгиусом Агриколой.Первоначально он нашел его в составе плавикового шпата, который использовался для ускорения плавления металлов. Он находился под этим приложением до 1670 года, когда Шванхард обнаружил его полезность в травлении стекла. Чистый фтор (от латинского fluere, что означает «поток») не был выделен до 1886 года Анри Муассаном, который по пути сжег и даже убил многих ученых.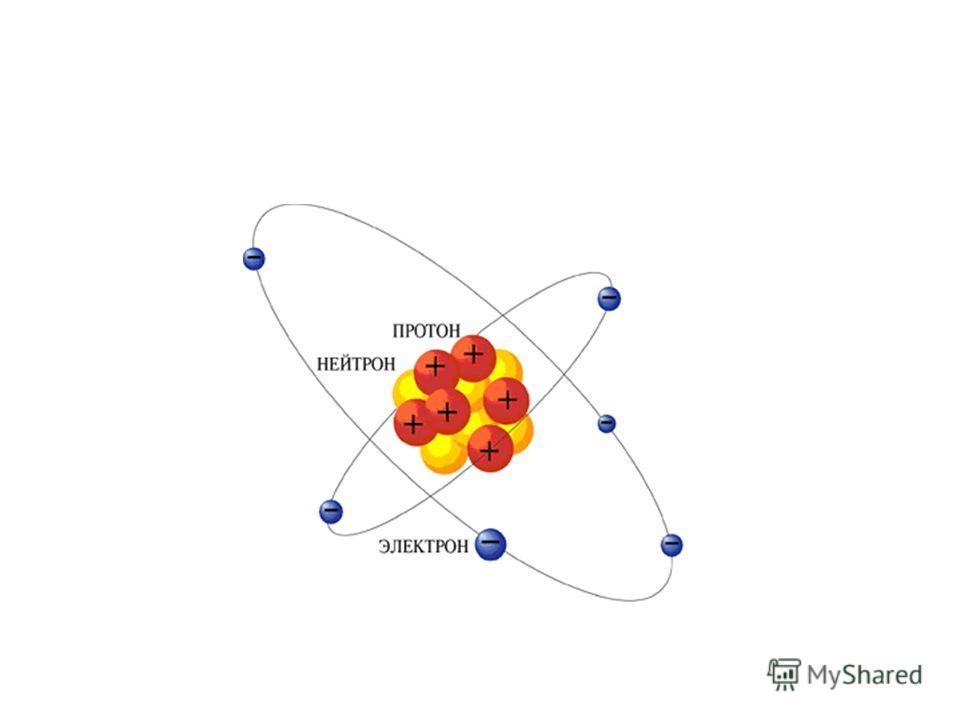 Сегодня у него много применений, в частности, в Манхэттенском проекте по созданию первой ядерной бомбы.
Сегодня у него много применений, в частности, в Манхэттенском проекте по созданию первой ядерной бомбы.
Электроотрицательность фтора
Фтор — самый электроотрицательный элемент в периодической таблице, а это означает, что он является очень сильным окислителем и принимает электроны других элементов.Электронная конфигурация атома фтора: 1s 2 2s 2 2p 5 . (см. рис. 2)
Рисунок 2: Электронная конфигурация фтора
. Фтор является наиболее электроотрицательным элементом, поскольку он имеет 5 электронов в своей 2P-оболочке. Оптимальная электронная конфигурация 2P-орбитали содержит 6 электронов, поэтому, поскольку фтор настолько близок к идеальной электронной конфигурации, электроны очень плотно прилегают к ядру. Высокая электроотрицательность фтора объясняет его малый радиус тем, что положительные протоны очень сильно притягиваются к отрицательным электронам, удерживая их ближе к ядру, чем более крупные и менее электроотрицательные элементы.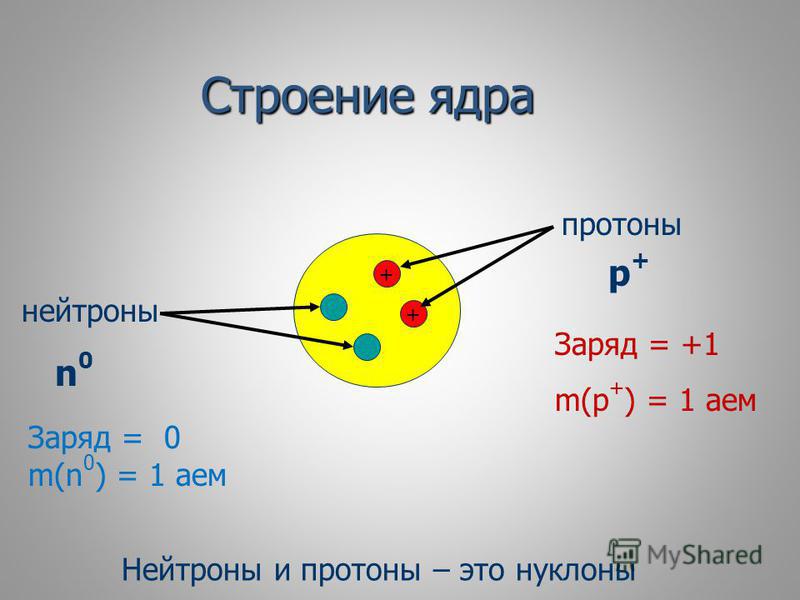
Реакции фтора
Из-за своей реакционной способности элементарный фтор никогда не встречается в природе, и никакой другой химический элемент не может вытеснить фтор из его соединений. Фтор связывается практически со всеми элементами, как с металлами, так и с неметаллами, поскольку является очень сильным окислителем. Он очень нестабилен и реакционноспособен, поскольку он так близок к своей идеальной электронной конфигурации. Он образует ковалентные связи с неметаллами, и, поскольку он является наиболее электроотрицательным элементом, он всегда будет восстанавливаемым элементом.- \тег{2}\]
Существуют также некоторые органические соединения, состоящие из фтора, от нетоксичных до высокотоксичных. Фтор образует ковалентные связи с углеродом, которые иногда образуют стабильные ароматические кольца. Когда углерод реагирует с фтором, реакция носит сложный характер и образует смесь \(CF_4\), \(C_2F_6\), \(C_5F_{12}\).
\[C_{(s)} + F_{2(g)} \rightarrow CF_{4(g)} + C_2F_6 + C_5F_{12} \tag{3}\]
Фтор реагирует с кислородом с образованием \(OF_2\), потому что фтор более электроотрицателен, чем кислород.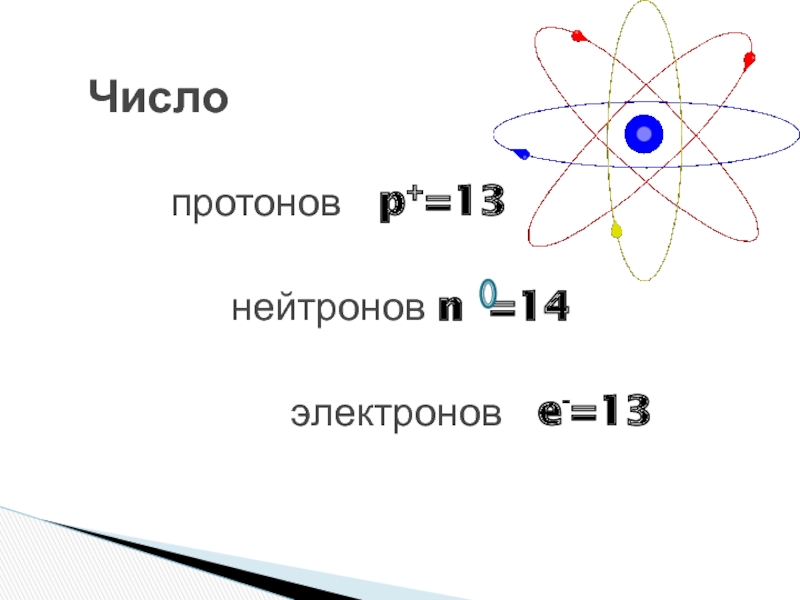 Реакция идет:
Реакция идет:
\[2F_2 + O_2 \стрелка вправо 2OF_2 \тег{4}\]
Фтор настолько электроотрицателен, что иногда он даже образует молекулы с благородными газами, такими как ксенон, такие как молекула дифторида ксенона, \(XeF_2\).
\[Xe + F_2 \rightarrow XeF_2 \tag{5}\]
Фтор также образует сильные ионные соединения с металлами. Некоторые распространенные ионные реакции фтора:
\[F_2 + 2NaOH \rightarrow O_2 + 2NaF +H_2 \tag{6}\]
\[4F_2 + HCl + H_2O \rightarrow 3HF + OF_2 + ClF_3 \tag{7}\]
\[F_2 + 2HNO_3 \rightarrow 2NO_3F + H_2 \tag{8}\]
Применение фтора
Соединения фтора присутствуют во фторированной зубной пасте и во многих муниципальных системах водоснабжения, где они помогают предотвратить кариес.И, конечно же, фторуглероды, такие как тефлон, оказали большое влияние на жизнь в 20 веке. Есть много применений фтора:
- Ракетное топливо
- Производство полимеров и пластмасс
- тефлон и тефзель производство
- В сочетании с кислородом используется в качестве охладителя холодильника
- Плавиковая кислота, используемая для травления стекла
- Очистка коммунальных источников воды
- Производство урана
- Кондиционер
Источники
Фтор можно найти в природе или произвести в лаборатории. Чтобы сделать это в лаборатории, такие соединения, как фторид калия, подвергают электролизу с плавиковой кислотой для создания чистого фтора и других соединений. Его можно проводить с различными соединениями, обычно ионными, включающими фтор и металл. Фтор также можно найти в природе в виде различных минералов и соединений. Двумя основными соединениями, в которых он содержится, являются плавиковый шпат (\(CaF_2\)) и криолит (\(Na_3AlF_6\)).
Чтобы сделать это в лаборатории, такие соединения, как фторид калия, подвергают электролизу с плавиковой кислотой для создания чистого фтора и других соединений. Его можно проводить с различными соединениями, обычно ионными, включающими фтор и металл. Фтор также можно найти в природе в виде различных минералов и соединений. Двумя основными соединениями, в которых он содержится, являются плавиковый шпат (\(CaF_2\)) и криолит (\(Na_3AlF_6\)).
Ссылки
- Newth, GS Неорганическая химия .Лонгманс, Грин и Ко.: Нью-Йорк, 1903 г.
- Латимер, Венделл М., Хильдебранд, Джоэл Х. Справочник по неорганической химии . Компания Macmillan: Нью-Йорк, 1938.
.
.
Проблемы
(Выделите, чтобы просмотреть ответы)
1. В. Какова электронная конфигурация фтора? F — ?
А. 1с 2 2с 2 2п 5
1с 2 2с 2 2п 6
2. В. Фтор обычно окисляется или восстанавливается? объяснять.
В. Фтор обычно окисляется или восстанавливается? объяснять.
A. Фтор обычно восстанавливается, потому что он принимает электрон от других элементов, так как он такой электроотрицательный.
3. В. Каковы некоторые распространенные области применения фтора?
A. Зубная паста, пластмассы, ракетное топливо, травление стекла и т. д.
4. В. Образует ли фтор соединения с неметаллами? если да, приведите два примера, один из которых относится к оксиду.
А. 2 , CLF
5.В. В какой группе находится фтор? (включая название группы и номер)
А. 17, Галогены
Авторы и авторство
- Рэйчел Фельдман (Калифорнийский университет, Дэвис)
Стивен Р. Марсден
Фтор — Атомный номер — Атомная масса — Плотность фтора
Атомный номер фтора
Фтор — химический элемент с атомным номером 9 , что означает, что в атомной структуре 9 протонов и 9 электронов. Химический символ для фтора — это F .
Химический символ для фтора — это F .
Поскольку количество электронов отвечает за химическое поведение атомов, атомный номер идентифицирует различные химические элементы.
Как атомный номер определяет химическое поведение атомов?
Атомная масса фтора
Атомная масса фтора 18,9984 ед.
Обратите внимание, что каждый элемент может содержать больше изотопов. Следовательно, эта результирующая атомная масса рассчитывается на основе встречающихся в природе изотопов и их распространенности.
Единицей измерения массы является атомная единица массы (а.е.м.) . Одна атомная единица массы равна 1,66 х 10 -24 граммов. Одна единая атомная единица массы составляет приблизительно массы одного нуклона (либо отдельного протона, либо нейтрона) и численно эквивалентна 1 г/моль.
Для 12 C атомная масса точно равна 12u, так как по ней определяется единица атомной массы. Для других изотопов изотопная масса обычно отличается и обычно находится в пределах 0.1 ед массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в основном ядерном состоянии равна 62,91367 ед.
Для других изотопов изотопная масса обычно отличается и обычно находится в пределах 0.1 ед массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в основном ядерном состоянии равна 62,91367 ед.
Различие между массовым числом и изотопной массой, известное как дефект массы, объясняется двумя причинами: Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов.
Число атомной массы определяет прежде всего атомную массу атомов.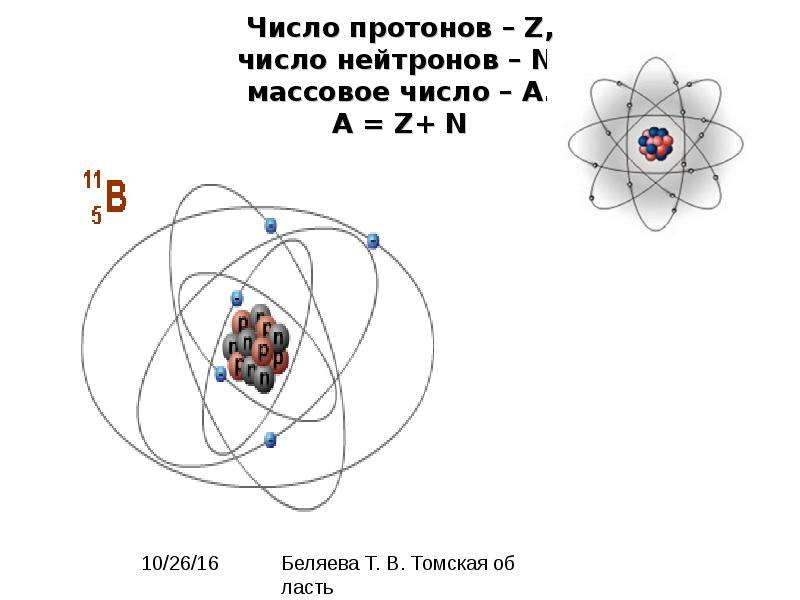 Массовое число различно для каждого изотопа химического элемента.
Массовое число различно для каждого изотопа химического элемента.
Как атомная масса определяет плотность материалов?
Плотность фтора
Плотность фтора 1,696 г/см 3 .
Типичные плотности различных веществ при атмосферном давлении.
Плотность определяется как масса на единицу объема . Это интенсивное свойство , которое математически определяется как масса, деленная на объем:
ρ = m/V
вещества, деленное на общий объем (V), занимаемый этим веществом.Стандартная единица СИ составляет килограммов на кубический метр ( кг/м 3 ). Стандартная английская единица измерения – 90 009 фунтов массы на кубический фут ( фунтов/фут 3 ).
см. Также: Что такое плотность
см. Также: самые плотные материалы земли
фтор — свойства 9071
9984
3
| элемент | фтор 8 | |||||
|---|---|---|---|---|---|---|
| атомное число | 9 | |||||
| символ | F | F | F | Элемент элемент | Галоген | |
| Фаза на STP | GAS | |||||
| атомная масса [AMU] | 18. 9984 9984 | |||||
| Плотность на STP [G / CM3] | 1.696 | Электронная конфигурация | [HE] 2S2 2P5 | |||
| Возможные окисленные состояния | -1 | |||||
| Электронная аффинность [KJ / MOL | 328 | 328 | ||||
| Электронегативность [Pauling Scale] | 3.98 | |||||
| 1-я ионизационная энергия [EV] | 17.4228 | |||||
| год открытия | 1886 | Discoverer | Moissan, Henri | |||
| Термические свойства | ||||||
| Температура плавления [шкала Цельсия] | -219.8 | |||||
| кипения точка кипения [Celsius Face] | -188.1 | |||||
| 0,0279 | 0,0279 | Удельное тепло [J / G K] | 0,82 | |||
| Fusion [KJ / MOL] | 0.2552 | |||||
| Тепловое тепло [KJ / MOL] | 3.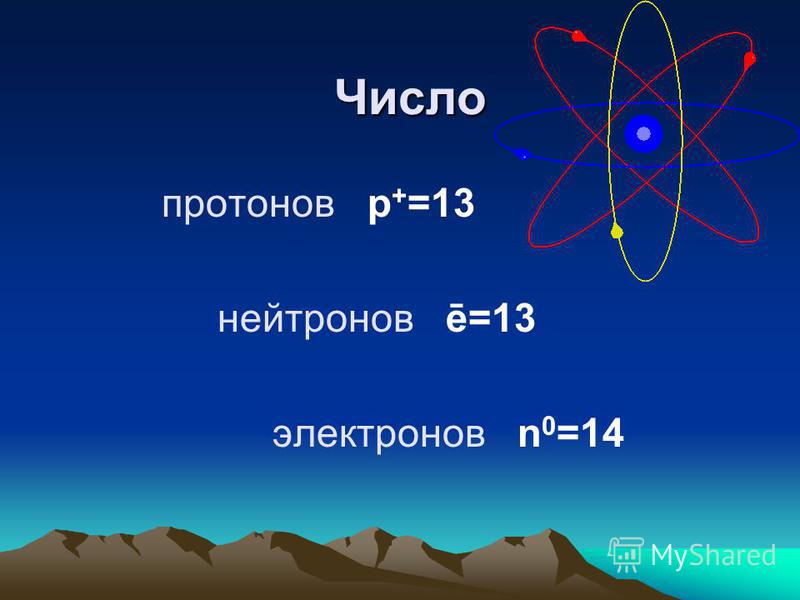 2698 2698 | 32698 |
фтор в периодической таблице
—
—
—
Фторс — ключевой этап Wiki
Ключевой этап 2
Значение
Фтор — желтый газ.
Ключевой этап 3
Значение
Фтор — элемент 7-й группы Периодической таблицы элементов с атомным номером 9.
О фторе
Молекулярная структура
- Фтор имеет химическую формулу F 2 .
Атомная структура
- Фтор в виде 9 протонов и 10 нейтронов в ядре, что дает ему атомный номер 9 и атомную массу 19.
- У атома фтора отсутствует один электрон из полной внешней оболочки.
Свойства
- Фтор является неметаллическим элементом.
- Фтор является наиболее реакционноспособным галогеном.
- Фтор сильно реагирует с водородом с образованием фтористого водорода, который растворяется в воде с образованием плавиковой кислоты.

- Фтор является сильным отбеливающим средством.
- Фтор убивает бактерии.
- Фтор представляет собой газ желтого цвета при комнатной температуре.
Ключевой этап 4
Значение
Фтор — элемент 7-й группы Периодической таблицы элементов с 9 протонами в ядре.
О фторе
Молекулярная структура
- Фтор имеет химическую формулу F 2 .
- Атомы фтора образуют ковалентную связь.
Атомная структура
- Самый стабильный изотоп фтора имеет 10 нейтронов в ядре, что дает ему атомную массу 19.
- У атома фтора отсутствует один электрон из полной внешней оболочки.
- Ионы фтора получают 1 электрон, чтобы получить полную внешнюю оболочку и стать отрицательно заряженными.
| Диаграмма, показывающая образование иона фторида . |
Свойства
- Фтор является неметаллическим элементом.

- Фтор является наиболее реакционноспособным галогеном.
- Фтор сильно реагирует с водородом с образованием фтористого водорода, который растворяется в воде с образованием плавиковой кислоты.
- Фтор является сильным отбеливающим средством.
- Фтор убивает бактерии.
- Фтор представляет собой газ желтого цвета при стандартной температуре и давлении.
Проверка на фтор
- Соберите газ в пробирку.
- Поместите кусочек лакмусовой бумаги на горлышко пробирки.
- Если лакмусовая бумажка обесцвечена, то газ представляет собой фтор или хлор.
Каталожные номера
АКА
- Фтор, стр. 61, GCSE Chemistry, CGP, AQA
- Фтор, стр. 61, Комбинированная научная трилогия GCSE; Химия, CGP, AQA
- Фтор, страницы 26, 44-5, 61, GCSE по химии; Учебник, Collins, AQA
Сколько электронов и протонов во фторе? — Ответы на все
Сколько электронов и протонов во фторе?
| Имя | Фтор |
|---|---|
| Атомная масса | 18.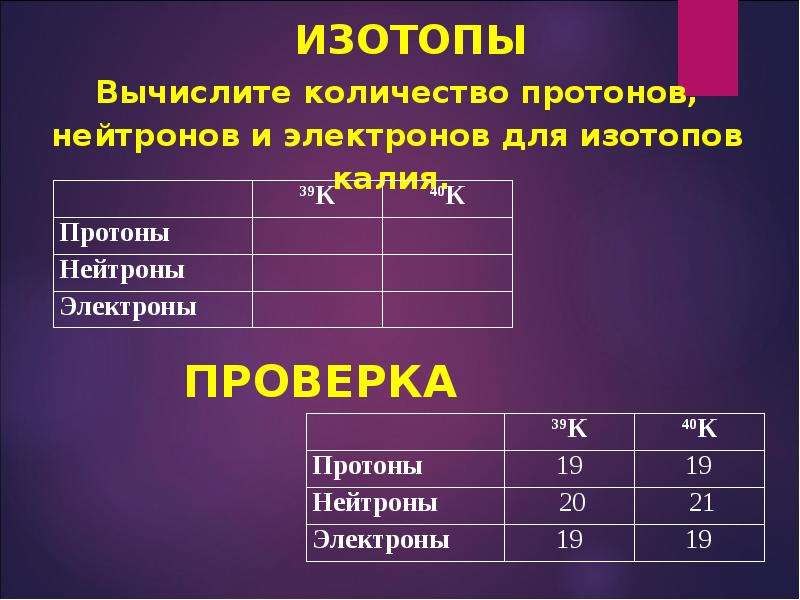 998 атомных единиц массы 998 атомных единиц массы |
| Количество протонов | 9 |
| Количество нейтронов | 10 |
| Количество электронов | 9 |
Сколько протонов нейтронов и электронов во фторе?
Фтор-19 состоит из 9 протонов, 10 нейтронов и 9 электронов. Его изобилие составляет 100%; других изотопов фтора в значительных количествах не существует.
Сколько протонов у фтора?
9
Фтор/Атомный номер
Сколько электронов у фтора?
9 электронов
Фтор — девятый элемент с 9 электронами.При записи электронной конфигурации фтора первые два электрона будут находиться на 1s-орбитали. Поскольку 1s может удерживать только два электрона, следующие 2 электрона для F переходят на 2s-орбиталь.
Может ли фтор иметь 10 электронов?
Фтор имеет атомный номер 9, поэтому в нейтральном состоянии один атом фтора имеет 9 протонов и 9 электронов. Если мы получаем электрон, у нас есть 10 электронов (так же, как ион Na+). Так что если у нашего «загадочного» элемента 10 электронов, то у него должно быть и 10 протонов.
Так что если у нашего «загадочного» элемента 10 электронов, то у него должно быть и 10 протонов.
Сколько протонов нейтронов и электронов во фторе 20?
Этот изотоп фтора имеет 9 протонов, 9 электронов и 10 нейтронов.
Сколько протонов у фтора 9?
Все изотопы фтора имеют девять протонов, поэтому 9 — это атомный номер и идентификационный номер элемента.
Сколько нейтронов у f?
10 нейтронов
Поскольку в каждом ядре фтора обязательно 9 протонов, почему обязательно?, в ядре фтора должно быть 10 нейтронов, нейтральных массивных частиц.
Сколько электронов в F?
Подоболочки
| Этикетка подоболочки | ℓ | Максимум электронов |
|---|---|---|
| с | 0 | 2 |
| р | 1 | 6 |
| д | 2 | 10 |
| ф | 3 | 14 |
Сколько нейтронов у фтора?
Причина: Рассмотрим атомы фтора с 9 протонами и 10 нейтронами.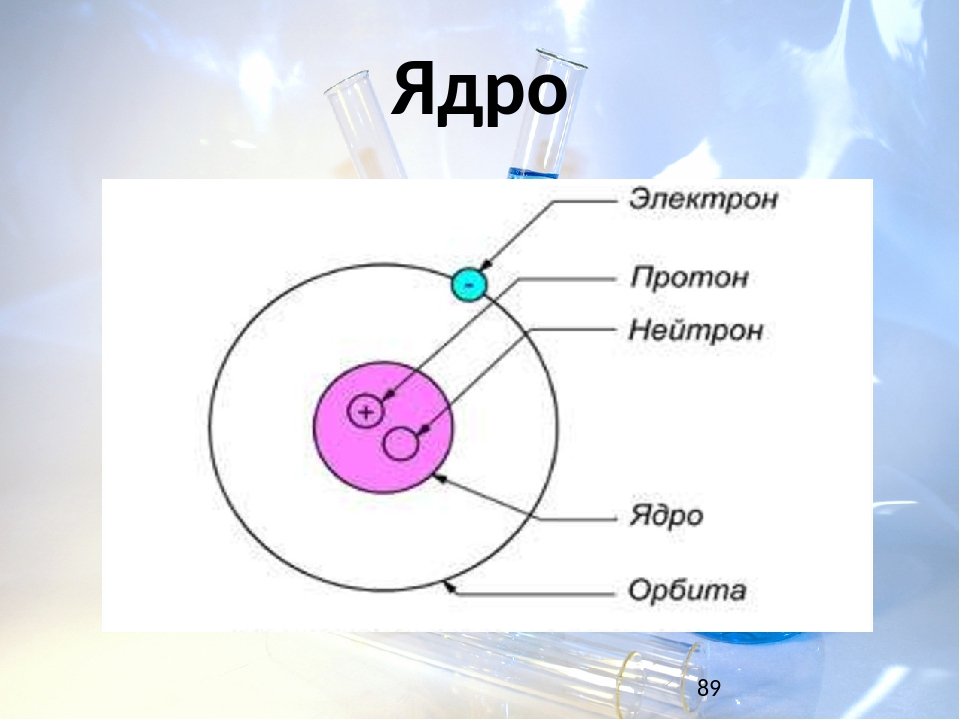
Сколько протонов у F 2?
девять протонов
Атом фтора имеет девять протонов и девять электронов, поэтому он электрически нейтрален. Легко получить атом водорода с одним протоном и одним нейтроном дейтерия, но вы не найдете атом гелия с атомным весом 2, потому что это означало бы, что атом гелия имеет два протона и ноль нейтронов!
Сколько протонов и электронов во фторе?
Атом фтора имеет девять протонов и девять электронов, поэтому он электрически нейтрален.Если атом фтора получает электрон, он становится ионом фтора с электрическим зарядом -1.
Как найти количество нейтронов в элементе?
Вычесть атомный номер из атомной массы. Поскольку подавляющее большинство массы атома состоит из его протонов и нейтронов, вычитание количества протонов (то есть атомного номера) из атомной массы даст вам расчетное количество нейтронов в атоме.
Какой элемент имеет 1 протон и 2 нейтрона?
Ядро трития (иногда его называют тритоном) содержит один протон и два нейтрона, тогда как ядро обычного изотопа водорода-1 («протий») содержит только один протон, а ядро водорода-2 («дейтерий») содержит один протон и один нейтрон. Встречающийся в природе тритий крайне редко встречается на Земле.
Встречающийся в природе тритий крайне редко встречается на Земле.
Количество протонов равно количеству нейтронов?
Протоны и нейтроны имеют примерно одинаковую массу. Однако один протон весит более 1800 электронов. Атомы всегда имеют одинаковое количество протонов и электронов, и количество протонов и нейтронов обычно также одинаково.
.

 Томсон
Томсон Он принял обычные меры предосторожности в таких ситуациях, быстро облился водой из лабораторного шланга и даже нырнул в ближайший бассейн, пока парамедики были в пути. Но через неделю врачи удалили ногу, и еще через неделю он умер. Виновник: плавиковая кислота (в просторечии известная как HF), и несчастный мужчина стал не первой ее жертвой.
Он принял обычные меры предосторожности в таких ситуациях, быстро облился водой из лабораторного шланга и даже нырнул в ближайший бассейн, пока парамедики были в пути. Но через неделю врачи удалили ногу, и еще через неделю он умер. Виновник: плавиковая кислота (в просторечии известная как HF), и несчастный мужчина стал не первой ее жертвой. Ожоги с концентрированной HF, охватывающие всего 2,5% площади поверхности тела — например, размер подошвы стопы — были смертельными.
Ожоги с концентрированной HF, охватывающие всего 2,5% площади поверхности тела — например, размер подошвы стопы — были смертельными. Очередная жертва токсического воздействия фтора, он умер всего через два месяца. Тем не менее, метод Муассан жил и используется сегодня для производства многотонного количества фтора из рудного плавикового шпата.
Очередная жертва токсического воздействия фтора, он умер всего через два месяца. Тем не менее, метод Муассан жил и используется сегодня для производства многотонного количества фтора из рудного плавикового шпата. Или введенный фтор может изменить форму молекулы, чтобы она лучше связывалась с белком-мишенью.Такая точная химическая обработка теперь может быть выполнена в фармацевтических лабораториях с использованием множества безопасных, имеющихся в продаже фторирующих агентов, или сложные преобразования могут быть просто переданы кому-то другому.
Или введенный фтор может изменить форму молекулы, чтобы она лучше связывалась с белком-мишенью.Такая точная химическая обработка теперь может быть выполнена в фармацевтических лабораториях с использованием множества безопасных, имеющихся в продаже фторирующих агентов, или сложные преобразования могут быть просто переданы кому-то другому.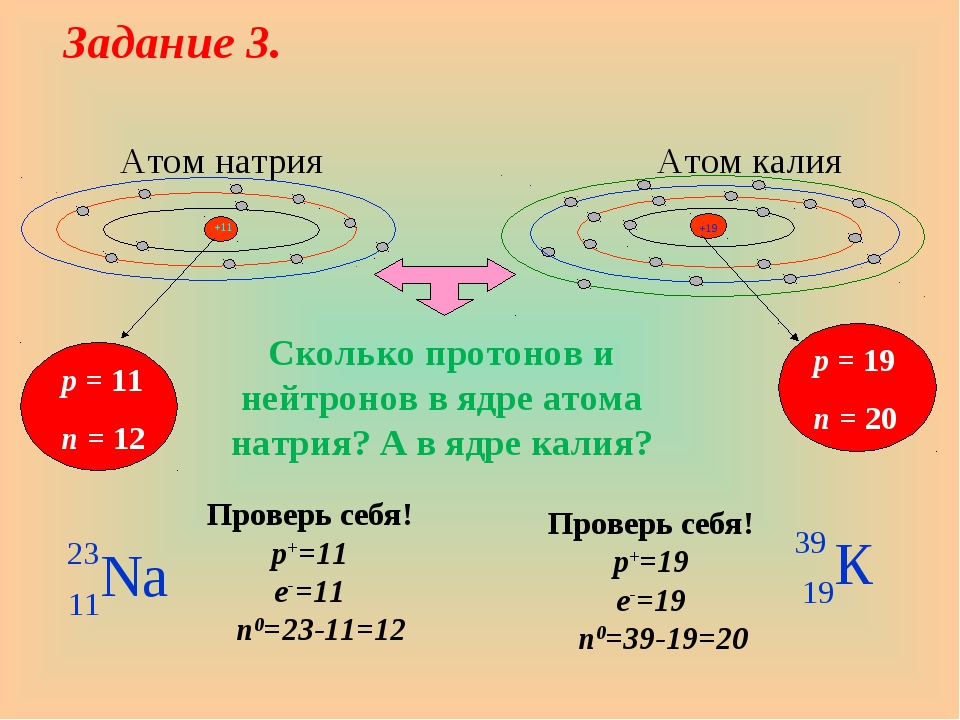 Фторуглероды также являются одним из основных кандидатов на разработку искусственной крови, поскольку кислород лучше растворяется в этих материалах, чем в большинстве других растворителей. А радиоактивный фтор ( 18 F, а не встречающийся в природе 19 F) является ключевым компонентом позитронно-эмиссионной томографии (или ПЭТ), метода визуализации всего тела, который позволяет обнаруживать раковые опухоли до их распространения.
Фторуглероды также являются одним из основных кандидатов на разработку искусственной крови, поскольку кислород лучше растворяется в этих материалах, чем в большинстве других растворителей. А радиоактивный фтор ( 18 F, а не встречающийся в природе 19 F) является ключевым компонентом позитронно-эмиссионной томографии (или ПЭТ), метода визуализации всего тела, который позволяет обнаруживать раковые опухоли до их распространения. Таким образом, вы можете бежать в дождливый день и оставаться сухим. Фтор играет еще одну важную роль в охлаждении, поскольку кондиционеры и бытовые холодильные установки работают на энергосберегающих фторуглеродных жидкостях. Использование фтора не ограничивается землей. Когда астронавты отправляются в космос, они полагаются на фторэластомеры, разновидность фторированного каучука. Эти материалы, используемые в уплотнительных кольцах и других уплотнительных устройствах, обеспечивают отсутствие утечек в самолете даже в экстремальных условиях жары и холода.А когда случаются несчастные случаи, космические путешественники могут положиться на огнетушители на основе фторуглеродов, чтобы потушить пламя.
Таким образом, вы можете бежать в дождливый день и оставаться сухим. Фтор играет еще одну важную роль в охлаждении, поскольку кондиционеры и бытовые холодильные установки работают на энергосберегающих фторуглеродных жидкостях. Использование фтора не ограничивается землей. Когда астронавты отправляются в космос, они полагаются на фторэластомеры, разновидность фторированного каучука. Эти материалы, используемые в уплотнительных кольцах и других уплотнительных устройствах, обеспечивают отсутствие утечек в самолете даже в экстремальных условиях жары и холода.А когда случаются несчастные случаи, космические путешественники могут положиться на огнетушители на основе фторуглеродов, чтобы потушить пламя.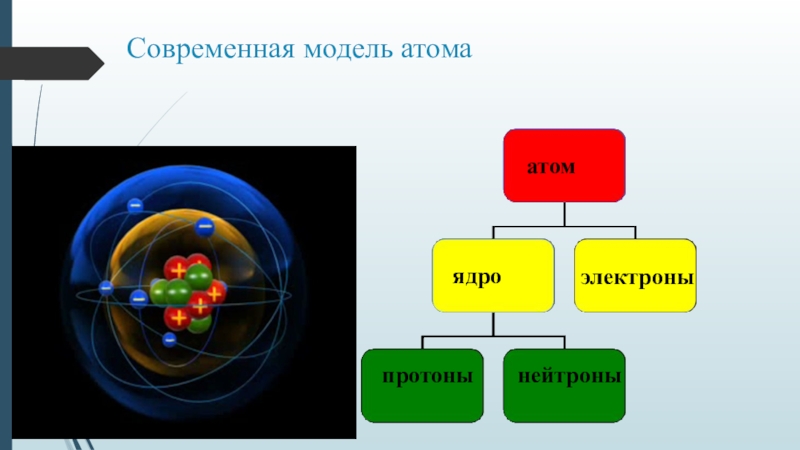
 Я Крис Смит, спасибо за внимание и до свидания.
Я Крис Смит, спасибо за внимание и до свидания.
