Газы — это… Что такое Газы?
агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Вещество в газообразном состоянии широко распространено в природе. Г. образуют атмосферу Земли, в значительных количествах содержатся в твёрдых земных породах, растворены в воде океанов, морей и рек. Солнце, звёзды, облака межзвёздного вещества состоят из Г. — нейтральных или ионизованных (плазмы). Встречающиеся в природных условиях Г. представляют собой, как правило, смеси химически индивидуальных Г.
Г. обладают рядом характерных свойств. Они полностью заполняют сосуд, в котором находятся, и принимают его форму. В отличие от твёрдых тел и жидкостей, объём Г. существенно зависит от давления и температуры. Коэффициент объёмного расширения Г. в обычных условиях (0—100°С) на два порядка выше, чем у жидкостей, и составляет в среднем 0,003663 град-1. В табл. приведены данные о физических свойствах наиболее распространённых Г.
В табл. приведены данные о физических свойствах наиболее распространённых Г.
Любое вещество можно перевести в газообразное состояние надлежащим подбором давления и температуры. Поэтому возможную область существования газообразного состояния графически удобно изобразить в переменных: давление р — температура Т (в р, Т-диаграмме, рис. 1). При температурах ниже критической Тк(см. Критическое состояние) эта область ограничена кривыми сублимации (См. Сублимация) (возгонки) / и парообразования (См.
Парообразование) II. Это означает, что при любом давлении ниже критического рк существует температура Т (см. рис. 1), определяемая кривой сублимации или парообразования, выше которой вещество становится газообразным. В состояниях на кривой 1 (ниже тройной точки (См. Тройная точка) Tp) газ находится в равновесии с твёрдым веществом (твёрдой фазой), а на кривой II (между тройной и критической точкой К.) — с жидкой фазой. Газ в этих состояниях обычно называют Паром вещества.
Тройная точка) Tp) газ находится в равновесии с твёрдым веществом (твёрдой фазой), а на кривой II (между тройной и критической точкой К.) — с жидкой фазой. Газ в этих состояниях обычно называют Паром вещества.
При температурах ниже Тк можно сконденсировать Г. — перевести его в др. агрегатное состояние (твёрдое или жидкое). При этом фазовое превращение Г. в жидкость или твёрдое тело происходит скачкообразно: весьма малое изменение давления приводит к конечному изменению ряда свойств вещества (например, плотности (См. Плотность), энтальпии (См. Энтальпия), теплоёмкости (См. Теплоёмкость) и др.). Процессы конденсации Г., особенно Сжижение газов, имеют важное техническое значение.
При Т > Тк граница газообразной области условна, поскольку при этих температурах фазовые превращения не происходят. В ряде случаев за условную границу между Г. и жидкостью при сверхкритических температурах и давлениях принимают критическую изохору (См. Изохора) вещества (кривую постоянной плотности или удельного объёма, см. рис. 1), в непосредственной близости от которой свойства вещества изменяются, хотя и не скачком, но особенно быстро.
Изохора) вещества (кривую постоянной плотности или удельного объёма, см. рис. 1), в непосредственной близости от которой свойства вещества изменяются, хотя и не скачком, но особенно быстро.
В связи с тем что область газового состояния очень обширна, свойства Г. при изменении температуры и давления могут меняться в широких пределах. Так, в нормальных условиях (при 0° С и атмосферном давлении) плотность Г. примерно в 1000 раз меньше плотности того же вещества в твёрдом или жидком состоянии. При комнатной температуре, но давлении, в 1017 раз меньшем атмосферного (предел, достигнутый современной вакуумной техникой (См. Вакуумная техника)), плотность Г. составляет около 10 -20 г/см3. В космических условиях плотность Г. может быть ещё на 10 порядков меньше (Газы10-30/см3).
С другой стороны, при высоких давлениях вещество, которое при сверхкритических температурах можно считать Г., обладает огромной плотностью (например, в центре некоторых звёзд Газы109г/см3). В зависимости от условий в широких пределах изменяются и др. свойства Г. — теплопроводность, вязкость и т. д.
В зависимости от условий в широких пределах изменяются и др. свойства Г. — теплопроводность, вязкость и т. д.
Молекулярно-кинетическая теория Г. Молекулярно-кинетическая теория рассматривает Г. как совокупность слабо взаимодействующих частиц (молекул или атомов), находящихся в непрерывном хаотическом (тепловом) движении. На основе этих простых представлений кинетической теории удаётся объяснить основные физические свойства Г., особенно полно — свойства разреженных Г.
У достаточно разреженных Г. средние расстояния между молекулами оказываются значительно больше радиуса действия межмолекулярных сил. Так, например, при нормальных условиях в 1 см3 Г. находитсяГазы 1019 молекул и среднее расстояние между ними составляет Газы 10-6см, или Газы 100 Å, тогда как межмолекулярное взаимодействие не существенно на расстояниях свыше 5—10 Å. Следовательно, в таких условиях молекулы взаимодействуют лишь при сближении на расстояние действия межмолекулярных сил. Такое сближение принято трактовать как столкновение молекул. Радиус действия межмолекулярных сил в рассмотренном примере в 10—20 раз меньше среднего расстояния между молекулами, так что общий объём, в котором эти силы могут сказываться (как бы «собственный объём» всех молекул), составляет 10-3—10-4 от полного объёма Г. Это позволяет считать собственный объём молекул Г. в нормальных условиях пренебрежимо малым и рассматривать молекулы как материальные точки. Газ, молекулы которого рассматриваются как не взаимодействующие друг с другом материальные точки, называется идеальным. При тепловом равновесии идеального Г. все направления движения его молекул равновероятны, а скорости распределены в соответствии с Максвелла распределением. На рис. 2 приведён график этого распределения для азота при температурах 20 и 500°С. Из графика видно, что подавляющее большинство молекул имеет близкие значения скорости (максимум кривой соответствует скорости наиболее вероятной при данной температуре), но существует также известная часть молекул с малыми и очень большими скоростями.
Такое сближение принято трактовать как столкновение молекул. Радиус действия межмолекулярных сил в рассмотренном примере в 10—20 раз меньше среднего расстояния между молекулами, так что общий объём, в котором эти силы могут сказываться (как бы «собственный объём» всех молекул), составляет 10-3—10-4 от полного объёма Г. Это позволяет считать собственный объём молекул Г. в нормальных условиях пренебрежимо малым и рассматривать молекулы как материальные точки. Газ, молекулы которого рассматриваются как не взаимодействующие друг с другом материальные точки, называется идеальным. При тепловом равновесии идеального Г. все направления движения его молекул равновероятны, а скорости распределены в соответствии с Максвелла распределением. На рис. 2 приведён график этого распределения для азота при температурах 20 и 500°С. Из графика видно, что подавляющее большинство молекул имеет близкие значения скорости (максимум кривой соответствует скорости наиболее вероятной при данной температуре), но существует также известная часть молекул с малыми и очень большими скоростями. При помощи максвелловского распределения может быть определена т. н. средняя квадратичная скорость молекул Т газа соотношением
При помощи максвелловского распределения может быть определена т. н. средняя квадратичная скорость молекул Т газа соотношением
Здесь k — Больцмана постоянная, m — масса молекулы. Уравнение (1) позволяет установить связь между средней кинетической энергией одной молекулы и температурой газа:
Эту зависимость часто рассматривают как молекулярно-кинетическое толкование температуры — температура есть мера кинетической энергии молекул.
Поскольку молекулы идеального Г. обладают лишь кинетической энергией, Внутренняя энергия такого Г. не зависит от занимаемого им объёма (закон Джоуля).
Молекулярно-кинетическая теория рассматривает давление Г. на стенки сосуда, в котором он находится, как воздействие ударов молекул, усреднённое по поверхности и времени. Количественно давление р определяется импульсом, передаваемым молекулами в единицу времени единице площади стенки:
где n — число молекул в единице объёма. Уравнения (2) и (3) позволяют записать Уравнение состояния идеального Г. в виде
Уравнения (2) и (3) позволяют записать Уравнение состояния идеального Г. в виде
p = nkT. (4)
pv = RT. (5)
Здесь R = kN — универсальная Газовая постоянная, v — объём, приходящийся на 1 моль. уравнение Клапейрона обобщает эмпирические газовые законы Бойля — Мариотта и Гей-Люссака (см. Бойля — Мариотта закон, Гей-Люссака законы). Из уравнения (5) следует также, что при одинаковых температуре и давлении идеальные Г., взятые в количестве 1 моля, имеют равные объёмы и в любом таком Г. в единице объёма содержится равное количество молекул (см. Авогадро закон).
В условиях теплового равновесия температура и давление Г. по всему его объёму одинаковы, молекулы движутся хаотично, в Г. нет упорядоченных потоков. Возникновение в Г. перепадов (градиентов) температуры или давления приводит к нарушению равновесия и переносу в направлении градиента энергии, массы или др. физических величин.
физических величин.
Кинетические свойства Г. — теплопроводность, диффузию, вязкость — молекулярно-кинетическая теория рассматривает с единой точки зрения: диффузию (См. Диффузия) как перенос молекулами массы, Теплопроводность как перенос ими энергии, Вязкость как перенос количества движения. Модель идеального Г. для анализа явлений переноса непригодна, ибо в этих процессах существенную роль играют столкновения молекул (при которых происходит передача какой-нибудь из переносимых величин, например энергии) и «размер» молекул (влияющий на частоту столкновений). Поэтому в простейшем случае явления переноса в Г. рассматриваются для разреженного Г., молекулы которого в первом приближении считаются упругими шариками с определённым диаметром σ, причём эти шарики взаимодействуют друг с другом только в момент соударения. В этом приближении диаметр молекулы связан простым соотношением с её средней длиной свободного пробега (См. Длина свободного пробега) l̅:
Размер l̅ существенно влияет на процессы переноса в разреженном Г. В частности, если характерный размер объёма, занимаемого Г., больше l̅, то теплопроводность и вязкость Г. не зависят от давления. Наоборот, когда l̅ больше характерного размера, теплопроводность и вязкость Г. с уменьшением давления (а значит, и числа столкновений) начинают падать. На этом явлении, в частности, основаны теплоизолирующие свойства сосудов с двойными стенками, воздух между которыми откачан (см. Дьюара сосуды).
В частности, если характерный размер объёма, занимаемого Г., больше l̅, то теплопроводность и вязкость Г. не зависят от давления. Наоборот, когда l̅ больше характерного размера, теплопроводность и вязкость Г. с уменьшением давления (а значит, и числа столкновений) начинают падать. На этом явлении, в частности, основаны теплоизолирующие свойства сосудов с двойными стенками, воздух между которыми откачан (см. Дьюара сосуды).
В более строгой молекулярной теории при анализе явлений переноса в разреженных газах учитывается взаимодействие молекул при любых расстояниях между ними. Характер взаимодействия определяется т. н. потенциалом взаимодействия (см. Межмолекулярное взаимодействие). Строгое рассмотрение динамики парных взаимодействий (столкновений) приводит к тому, что в формулах для расчёта коэффициентов переноса появляются т. н. интегралы столкновений, являющиеся функциями только приведённой температуры T* = kT/ε. Эта температура характеризует отношение кинетической энергии молекул (ГазыkT) к их потенциальной энергии (ε — глубина потенциальной ямы (См. Потенциальная яма) при данном потенциале взаимодействия). Интегралы столкновений учитывают то обстоятельство, что сталкивающиеся молекулы в зависимости от их кинетической энергии, а значит и температуры Г., могут сближаться на различные расстояния, т. е. как бы изменять свой эффективный размер.
Потенциальная яма) при данном потенциале взаимодействия). Интегралы столкновений учитывают то обстоятельство, что сталкивающиеся молекулы в зависимости от их кинетической энергии, а значит и температуры Г., могут сближаться на различные расстояния, т. е. как бы изменять свой эффективный размер.
Свойства реальных Г. При повышении плотности изменяются свойства Г., они перестают быть идеальными. Уравнение состояния (5) оказывается неприменимым, т. к. средние расстояния между молекулами Г. становятся сравнимыми с радиусом межмолекулярного взаимодействия. Для описания термодинамических свойств неидеальных, или, как их чаще называют, реальных, Г. пользуются различными уравнениями состояния, имеющими более или менее строгое теоретическое обоснование. Простейшим примером уравнения, которое качественно правильно описывает основные отличия реального Г. от идеального, служит уравнение Ван-дер-Ваальса. Оно учитывает, с одной стороны, существование сил притяжения между молекулами (их действие приводит к уменьшению давления Г. ), с другой стороны — сил отталкивания, препятствующих безграничному сжатию Г. (см. Ван-дер-Ваальса уравнение).
), с другой стороны — сил отталкивания, препятствующих безграничному сжатию Г. (см. Ван-дер-Ваальса уравнение).
Значения вириальных коэффициентов В, С и т. д. определяются соударениями молекул: парными (В), тройными (С) и более высокого порядка для последующих коэффициентов. Существенно, что вириальные коэффициенты являются функциями только температуры.
В Г. малой плотности наиболее вероятны парные столкновения молекул, т. е. для такого Г. в разложении (7) можно пренебречь всеми членами после члена с коэффициента В. В соответствии с температурным изменением В, при т. н. температуре Бойля ТВ (см. Бойля точка) В обращается в нуль, и умеренно плотный Г. ведёт себя как идеальный, т. е. подчиняется уравнению (5). Физически это означает, что при ТВ межмолекулярные силы притяжения и отталкивания практически компенсируют друг друга. Существование межмолекулярного взаимодействия в той или иной степени сказывается на всех свойствах реальных Г. Внутренняя энергия реального Г. оказывается зависящей от его объёма (от расстояний между молекулами), т. к. потенциальная энергия молекул определяется их взаимными расстояниями.
Внутренняя энергия реального Г. оказывается зависящей от его объёма (от расстояний между молекулами), т. к. потенциальная энергия молекул определяется их взаимными расстояниями.
С межмолекулярным взаимодействие связано также изменение температуры реального Г. при протекании его с мало постоянной скоростью через пористую перегородку (этот процесс называется Дросселированием). Мерой изменения температуры Г при дросселировании служит Джоуля — Томсона коэффициент который в зависимости от условий может быть положительным (охлаждение Г.), отрицательным (нагрев Г.) либо равным нулю при т. н. температуре инверсии (см. Джоуля — Томсона явление (См. Джоуля — Томсона эффект)). Эффект охлаждения Г при дросселировании широко применяется в технике как один из методов сжижения газов.
Внутреннее строение молекул Г. слабо влияет на их термические свойства (давление, температуру, плотность и связь между ними). Для этих свойств в первом приближении существенна только молекулярная масса Г. Напротив, калорические свойства Г. (теплоёмкость, энтропия и др.), а также его электрические и магнитные свойства существенно зависят от внутреннего строения молекул. Например, для расчёта (в первом приближении) теплоёмкости Г. при постоянном объёме cv необходимо знать число внутренних степеней свободы молекулы (т. е. число возможных внутренних движений) iвн. В соответствии с Равнораспределения законом классической статистической физики на каждую степень свободы молекулы Г. (поступательную, колебательную, вращательную) приходится энергия, равная 1/2 · kT. Отсюда теплоёмкость 1 моля
Напротив, калорические свойства Г. (теплоёмкость, энтропия и др.), а также его электрические и магнитные свойства существенно зависят от внутреннего строения молекул. Например, для расчёта (в первом приближении) теплоёмкости Г. при постоянном объёме cv необходимо знать число внутренних степеней свободы молекулы (т. е. число возможных внутренних движений) iвн. В соответствии с Равнораспределения законом классической статистической физики на каждую степень свободы молекулы Г. (поступательную, колебательную, вращательную) приходится энергия, равная 1/2 · kT. Отсюда теплоёмкость 1 моля
Для точного расчёта калорических свойств Г. необходимо знать уровни энергии молекулы, сведения о которых в большинстве случаев получают из анализа спектров Г. Для большого числа веществ в состоянии идеального Г. калорические свойства вычислены с высокой точностью и их значения представлены в виде таблиц до температур 10—22 тыс. градусов.
градусов.
Электрические свойства Г. связаны в первую очередь с возможностью ионизации (См. Ионизация) молекул или атомов, т. е. с появлением в Г. электрически заряженных частиц (ионов и электронов). При отсутствии заряженных ч
ГАЗ (состояние вещества) — это… Что такое ГАЗ (состояние вещества)?
ГА́З (франц. gaz, от греч. chaos — хаос), агрегатное состояние вещества, в котором составляющие его атомы и молекулы почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения.
Газообразное состояние вещества является самым распространенным состоянием вещества Вселенной. Солнце, звезды, облака межзвездного вещества, туманности, атмосферы планет и т. д. состоят из газов, или нейтральных, или ионизованных (плазмы (см. ПЛАЗМА)). Газы широко распространены в природе: они образуют атмосферу Земли, в значительных количествах содержатся в твердых земных породах, растворены в воде океанов, морей и рек. Встречающиеся в природных условиях газы представляют собой, как правило, смеси химически индивидуальных газов.
Встречающиеся в природных условиях газы представляют собой, как правило, смеси химически индивидуальных газов.
Газы равномерно заполняют доступное для них пространство, и в отличие от жидкостей и твердых тел, не образуют свободной поверхности. Они оказывают давление на ограничивающую заполняемое ими пространство оболочку. Плотность газов при нормальном давлении на насколько порядков меньше плотности жидкостей. В отличие от твердых тел и жидкостей, объем газов существенно зависит от давления и температуры.
Свойства большинства газов — прозрачность, бесцветность и легкость — затрудняло их изучение, поэтому физика и химия газов развивались медленно. Только в 17 в. было доказано, что воздух обладает весом (Э. Торричелли (см. ТОРРИЧЕЛЛИ Эванджелиста) и Б. Паскаль (см. ПАСКАЛЬ Блез)). Тогда же Я. ван Гельмонт (см. ГЕЛЬМОНТ Ян Баптист ван) ввел термин газы для обозначения воздухоподобных веществ. И только к середине 19 в.
были установлены основные закономерности, которым подчиняются газы. К ним относятся закон Бойля — Мариотта (см. БОЙЛЯ-МАРИОТТА ЗАКОН), закон Шарля (см. ШАРЛЯ ЗАКОН), закон Гей-Люссака (см. ГЕЙ-ЛЮССАКА ЗАКОНЫ), закон Авогадро (см. АВОГАДРО ЗАКОН).
К ним относятся закон Бойля — Мариотта (см. БОЙЛЯ-МАРИОТТА ЗАКОН), закон Шарля (см. ШАРЛЯ ЗАКОН), закон Гей-Люссака (см. ГЕЙ-ЛЮССАКА ЗАКОНЫ), закон Авогадро (см. АВОГАДРО ЗАКОН).
Наиболее полно изучены были свойства достаточно разряженных газов, в которых расстояния между молекулами при нормальных условиях порядка 10 нм, что значительно больше радиуса действия сил межмолекулярного взаимодействия (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ). Такой газ, молекулы которого рассматриваются как невзаимодействующие материальные точки, называется идеальным газом (см. ИДЕАЛЬНЫЙ ГАЗ). Идеальные газы строго подчиняются законам Бойля — Мариотта и Гей-Люссака. Практически все газы ведут себя как идеальные при не слишком высоких давлениях и не слишком низких температурах.
Уравнение pV=RT называют уравнением состояния (см. УРАВНЕНИЕ СОСТОЯНИЯ) идеального газа. Оно было получено в 1834 Б. Клапейроном (см. КЛАПЕЙРОН Эмиль) и обобщено Д. И. Менделеевым (см. МЕНДЕЛЕЕВ Дмитрий Иванович) для любой массы газа. Входящая в это уравнение газовая постоянная (см. ГАЗОВАЯ ПОСТОЯННАЯ) R равна 8,31 Дж/моль.град. Уравнение Клапейрона — Менделеева (см. КЛАПЕЙРОНА УРАВНЕНИЕ) справедливо только для идеальных газов. Для них выполняется также закон Дальтона (см. ДАЛЬТОНА ЗАКОНЫ).
И. Менделеевым (см. МЕНДЕЛЕЕВ Дмитрий Иванович) для любой массы газа. Входящая в это уравнение газовая постоянная (см. ГАЗОВАЯ ПОСТОЯННАЯ) R равна 8,31 Дж/моль.град. Уравнение Клапейрона — Менделеева (см. КЛАПЕЙРОНА УРАВНЕНИЕ) справедливо только для идеальных газов. Для них выполняется также закон Дальтона (см. ДАЛЬТОНА ЗАКОНЫ).
Молекулярно-кинетическая теория газов рассматривает газы как совокупность слабо взаимодействующих частиц (молекул или атомов), находящихся в непрерывном хаотическом (тепловом) движении. На основе этих простых представлений кинетической теории удается объяснить основные физические свойства газов, особенно полно — свойства разреженных газов. У достаточно разреженных газов средние расстояния между молекулами оказываются значительно больше радиуса действия межмолекулярных сил. Так, например, при нормальных условиях в 1 см3 газа находится ГАЗ (состояние вещества) 1019 молекул и среднее расстояние между ними составляет ГАЗ (состояние вещества) 10-6 см. С точки зрения молекулярно-кинетической теории давление газов является результатом многочисленных ударов молекул газа о стенки сосуда, усредненных по времени и по стенкам сосуда. При нормальных условиях и макроскопических размерах сосуда число ударов об 1см2 поверхности составляет примерно 1024 в секунду.
С точки зрения молекулярно-кинетической теории давление газов является результатом многочисленных ударов молекул газа о стенки сосуда, усредненных по времени и по стенкам сосуда. При нормальных условиях и макроскопических размерах сосуда число ударов об 1см2 поверхности составляет примерно 1024 в секунду.
Внутренняя энергия идеального газа (среднее значение полной энергии всех его частиц) зависит только от его температуры. Внутренняя энергия одноатомного газа, имеющего 3 поступательные степени свободы и состоящего из N атомов, равна:
Е = (3/2)kTN, где Т — абсолютная температура, а k — постоянная Больцмана (см. БОЛЬЦМАНА ПОСТОЯННАЯ).
При повышении плотности газа его свойства перестают быть идеальными, процессы столкновения начинают играть все большую роль и размерами молекул и их взаимодействия пренебречь уже нельзя. Такой газ называют реальный газ (см. РЕАЛЬНЫЙ ГАЗ). Поведение реальных газов в зависимости от их температуры, давления, физической природы в большей или меньшей степени отличаются от законов идеальных газов. Одним из основных уравнений, описывающих свойства реального газа, является уравнения Ван-дер-Ваальса (см. ВАН-ДЕР-ВААЛЬСА УРАВНЕНИЕ), при выводе которого были учтены две поправки: на силы притяжения между молекулами и на их размер.
Одним из основных уравнений, описывающих свойства реального газа, является уравнения Ван-дер-Ваальса (см. ВАН-ДЕР-ВААЛЬСА УРАВНЕНИЕ), при выводе которого были учтены две поправки: на силы притяжения между молекулами и на их размер.
Любое вещество можно перевести в газообразное состояние соответствующим подбором давления и температуры. Поэтому возможную область существования газообразного состояния графически изображают в переменных: давление р — температура Т (на р-Т-диаграмме). Существует критическая температура Тк, ниже которой эта область ограничена кривыми сублимации (возгонки) и парообразования, т. е. при любом давлении ниже критического рк существует температура Т, определяемая кривой сублимации или парообразования, выше которой вещество становится газообразным. При температурах ниже Тк можно сконденсировать газ — перевести его в другое агрегатное состояние (твердое или жидкое). При этом фазовое превращение газа в жидкость или твердое тело происходит скачкообразно: незначительное изменение давления приводит к изменению ряда свойств вещества (например, плотнޑQج энтальпии (см. ЭНТАЛЬПИЯ), теплоемкости и др.). Процессы конденсации газов, особенно сжижение газов (см. СЖИЖЕНИЕ ГАЗОВ), имеют важное техническое значение.
ЭНТАЛЬПИЯ), теплоемкости и др.). Процессы конденсации газов, особенно сжижение газов (см. СЖИЖЕНИЕ ГАЗОВ), имеют важное техническое значение.
Область газового состояния вещества очень обширна, и свойства газов при изменении температуры и давления могут меняться в широких пределах. Так, в нормальных условиях (при 0°С и атмосферном давлении) плотность газа примерно в 1000 раз меньше плотности того же вещества в твердом или жидком состоянии. С другой стороны, при высоких давлениях вещество, которое при сверхкритических температурах можно считать газом, обладает огромной плотностью (например, в центре некоторых звезд ГАЗ (состояние вещества)109 г/см3).
Внутреннее строение молекул газа слабо влияет на давление, температуру, плотность и связь между ними, но существенным образом влияет на его электрические и магнитные свойства. Калорические свойства газов, такие как теплоемкость, энтропия и т. д., также зависят от внутреннего строения молекул.
Электрические свойства газов определяются возможностью ионизации молекул или атомов, т. е. появлением в газе электрически заряженных частиц (ионов и электронов). При отсутствии заряженных частиц газы являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность газов увеличивается. При температурах выше нескольких тысяч К газ частично ионизуется и превращается в плазму.
е. появлением в газе электрически заряженных частиц (ионов и электронов). При отсутствии заряженных частиц газы являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность газов увеличивается. При температурах выше нескольких тысяч К газ частично ионизуется и превращается в плазму.
По магнитным свойствам газы делятся на диамагнитные (инертные газы, СО2, Н2О) и парамагнитные (О2). Молекулы диамагнитных газов не имеют постоянного магнитного момента и приобретают его лишь под действием магнитного поля. Те газы, молекулы которых обладают постоянным магнитным моментом, ведут себя как парамагнетики.
В современной физике газами называют не только одно из агрегатных состояний вещества. К газам с особыми свойствами относят, например, совокупность свободных электронов в металле (электронный газ), фононов в кристалле (фононный газ). Свойства таких газовых частиц описывает квантовая статистика (см. КВАНТОВАЯ СТАТИСТИКА).
Углекислый газ, свойства, получение и применение
Углекислый газ, свойства, получение и применение.
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Углекислый газ, формула, молекула, строение, состав, вещество
Физические свойства углекислого газа. Сухой лёд
Получение углекислого газа
Химические свойства углекислого газа. Химические реакции (уравнения) углекислого газа
Применение углекислого газа
Углекислый газ, формула, молекула, строение, состав, вещество:
Углекислый газ (диоксид углерода, двуокись углерода, углекислота, оксид углерода (IV), угольный ангидрид) – бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Химическая формула углекислого газа CO2.
Строение молекулы углекислого газа, структурная формула углекислого газа:
Углекислый газ тяжелее воздуха приблизительно в 1,5 раза. Его плотность при нормальных условиях составляет 1,98 кг/м3, по отношении к воздуху – 1,524. Поэтому скапливается в низких непроветриваемых местах.
Его плотность при нормальных условиях составляет 1,98 кг/м3, по отношении к воздуху – 1,524. Поэтому скапливается в низких непроветриваемых местах.
Концентрация углекислого газа в воздухе (в атмосфере Земли) составляет в среднем 0,046 % (по массе) и 0,0314 % (по объему).
Углекислый газ вырабатывается в органах и тканях человека образуется в качестве одного из конечных продуктов метаболизма. Он переносится от тканей по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и содержание его мало в артериальной крови. В выдыхаемом человеком воздухе содержится около 4,5% диоксида углерода, что в 60-110 раз больше, чем во вдыхаемом. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Углекислый газ растворяется в воде. В 100 граммах воды растворяется 0,3803 грамма CO2 при 16 °C, 0,3369 грамма CO2 – при 20 °C, 0,2515 грамма CO2 – при 30 °C. Растворяясь в воде, образует угольную кислоту Н2CO3. Растворим также в ацетоне, бензоле, метаноле и этаноле.
Растворяясь в воде, образует угольную кислоту Н2CO3. Растворим также в ацетоне, бензоле, метаноле и этаноле.
Термически устойчив при температурах менее 1000 °C. При температуре 1000 °C восстанавливается углем до оксида углерода (II).
При нормальном атмосферном давлении диоксид углерода не существует в жидком состоянии, существует только в твердом или газообразном состоянии. Твердая двуокись углерода при повышении температуры не плавится, а переходит (возгоняется) непосредственно из твёрдого состояния в газообразное. Твёрдую двуокись углерода также называют сухим льдом. Внешний вид сухого льда напоминает обычный лед, снегоподобную массу. При сублимации сухой лед поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
Под давлением 35 000 атм. твердая углекислота становится проводником электрического тока.
Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм. ) газ сгущается в бесцветную жидкость. При нормальных условиях (20 °С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. Хранят и транспортируют углекислый газ, как правило, в жидком состоянии
) газ сгущается в бесцветную жидкость. При нормальных условиях (20 °С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. Хранят и транспортируют углекислый газ, как правило, в жидком состоянии
Двуокись углерода негорюча, но в ее атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных – магния, кальция, бария.
Двуокись углерода нетоксична, невзрывоопасна.
Предельно допустимая концентрация двуокиси углерода в воздухе рабочей зоны не установлена, при оценке этой концентрации можно ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5% (об.) или 9,2 г/м (см. ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
По степени воздействия на организм человека двуокись углерода относится к 4-му классу опасности по ГОСТ 12.1.007-76.
При концентрациях более 5% (92 г/м) двуокись углерода оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха в полтора раза и может накапливаться в слабопроветриваемых помещениях у пола и в приямках, а также во внутренних объемах оборудования для получения, хранения и транспортирования газообразной, жидкой и твердой двуокиси углерода. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Углекислый газ образуется при гниении и горении органических веществ, в результате вулканической деятельности. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Искусственными источниками образования углекислого газа являются промышленные выбросы и выхлопные газы автомобильного транспорта.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего участвует в процессе глобального потепления.
Физические свойства углекислого газа:
| Наименование параметра: | Значение: |
| Химическая формула | CO2 |
| Синонимы и названия иностранном языке | углерода двуокись (рус. ) )углерода диоксид (рус.) угольный ангидрид (рус.) оксид углерода (IV) carbon dioxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветный газ |
| Цвет | бесцветный |
| Вкус | кисловатый вкус |
| Запах | почти без запаха (в больших концентрациях с кисловатым «содовым» запахом) |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (состояние вещества – твердое вещество, при -79 °C и атмосферном давлении 1 атм.), кг/м3 | 1561 |
| Плотность (состояние вещества – твердое вещество, при -79 °C и атмосферном давлении 1 атм.), г/см3 | 1,561 |
| Плотность (состояние вещества – жидкость, при -60 °C и атмосферном давлении 1 атм.), кг/м3 | 1190 |
Плотность (состояние вещества – жидкость, при -60 °C и атмосферном давлении 1 атм. ), г/см3 ), г/см3 | 1,19 |
| Плотность (состояние вещества – жидкость, при -37 °C и атмосферном давлении 1 атм.), кг/м3 | 1101 |
| Плотность (состояние вещества – жидкость, при -37 °C и атмосферном давлении 1 атм.), г/см3 | 1,101 |
| Плотность (состояние вещества – жидкость, при 0 °C и атмосферном давлении 35,5 атм.), кг/м3 | 925 |
| Плотность (состояние вещества – жидкость, при 0 °C и атмосферном давлении 35,5 атм.), г/см3 | 0,925 |
| Плотность (состояние вещества – газ, при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 1,9768 |
| Плотность (состояние вещества – газ, при 0 °C и атмосферном давлении 1 атм.), г/см3 | 0,0019768 |
| Температура сублимации (возгонки), °C | -78,5 |
| Критическая температура*, °C | 31 |
| Критическое давление, МПа | 7,387 |
| Критический удельный объём, м3/кг | 0,468 |
| Критическая точка | 31 °C, 7,38 МПа |
| Тройная точка | −56,6 °C, 0,52 МПа |
| Молярная масса, г/моль | 44,01 |
| Растворимость в воде, г/100 г | 0,3803 при 16 °C, 0,3369 при 20 °C, 0,2515 при 30 °C |
| Теплопроводность, Вт/(м·K) | 0,0166 |
| Удельная теплоемкость, Дж/(кг·К) | 849 |
| Удельная теплота испарения, кДж/кг | 379,5 |
| Удельная теплота плавления, кДж/кг | 205 |
| Стандартная энтальпия образования ΔH (при 298 К, для состояния вещества – газ), кДж/моль | -393,51 |
| Стандартная энергия Гиббса образования ΔG (при 298 К, для состояния вещества – газ), кДж/моль | -394,38 |
| Стандартная энтропия вещества S (при 298 К, для состояния вещества – газ) | 213,68 |
| Стандартная мольная теплоемкость Cp (298 К, для состояния вещества – газ), Дж/(моль·K) | 37,11 |
| Энтальпия плавления ΔHпл, кДж/моль | 8,37 |
| Энтальпия возгонки ΔHвозг, кДж/моль | 25,23 |
| Скорость звука в веществе (при 20°C, состояние среды – газ), м/с | 274,6 |
Давление паров, мм. рт.ст. рт.ст. | 0,000001 (при -186,4°C), 0,00001 (при -180,7°C), 0,0001 (при -174,3°C), 0,001 (при -166,8°C), 0,01 (при -158°C), 2,31 (при -130°C), 9,81 (при -120°C), 34,63 (при -110°C), 104,81 (при -100°C), 279,5 (при -90°C), 672,2 (при -80°C), 1486,1 (при -70°C), 3073,1 (при -60°C), 5127,8 (при -50°C), 7545 (при -40°C), 10718 (при -30°C), 14781 (при -20°C), 19872 (при -10°C), 26142 (при 0°C), 33763 (при 10°C), 42959 (при 20°C), 54086 (при 30°C) |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Получение углекислого газа:
В промышленности углекислый газ образуется в дымовых газах при сжигании различных органических и неорганических веществ или как побочный продукт химических процессов, например, при разложении природных карбонатов (доломита, известняка). Также углекислый газ как побочный продукт получают на установках разделения воздуха с целью получения чистого кислорода, азота и аргона.
Также углекислый газ как побочный продукт получают на установках разделения воздуха с целью получения чистого кислорода, азота и аргона.
В лабораторных условиях углекислый газ получают, например, в результате следующих химических реакций:
1. взаимодействия карбоната кальция и азотной кислоты:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O,
2. в результате взаимодействия карбоната кальция с другими минеральными кислотами,
3. взаимодействия пищевой соды с лимонной кислотой или с кислым лимонным соком,
4. реакции горения углерода:
С + O2 → CO2.
Химические свойства углекислого газа. Химические реакции (уравнения) углекислого газа:
Диоксид углерода относится к кислотным оксидам, поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия оксида углерода (IV) и водорода:
CO2 + 4H2 → CH4 + 2H2O (t ~ 200 °C, kat = Cu2O).
В результате реакции образуются метан и вода.
2. реакция взаимодействия оксида углерода (IV) и углерода:
CO2 + C ⇄ 2CO (t = 700-1000 °C).
В результате реакции образуется оксид углерода (II). Реакция протекает при взаимодействии углекислого газа с раскаленными углями.
3. реакция взаимодействия оксида углерода (IV) и магния:
CO2 + 2Mg → 2MgO + C (t ~ 500 °C).
В результате реакции образуются оксид магния и углерод.
4. реакция взаимодействия оксида углерода (IV) и гафния:
Hf + CO2 → HfC + HfO2 (t = 800-1000 °C).
В результате реакции образуются карбид гафния и оксид гафния.
5. реакция взаимодействия оксида углерода (IV) и германия:
Ge + CO2 → GeO + CO (t = 700-900 °C).
В результате реакции образуются оксид германия и оксид углерода (II).
6. реакция взаимодействия оксида углерода (IV) и цинка:
Zn + CO2 → ZnO + CO (t = 800-950 °C).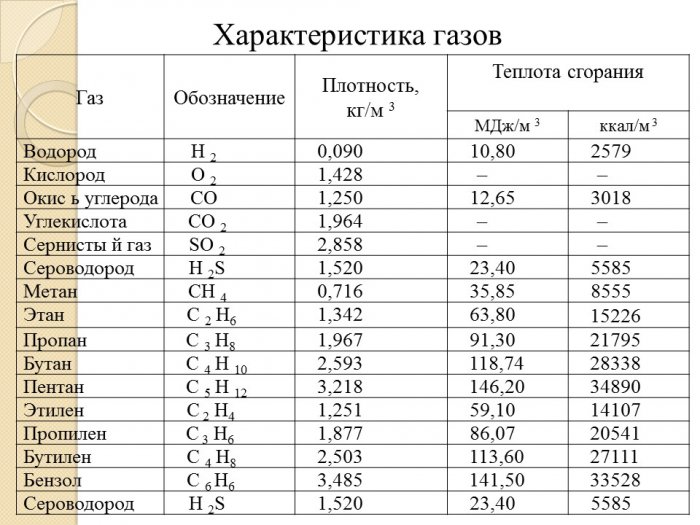
В результате реакции образуются оксид цинка и оксид углерода (II).
7. реакция взаимодействия оксида углерода (IV) и индия:
2In + CO2 → In2O + CO (t ~ 850 °C).
В результате реакции образуются оксид индия и оксид углерода (II).
8. реакция взаимодействия оксида углерода (IV) и циркония:
2Zr + CO2 → ZrC + ZrO2 (t = 800-100 °C).
В результате реакции образуются карбид циркония и оксид циркония.
9. реакция взаимодействия оксида углерода (IV) и вольфрама:
W + 2CO2 → WO2 + 2CO (t ~ 1200 °C).
В результате реакции образуются оксид вольфрама и оксид углерода (II).
10. реакция взаимодействия оксида углерода (IV) и оксида лития:
Li2O + CO2 → Li2CO3.
В результате реакции образуется карбонат лития.
11. реакция взаимодействия оксида углерода (IV) и оксида натрия:
Na2O + CO2 → Na2CO3 (t = 450-550 °C).
В результате реакции образуется карбонат натрия.
12. реакция взаимодействия оксида углерода (IV) и оксида калия:
K2O + CO2 → K2CO3 (t ~ 400 °C).
В результате реакции образуется карбонат калия.
13. реакция взаимодействия оксида углерода (IV) и оксида бария:
BaO + CO2 → BaCO3.
В результате реакции образуется карбонат бария.
14. реакция взаимодействия оксида углерода (IV) и оксида кальция:
CaO + CO2 → CaCO3.
В результате реакции образуется карбонат кальция.
15. реакция взаимодействия карбоната кальция, оксида углерода (IV) и воды:
CaCO3 + CO2 + H2O → Ca(HCO3)2.
В результате реакции образуется гидрокарбонат кальция.
16. реакция взаимодействия оксида углерода (IV) и оксида магния:
MgO + CO2 → MgCO3.
В результате реакции образуется карбонат магния.
17. реакция взаимодействия оксида углерода (IV) и оксида кремния (II):
SiO + CO2 → SiO2 + CO (t ~ 500 °C).
В результате реакции образуются оксид кремния (IV) и оксид углерода (II).
18. реакция взаимодействия оксида углерода (IV) и воды:
CO2 + H2O ⇄ H2CO3.
В результате реакции образуется угольная кислота.
19. реакция взаимодействия оксида углерода (IV) и гидроксида лития:
2LiOH + CO2 → Li2CO3 + H2O.
В результате реакции образуются карбонат лития и вода. В ходе реакции используется концентрированный раствор гидроксида лития.
20. реакция взаимодействия оксида углерода (IV) и гидроксида калия:
KOH + CO2 → KHCO3,
2KOH + CO2 → K2CO3 + H2O.
В первом случае в результате реакции образуются гидрокарбонат калия, во втором случае – карбонат калия и вода. Реакция протекает в первом случае в этаноле и используется разбавленный раствор гидроксида калия, во втором используется концентрированный раствор гидроксида калия.
21. реакция взаимодействия оксида углерода (IV) и гидроксида натрия:
NaOH + CO2 → NaHCO3,
2NaOH + CO2 → Na2CO3 + H2O.
В первом случае в результате реакции образуются гидрокарбонат натрия, во втором – карбонат натрия и вода. В ходе первой реакции используется разбавленный раствор гидроксида натрия, в ходе второй – концентрированный раствор гидроксида натрия.
22. реакция взаимодействия оксида углерода (IV) и гидроксида кальция:
Ca(OH)2 + CO2 → CaCO3 + H2O.
В результате реакции образуются карбонат кальция и вода.
23. реакция взаимодействия оксида углерода (IV) и гидроксида бария:
реакция взаимодействия оксида углерода (IV) и гидроксида бария:
Ba(OH)2 + CO2 → BaCO3 + H2O.
В результате реакции образуются карбонат бария и вода.
24. реакция взаимодействия оксида углерода (IV) и метана:
CH4 + CO2 → 2CO + 2H2 (t = 800-900 °C, kat = NiO, нанесенный на Al2O3).
В результате реакции образуются оксид углерода (II) и вода.
25. реакция термического разложения оксида углерода (IV):
2CO2 → 2CO + O2 (t > 2000 °C).
В результате реакции образуются оксид углерода (II) и кислород.
26. реакция фотосинтеза:
6CO2 + 6H2O → C6H12O6 + 6O2 (hv, kat = хлорофилл).
В результате реакции образуются глюкоза и кислород.
Применение углекислого газа:
Углекислый газ используется во многих отраслях промышленности и быту:
– как пищевая добавка Е290 в качестве разрыхлителя в пищевом производстве и консерванта в алкогольных и безалкогольных газированных напитках, а также для газирования лимонада, газированной воды и других напитков;
– в системах пожаротушения и в огнетушителях;
– для создания защитной среды при сварке металлов;
– для охлаждения, замораживания и хранения пищевых продуктов при прямом и косвенном контакте с сухим льдом;
– для сушки литейных форм;
– в качестве активной среды углекислотного лазера.
Примечание: © Фото https://www.pexels.com, https://pixabay.com.
Найти что-нибудь еще?
Похожие записи:
карта сайта
Коэффициент востребованности
1 593
ГАЗ | Энциклопедия Кругосвет
Содержание статьи
ГАЗ – одно из агрегатных состояний вещества, в котором составляющие его частицы (атомы, молекулы) находятся на значительных расстояниях друг от друга и находятся в свободном движении. В отличие от жидкости и твердого тела, где молекулы находятся на близких расстояниях и связаны друг с другом значительными по величине силами притяжения и отталкивания, взаимодействие молекул в газе проявляется лишь в короткие моменты их сближения (столкновения). При этом происходит резкое изменение величины и направления скорости движения сталкивающихся частиц.
В отличие от жидкости и твердого тела, где молекулы находятся на близких расстояниях и связаны друг с другом значительными по величине силами притяжения и отталкивания, взаимодействие молекул в газе проявляется лишь в короткие моменты их сближения (столкновения). При этом происходит резкое изменение величины и направления скорости движения сталкивающихся частиц.
Название «газ» происходит от греческого слова «haos» и было введено Ван Гельмонтом еще в начале 17 в., оно хорошо отражает истинный характер движения частиц в газе, отличающегося полной беспорядочностью, хаотичностью. В отличие, например, от жидкости газы не образуют свободной поверхности и равномерно заполняют весь доступный им объем.
Газообразное состояние, если причислять к нему и ионизованные газы, является самым распространенным состоянием вещества во Вселенной (атмосферы планет, звезды, туманности, межзвездное вещество и т.д.).
Идеальный газ.
Законы, определяющие свойства и поведение газа, легче всего формулируются для случая так называемого идеального газа или газа относительно низкой плотности. В таком газе среднее расстояние между молекулами предполагается большим по сравнению с радиусом действия межмолекулярных сил. Порядок величины этого среднего расстояния можно определить как , где – n число частиц в единице объема или числовая плотность газа. Если пользоваться приближенной моделью взаимодействия частиц газа, в которой молекулы представляются твердыми упругими шариками диаметром d, то условие идеальности газа записывается как nd3 d = 3·10–8 см. Это означает, что газ является идеальным, если n 22 см–3. Такому условию заведомо отвечает любой газ (например, воздух), находящийся при нормальных условиях (давление p = 1атм, температура T = 273K), поскольку при этих условиях число молекул в одном кубическом сантиметре газа равно 2,69·1019см–3 (число Лошмидта). При фиксированном давлении газа условие идеальности удовлетворяется тем лучше, чем выше температура газа, поскольку плотность газа, как это следует из уравнения состояния идеального газа в этом случае обратно пропорциональна его температуре.
В таком газе среднее расстояние между молекулами предполагается большим по сравнению с радиусом действия межмолекулярных сил. Порядок величины этого среднего расстояния можно определить как , где – n число частиц в единице объема или числовая плотность газа. Если пользоваться приближенной моделью взаимодействия частиц газа, в которой молекулы представляются твердыми упругими шариками диаметром d, то условие идеальности газа записывается как nd3 d = 3·10–8 см. Это означает, что газ является идеальным, если n 22 см–3. Такому условию заведомо отвечает любой газ (например, воздух), находящийся при нормальных условиях (давление p = 1атм, температура T = 273K), поскольку при этих условиях число молекул в одном кубическом сантиметре газа равно 2,69·1019см–3 (число Лошмидта). При фиксированном давлении газа условие идеальности удовлетворяется тем лучше, чем выше температура газа, поскольку плотность газа, как это следует из уравнения состояния идеального газа в этом случае обратно пропорциональна его температуре.
Законы идеального газа были в свое время открыты опытным путем. Так еще в 17 в. был установлен закон Бойля – Мариотта
(1) pV = const,
(2) из которого следует, что изменение объема газа V при постоянной температуре T сопровождается таким изменением его давления p, что их произведение остается постоянной величиной.
Если газ находится в условиях, когда постоянным сохраняется его давление, но меняется температура (такие условия можно осуществить, например, поместив газ в сосуд, закрытый подвижным поршнем), то выполняется закон Гей-Люссака
(2) ,
т.е. при фиксированном давлении отношение объема газа к его температуре является постоянным. Оба указанных закона объединяются в универсальное уравнение Клапейрона – Менделеева, которое называется также уравнением состояния идеального газа
(3) pV = nRT.
Здесь n – число молей газа, R = 8,317 Дж/моль·K – универсальная газовая постоянная. Молем любого вещества называется такое его количество, масса которого в граммах равна атомной или молекулярной массе вещества М. В свою очередь, молекулярной массой вещества называется отношение массы молекулы этого вещества к так называемой атомной единице массы (а.е.м.), в качестве которой принимается масса равная 1/12 массы атома 12С (изотопа углерода с массовым числом 12) (см. ИЗОТОПЫ). При этом 1 а.е.м. = 1,66·10–27 кг.
Молем любого вещества называется такое его количество, масса которого в граммах равна атомной или молекулярной массе вещества М. В свою очередь, молекулярной массой вещества называется отношение массы молекулы этого вещества к так называемой атомной единице массы (а.е.м.), в качестве которой принимается масса равная 1/12 массы атома 12С (изотопа углерода с массовым числом 12) (см. ИЗОТОПЫ). При этом 1 а.е.м. = 1,66·10–27 кг.
Один моль любого вещества содержит одно и то же число молекул, равное числу Авогадро моль–1. Число молей данного количества вещества определяется отношением массы вещества m к его молекулярной массе, т.е. n = m/M .
Используя соотношение n = N/V = nNA /V, уравнение состояния можно представить в виде, связывающем между собой давление, плотность и температуру
(4) p = nkT,
где вводится величина
k = R/NA = 1,38·10–23 Дж/K , которая носит название постоянной Больцмана.
Уравнение состояния в форме (3) или (4) может быть обосновано также методами кинетической теории газов, что позволяет, в частности, придать более отчетливый физический смысл постоянной Больцмана k (см. МОЛЕКУЛЯРНО- КИНЕТИЧЕСКАЯ ТЕОРИЯ).
Из уравнения состояния идеального газа непосредственно следует закон Авогадро: при одинаковых давлениях и температурах в равных объемах любого газа содержится одинаковое число молекул. Из этого закона вытекает и обратное утверждение: различные газы, содержащие одинаковое число молекул, при одинаковых давлениях и температурах занимают одинаковый объем. В частности, при нормальных условиях моль любого газа занимает объем
м3/моль
Исходя из этого значения легко определить число Лошмидта
2,69·1025 м–3 = 2,69·10–19 см–3
Другой закон, относящийся к смесям идеальных газов, носит название закона Дальтона: давление смеси газов равно сумме парциальных давлений ее компонентов. Парциальным давлением какого либо газа (компонента газовой смеси) называется при этом давление, которое оказывал бы этот газ, если бы он один занимал весь объем, занимаемый смесью.
Парциальным давлением какого либо газа (компонента газовой смеси) называется при этом давление, которое оказывал бы этот газ, если бы он один занимал весь объем, занимаемый смесью.
Средняя кинетическая энергия теплового движения молекул.
Уравнение состояния идеального газа в форме (3) или (4) может быть обосновано и методами кинетической теории газов. На основе кинетического подхода сравнительно просто выводится выражение для давления идеального газа в сосуде, которое получается как результат усреднения импульсов молекул, передаваемых стенке сосуда при многочисленных соударениях молекул со стенкой. Величина получаемого при этом давления определяется как
(5) ,
Где бv 2с – среднее значение квадрата скорости молекул, m – масса молекулы.
Средняя кинетическая энергия молекул газа (в расчете на одну молекулу) определяется выражением
(6)
Кинетическая энергия поступательного движения атомов и молекул, усредненная по огромному числу беспорядочно движущихся частиц, является мерилом того, что называется температурой. Если температура T измеряется в градусах Кельвина (К), то связь ее с Ek дается соотношением
Если температура T измеряется в градусах Кельвина (К), то связь ее с Ek дается соотношением
(7)
Это соотношение позволяет, в частности, придать более отчетливый физический смысл постоянной Больцмана
k = 1,38·10–23 Дж/K, которая фaктически является переводным коэффициентом, определяющим, какая часть джоуля содержится в градусе.
Используя (6) и (7), находим, что (1/3)m бv2с = kT. Подстановка этого соотношения в (5) приводит к уравнению состояния идеального газа в форме
p = nkT, которое уже было получено из уравнения Клапейрона – Менделеева (3).
Из уравнений (6) и (7) можно определить значение средне-квадратичной скорости молекул
(8)
Расчеты по этой формуле при Т = 273К дают для молекулярного водорода бvскв = 1838 м/с, для азота – 493 м/с, для кислорода – 461 м/с и т.д.
Распределение молекул по скоростям.
Приведенные выше значения бvскв позволяют составить представление о порядке величины среднего значения тепловых скоростей молекул для различных газов. Разумеется, не все молекулы движутся с одинаковыми скоростями. Среди них есть определенная доля молекул с малыми значениями скорости и, наоборот, некоторое число достаточно быстрых молекул. Однако, большая часть молекул обладает скоростями, значения которых группируются относительно наиболее вероятной при данной температуре величины, которая не очень существенно отличается от значений, даваемых формулой (8). Такое распределение молекул по скоростям устанавливается в газе в результате обмена импульсом и энергией при многочисленных столкновениях молекул между собой и со стенками сосуда, Вид этого универсального (не меняющегося во времени) распределения молекул по скоростям, соответствующего состоянию теплового равновесия в газе, был впервые теоретически установлен Максвеллом. С помощью распределения Максвелла определяется относительная доля молекул, абсолютные скорости которых лежат в некотором узком интервале значений dv.
(9)
Вид распределения dn/ndv, описываемого выражением (9), для двух различных температур (T2 > T1) представлен на рис.1.
С помощью максвелловского распределения можно вычислить такие важные характеристики газа как средняя, среднеквадратичная и наиболее вероятная скорость теплового движения молекул, рассчитать среднее число столкновений молекул со стенкой сосуда и т.д. Средняя тепловая скорость молекул, например, которая представляет собой фактически средне-арифметическую скорость, определяется при этом формулой
(10)
Наиболее вероятная скорость молекул, соответствующая максимуму кривых, представленных на рис. 1, определена как
(11)
Значения скоростей, определяемых формулами (8), (10) и (11), оказываются близкими по величине. При этом
(12) бvс = 0,93 бvскв, nв = 0,82бvскв
Внутренняя энергия и теплоемкость идеального газа.
Чтобы изменить состояние некоторого заданного объема газа (например, нагреть или охладить его), надо либо совершить над ним механическую работу, либо передать ему некоторое количество тепла за счет контакта с другими телами. Количественно эти изменения выражаются с помощью первого начала термодинамики, которое отражает важнейший закон природы: сохранение механической и тепловой энергии тела. Формулировку первого начала для бесконечно малого квазистатического процесса можно представить в виде (см. ТЕРМОДИНАМИКА).
(13) dQ = dU + dA
Здесь dQ – элементарное количество тепла, передаваемое телу, dU – изменение его внутренней энергии,
dA = pdV – элементарная работа, совершаемая газом при изменении его объема (эта работа равна с обратным знаком элементарной работе, совершаемой внешними силами над газом). Обозначение dU соответствует полному дифференциалу от переменной U. Это означает, что приращение внутренней энергии при переходе газа из некоторого состояния 1 в состояние 2 можно представить в виде интеграла
Обозначения dQ и dA означают, что в общем случае интеграл от них нельзя представить в виде разности соответствующих значений в конечном и начальном состоянии газа, поэтому интегрирование (13) по всему процессу приводит к соотношению
Q = U2 – U1 + A
Вводится понятие теплоемкости газа как количества тепла, которое нужно сообщить газу, чтобы повысить его температуру на один градус Кельвина. Тогда по определению
Тогда по определению
Далее под С подразумевается теплоемкость, отнесенная к одному молю газа, или молярная теплоемкость. Внутренняя энергия U также определена для одного моля газа. Если газ нагревается при постоянном объеме (изохорический процесс), т.е. совершаемая газом работа равна нулю, то
(14)
Если состояние газа меняется при постоянном давлении (изобарический процесс), то в соответствии с (13)
(15)
Использование уравнение состояния идеального газа (3) при v = 1 дает
Следовательно, молярные теплоемкости идеального газа при постоянном давлении и при постоянном объеме связаны соотношением
(16) Cp = Cv + R
Внутренняя энергия газа, в общем случае, состоит из кинетической энергии поступательного и вращательного движения молекул, энергии внутреннего (колебательного) движения атомов в молекуле, а также потенциальной энергии взаимодействия молекул. В случае идеального газа вкладом последнего слагаемого в полную энергию можно пренебрегать.
В случае идеального газа вкладом последнего слагаемого в полную энергию можно пренебрегать.
В классической статистической механике доказывается так называемая теорема о равномерном распределении кинетической энергии по степеням свободы молекул, согласно которой на каждую степень свободы молекулы в состоянии теплового равновесия в среднем приходится энергия, равная (1/2)kT.
Для газов, состоящих из одноатомных молекул, (например, инертные газы) средняя кинетическая энергия, приходящаяся на один атом, определена соотношением (7), поскольку она соответствует лишь поступательному движению атомов, (3 степени свободы). В этом случае
,
Существенно, что для идеального газа одноатомных молекул внутренняя энергия зависит только от температуры и не зависит от объема.
Для линейных двухатомных молекул число степеней свободы равно пяти (на одну степень свободы меньше, чем для системы двух независимых атомов, поскольку в молекуле эти атомы связаны жесткой связью) Дополнительные две степени свободы описывают вращательное движение молекулы относительно двух взаимно-перпендикулярных осей. При этом
При этом
,
Если атомы в молекуле совершают еще и колебания, то, согласно классической теории, наличие колебательного движения вносит вклад в среднюю энергию молекулы, равный kT (по kT/2, приходящийся на кинетическую и потенциальную энергии колебаний. Тогда в случае молекулы, образованной из атомов,
,
где i = nпост + nвращ + 2nкол – полное число степеней свободы молекулы. При этом nпост = 3. Для линейной молекулы nвращ = 2, nкол = 3N – 5. Для всех других молекул nвращ = 3, nкол = 3N – 6.
Классическая теория, в основном, правильно описывает тепловые явления в газе в некоторых узких интервалах температур, однако температурная зависимость теплоемкости в целом, наблюдаемая в эксперименте, ведет себя далеко не так, как предсказывает классическая теория. Это несоответствие теории и эксперимента было понято только с появлением квантовой теории теплоемкости, основанной на представлении о дискретности вращательных и колебательных уровней молекул. При низких температурах наблюдается только поступательное движение молекул. С ростом температуры все большее число молекул вовлекается во вращательное движение. Если средняя тепловая энергия kT заметно превышает энергию первого вращательного уровня, в молекуле возбуждено уже много вращательных уровней. В этом случае дискретность уровней становится несущественной и теплоемкость равна своему классическому значению. Аналогичная ситуация имеет место и с возбуждением колебательных степеней свободы. Квантовая теория полностью объясняет характер температурной зависимости теплоемкости, ее непрерывный характер, отличающийся постепенным вовлечением в «игру» различных степеней свободы молекул.
Это несоответствие теории и эксперимента было понято только с появлением квантовой теории теплоемкости, основанной на представлении о дискретности вращательных и колебательных уровней молекул. При низких температурах наблюдается только поступательное движение молекул. С ростом температуры все большее число молекул вовлекается во вращательное движение. Если средняя тепловая энергия kT заметно превышает энергию первого вращательного уровня, в молекуле возбуждено уже много вращательных уровней. В этом случае дискретность уровней становится несущественной и теплоемкость равна своему классическому значению. Аналогичная ситуация имеет место и с возбуждением колебательных степеней свободы. Квантовая теория полностью объясняет характер температурной зависимости теплоемкости, ее непрерывный характер, отличающийся постепенным вовлечением в «игру» различных степеней свободы молекул.
Изотермические и адиабатические процессы в газе. Наряду с процессами изменения параметров газа, происходящими при постоянном объеме или при постоянном давлении, возможны изотермические (T = const, внутренняя энергия газа остается неизменной) и адиабатические (без отвода и подвода тепла к газу) процессы. В первом случае все подводимое к газу тепло расходуется на механическую работу, а изменение давления и объема для одного моля газа удовлетворяет условию pV = PT = const. В p—V координатах на плоскости соответствующие зависимости образуют семейство изотерм.
В первом случае все подводимое к газу тепло расходуется на механическую работу, а изменение давления и объема для одного моля газа удовлетворяет условию pV = PT = const. В p—V координатах на плоскости соответствующие зависимости образуют семейство изотерм.
Для адиабатического процесса (dQ = 0) из (13) и (14) следует
CVdT + pdV = 0
Уравнение состояния идеального газа дает
dT = R–1(pdV + Vdp).
Используя (16), уравнение адиабатического процесса можно представить в дифференциальной форме
(17) gpdv + Vdp = 0, где g = Ср/CV– отношение теплоемкостей при постоянном давлении и постоянном объеме, называемое адиабатической постоянной. Дифференциальному соотношению (17) при g = const соответствует уравнение адиабаты pVg = const
или
(18) TVg – 1 = const
Так как g > 1, то из (18) следует, что при адиабатическом сжатии газ нагревается, а при расширении – охлаждается. Это явление находит применение, например, в дизельных двигателях, где горючая смесь воспламеняется за счет адиабатического сжатия.
Это явление находит применение, например, в дизельных двигателях, где горючая смесь воспламеняется за счет адиабатического сжатия.
Скорость звука в газе.
Из гидрогазодинамики известно, что скорость звука в сплошной среде определяется соотношением
В первоначальных теориях (Ньютон) считалось, что давление и плотность связаны обычным уравнением состояния, т.е. p/r = соnst. Это соответствует предположению, что разности температур между сгущениями и разрежениями газа в звуковой волне мгновенно выравниваются, т.е. распространение звука является изотермическим процессом. В этом случае формула Ньютона для скорости звука принимает вид
Эта формула, однако, противоречила эксперименту. Лаплас первым понял, что колебания плотности и связанные с этим колебания температуры в звуковой волне происходят настолько быстро, что для таких процессов теплообмен несущественен и выравнивания температур не происходит. Это означает, что вместо уравнения изотермы надо пользоваться уравнением адиабаты. Тогда выражение для скорости звука принимает вид
Тогда выражение для скорости звука принимает вид
(19)
Скорость звука в газе имеет тот же порядок величины, что и средняя тепловая или средне-квадратичная скорости молекул. Это понятно, поскольку возмущения в звуковой волне передаются молекулами, движущимися с тепловыми скоростями. Для молекулярного азота, например, g = 1,4 и скорость звука при T = 273К равна 337 м/с. Средняя тепловая скорость молекул азота бvс при тех же условиях равна 458 м/с.
Реальные газы.
С ростом давления и уменьшением температуры состояние газа начинает все больше отклоняться от идеальности. Эксперимент показал, например, что для азота N2 при температуре T = 273K и давлении p =100 атм, ошибка в определении объема газа, если пользоваться уравнением состояния (3), может достигать 7%. Это связано с тем, что при таком давлении молекулы газа в среднем удалены друг от друга на расстояние, которое только вдвое больше их собственных размеров, а собственный объем молекул лишь в 20 раз меньше объема газа. При дальнейшем повышении давления становится все более существенным учет влияния на поведение газа как сил межмолекулярного взаимодействия, так и собственного объема молекул.
При дальнейшем повышении давления становится все более существенным учет влияния на поведение газа как сил межмолекулярного взаимодействия, так и собственного объема молекул.
Пока отклонения от идеальности малы, их можно учесть с помощью так называемого вириального разложения – разложения давления в ряд по степеням плотности молекул в объеме N/V
(20) ,
где B(T), C(T) – так называемые вириальные коэффициенты, зависящие от температуры и характеризующие влияние межмолекулярного взаимодействия. Для учета более сильных отклонений предложено много полуэмпирических и эмпирических уравнений состояния реальных газов, из которых наиболее часто используется уравнение Ван-дер-Ваальса.
Уравнение состояния неидеального газа – уравнение Ван-дер-Ваальса записывается для одного моля газа в виде
(21)
В нем учитывается как собственный объем молекул (постоянная b), так и влияние сил притяжения между молекулами (постоянная a). Из этого уравнения вытекает, в частности, существование наблюдаемой на опыте критической температуры и критического состояния. Критическое состояние характеризуется значением Tk и соответствующими ему значениями pk и Vk. При критической температуре Tk исчезает различие между разными состояниями вещества. Выше этой температуры переход от жидкости к газу либо, наоборот, от газа к жидкости оказывается непрерывным.
Из этого уравнения вытекает, в частности, существование наблюдаемой на опыте критической температуры и критического состояния. Критическое состояние характеризуется значением Tk и соответствующими ему значениями pk и Vk. При критической температуре Tk исчезает различие между разными состояниями вещества. Выше этой температуры переход от жидкости к газу либо, наоборот, от газа к жидкости оказывается непрерывным.
Процессы переноса в газах.
Если в газе создается какая-либо неоднородность его параметров (например, разные температуры газа или разные концентрации компонентов газовой смеси в разных частях сосуда), то возникают отклонения состояния газа от равновесия, которые сопровождаются переносом энергии (теплопроводность) или массы компонентов смеси (диффузия) из одной части сосуда в другую. При различии в скоростях перемещения разных слоев газа (например, при течении газа в трубе) возникает поперечный перенос импульса (вязкость). Все эти явления объединяются одним общим названием процессы переноса. При их описании особенно важным оказывается учет характера столкновений молекул в газе. Порядок величины соответствующих коэффициентов переноса (кинетических коэффициентов) и характер зависимости их от основных параметров дается элементарной кинетической теорией газа, основанной на модели молекул в виде твердых упругих шаров и на концепции средней длины свободного пробега молекул. Для переноса энергии в газе принимается
Все эти явления объединяются одним общим названием процессы переноса. При их описании особенно важным оказывается учет характера столкновений молекул в газе. Порядок величины соответствующих коэффициентов переноса (кинетических коэффициентов) и характер зависимости их от основных параметров дается элементарной кинетической теорией газа, основанной на модели молекул в виде твердых упругих шаров и на концепции средней длины свободного пробега молекул. Для переноса энергии в газе принимается
где q – плотность потока энергии (поток тепла), k – коэффициент теплопроводности, dT/dz – градиент температуры в направлении оси z.
Сила вязкого трения, возникающая между двумя слоями в движущемся газе, если имеется поперечное распределение скорости газа u(x), имеет вид
Наконец, если в бинарной газовой смеси молекул с близкой массой компонентов задано распределение плотности одного из компонентов n1(z), то диффузионный поток молекул компонента в направлении z записывается в виде
Коэффициенты переноса в этих соотношениях: коэффициенты теплопроводности k, вязкости h и самодиффузии D, получаемые методами элементарной кинетической теории, записываются в виде,
(22) , ,
где l – средняя длина свободного пробега молекул, бvс – средняя тепловая скорость молекул. Поскольку , где s – поперечное сечение столкновений молекул. коэффициенты теплопроводности и вязкости не зависят от плотности (или от давления) газа, в то время как коэффициент диффузии D ~ 1/p.
В элементарной теории численные коэффициенты в выражениях (22) оказываются одинаковыми. Точная теория для модели твердых упругих шаров (s = сonst) дает h = 0,5бvс l, k = 2,5(R/M)h,
rD = 1,2h
Более реалистические модели взаимодействия молекул в газе вносят изменения в характер зависимости коэффициентов переноса от температуры, что позволяет обеспечить лучшее совпадение теории с результатами экспериментальных измерений этих коэффициентов.
Владимир Жданов
Газ (состояние вещества) — Мегаэнциклопедия Кирилла и Мефодия — статья
Газ — агрегатное состояние вещества, в котором составляющие его атомы и молекулы почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения. Французское слово gaz образовано от греческого «хаос». Газообразное состояние вещества является самым распространенным состоянием вещества Вселенной. Солнце, звезды, облака межзвездного вещества, туманности, атмосферы планет состоят из газов, или нейтральных, или ионизованных (плазмы). Газы широко распространены в природе: они образуют атмосферу Земли, в значительных количествах содержатся в твердых земных породах, растворены в воде океанов, морей и рек. Встречающиеся в природных условиях газы представляют собой, как правило, смеси химически индивидуальных газов.
Газы равномерно заполняют доступное для них пространство, и в отличие от жидкостей и твердых тел, не образуют свободной поверхности. Они оказывают давление на ограничивающую заполняемое ими пространство оболочку. Плотность газов при нормальном давлении на насколько порядков меньше плотности жидкостей. В отличие от твердых тел и жидкостей, объем газов существенно зависит от давления и температуры.
Наиболее полно изучены были свойства достаточно разряженных газов, в которых расстояния между молекулами при нормальных условиях порядка 10 нм, что значительно больше радиуса действия сил межмолекулярного взаимодействия. Такой газ, молекулы которого рассматриваются как невзаимодействующие материальные точки, называется идеальным газом. Идеальные газы строго подчиняются законам Бойля — Мариотта и Гей-Люссака. Практически все газы ведут себя как идеальные при не слишком высоких давлениях и не слишком низких температурах.
Молекулярно-кинетическая теория газов рассматривает газы как совокупность слабо взаимодействующих частиц (молекул или атомов), находящихся в непрерывном хаотическом (тепловом) движении. На основе этих простых представлений кинетической теории удается объяснить основные физические свойства газов, особенно полно — свойства разреженных газов. У достаточно разреженных газов средние расстояния между молекулами оказываются значительно больше радиуса действия межмолекулярных сил. Так, например, при нормальных условиях в 1 см3 газа находится ~ 1019 молекул и среднее расстояние между ними составляет ~ 10-6 см. С точки зрения молекулярно-кинетической теории давление газов является результатом многочисленных ударов молекул газа о стенки сосуда, усредненных по времени и по стенкам сосуда. При нормальных условиях и макроскопических размерах сосуда число ударов об 1см2 поверхности составляет примерно 1024 в секунду.
Внутренняя энергия идеального газа (среднее значение полной энергии всех его частиц) зависит только от его температуры. Внутренняя энергия одноатомного газа, имеющего 3 поступательные степени свободы и состоящего из N атомов, равна:
При повышении плотности газа его свойства перестают быть идеальными, процессы столкновения начинают играть все большую роль и размерами молекул и их взаимодействия пренебречь уже нельзя. Такой газ называют реальный газ. Поведение реальных газов в зависимости от их температуры, давления, физической природы в большей или меньшей степени отличаются от законов идеальных газов. Одним из основных уравнений, описывающих свойства реального газа, является уравнения Ван-дер-Ваальса, при выводе которого были учтены две поправки: на силы притяжения между молекулами и на их размер.Любое вещество можно перевести в газообразное состояние соответствующим подбором давления и температуры. Поэтому возможную область существования газообразного состояния графически изображают в переменных: давление р — температура Т (на р-Т-диаграмме). Существует критическая температура Тк, ниже которой эта область ограничена кривыми сублимации (возгонки) и парообразования, т. е. при любом давлении ниже критического рк существует температура Т, определяемая кривой сублимации или парообразования, выше которой вещество становится газообразным. При температурах ниже Тк можно сконденсировать газ — перевести его в другое агрегатное состояние (твердое или жидкое). При этом фазовое превращение газа в жидкость или твердое тело происходит скачкообразно: незначительное изменение давления приводит к изменению ряда свойств вещества (например, плотности, энтальпии, теплоемкости и др.). Процессы конденсации газов, особенно сжижение газов, имеют важное техническое значение.
Область газового состояния вещества очень обширна, и свойства газов при изменении температуры и давления могут меняться в широких пределах. Так, в нормальных условиях (при 0°С и атмосферном давлении) плотность газа примерно в 1000 раз меньше плотности того же вещества в твердом или жидком состоянии. С другой стороны, при высоких давлениях вещество, которое при сверхкритических температурах можно считать газом, обладает огромной плотностью (например, в центре некоторых звезд ~109 г/см3).
Внутреннее строение молекул газа слабо влияет на давление, температуру, плотность и связь между ними, но существенным образом влияет на его электрические и магнитные свойства. Калорические свойства газов, такие как теплоемкость, энтропия и т. д., также зависят от внутреннего строения молекул.
Электрические свойства газов определяются возможностью ионизации молекул или атомов, т. е. появлением в газе электрически заряженных частиц (ионов и электронов). При отсутствии заряженных частиц газы являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность газов увеличивается. При температурах выше нескольких тысяч К газ частично ионизуется и превращается в плазму.
По магнитным свойствам газы делятся на диамагнитные (инертные газы, СО2, Н2О) и парамагнитные (О2). Молекулы диамагнитных газов не имеют постоянного магнитного момента и приобретают его лишь под действием магнитного поля. Те газы, молекулы которых обладают постоянным магнитным моментом, ведут себя как парамагнетики.
В современной физике газами называют не только одно из агрегатных состояний вещества. К газам с особыми свойствами относят, например, совокупность свободных электронов в металле (электронный газ), фононов в кристалле (фононный газ). Свойства таких газовых частиц описывает квантовая статистика.
Азот жидкий и газ: характеристика, формула, плотность, масса, температура, применение. Закись азота.
- Азот
- химический элемент, атомный номер 7, атомная масса 14,0067. В воздухе свободный азот (в виде молекул N2) составляет 78,09%. Немного легче воздуха, плотность 1,2506 кг/м3 при нулевой температуре и нормальном давлении. Температура кипения -195,8°C. Критическая температура -147°C и критическое давление 3,39 МПа. Бесцветный, без запаха и вкуса, нетоксичен, невоспламеняемый, невзрывоопасен и не поддерживающий горение газ в газообразном состоянии при обычной температуре обладает высокой инертностью. Химическая формула — N. В обычных условиях молекула азота двухатомная — N2.
История открытия азота
До сих пор ведутся споры о том, кто был первооткрывателем. В 1772 г. шотландский врач Даниель Резерфорд (Daniel Rutherford) пропуская воздух через раскаленный уголь, а потом через водный раствор щелочи — получил газ, который он назвал «ядовитый газ». Оказалось, что горящая лучинка, внесенная в сосуд, наполненный газом, гаснет, а живое существо в атмосфере этого газа быстро гибнет. Кстати, увидеть опыт с горячей лучинкой можно в видео.
В тоже время британский физик Генри Кавендшин (Henry Cavendish) проводя подобный опыт получил N2назвав его «удушливый воздух», британский естествоиспытатель Джозеф Пристли (Joseph Priestley) дал ему имя «дефлогистированный воздух», шведский химик Карл Вильгельм Шееле (Carl Wilhelm Scheele) — «испорченный воздух».
Окончательное имя «азот» дал французский ученый Антуан Лоран Лавуазье (Antoine Laurent de Lavoisier).
Слово «азот» греческого происхождения и означает «безжизненный».
Азот довольно легко поглощается раскаленным карбидом кальция, образуя при этом важный технический продукт — цианамид кальция и об этом уже писали в статье о получении ацетилена из карбида кальция.
Способы получения азота
Получение N2 в промышленных масштабах основано на производстве его из воздуха путем фракционной перегонки (см. получение азота).
Виды азота
- Жидкий азот
- бесцветная жидкость без запаха с температурой кипения -195,8°C при давлении 101,3 кПа и удельным объемом 1,239 дм3/кг при температуре -195,8°C и давлении 101,3 кПа. Жидкий азот используется как хладагент. Жидкий азот может вызвать обморожение кожи и поражение слизистой оболочки глаз.
- Закись азота
- бесцветный газ, имеет сладковатый вкус и слабый, приятный запах. Свойства этого газа были изучены английским химиком Гемфри Дэви (Humphry Davy) в 1799 году. Интересуясь действием различных газов на организм человека, Дэви обычно испытывал их на себе. При вдыхании закиси азота, он пришел в возбужденное состояние, сопровождаемое смехом. За эти свойства закись азота была названа им — веселящим газом. В дальнейшем было установлено, что при более длительном вдыхании закиси азота наступает потеря сознания. Закись азота — окисел, не дающий кислот, он относится к несолеобразующим окислам.
Закись азота (N2O) не может быть получена из газообразного кислорода и N2, она образуется из азотнокислой соли аммония, которая при осторожном нагревании разлагается на закись азота и воду по реакции:
NH4NO3 = N2O + 2H2O
- Газообразный азот
- относительно инертный по своим свойствам газ без цвета и запаха плотностью 1,25046 кг/м3 при 0°C и давлении 101,3 кПа. Удельный объем газообразного азота равен 860,4 дм3/кг при давлении около 105 Па и температуре 20°C.
В отличие от кислорода, который взаимодействует почти со всеми элементами, встречающимися в природе, газообразный азот при комнатной температуре соединяется с единственным элементом — литием, образуя при этом нитрид лития:
N2 + 6Li = 2Li3N
Но при высоких температурах ряд металлов (титан, молибден и др.) с азотом образуют нитриды, снижающие механические свойства и поэтому его концентрацию в зоне плавления стремятся ограничить.
Применение азота
Азот нашел применение во многих отраслях промышленности и ниже приведен небольшой список:
- для создания инертной атмосферы при производстве, хранении и транспортировке легко окисляемых продуктов;
- при высокотемпературных процессах (например — сварка и резка) обработки металлов, не взаимодействующих с азотом;
- для консервации замкнутых металлических сосудов и трубопроводов.
Применение азота в сварке
N2 является инертным по отношению к меди и ее сплавам (не растворяется в меди и не реагирует с ней) даже при высоких температурах. Азот применяют, как в чистом виде, так и в составе защитного газовой смеси с аргоном Ar (70-90%) + N2 (30-10%) для сварки меди и ее сплавов.
Также газ азот используют для сварки аустенитных нержавеющих сталей — исключительно как компонент защитной газовой смеси с аргоном.
Возникает логичный вопрос: «Если он образует карбиды, какой смысл его использовать для сварки нержавеющих сталей, в составе которых есть карбидообразующие элементы?»
Все дело в том, что даже сравнительно небольшое содержание N2увеличивает тепловую мощность дуги. Именно из-за этого свойства, его чаще всего используют не для сварки, а для плазменной резки.
При сварке полуавтоматом нержавейки добавление небольшого количества азота к смеси аргона с кислородом (95-97,5% Ar, 1% O2, 1,5-3% N2) позволяет добиться равномерной аустенитной структуры в сварных швах. При добавлении азота более 10% начинается обильное выделение дыма, но это не оказывает какого-либо негативного влияния на качество сварного шва нержавеющей стали.
При сварке полуавтоматом малоуглеродистых сталей содержание N2 в газовой смеси более 2% вызывает пористость при сварке в один проход. Концентрация N2 менее 0,5% вызывает пористость в сварном шве при многопроходной сварке.
Применение смеси Ar c высоким содержанием N2 для сварки меди и ее сплавов вызывает большое разбрызгивание метала сварочной ванны.
Вредность и опасность азота
Азот относится к нетоксичным газам, но может действовать как простой асфиксант (удушающий газ). Удушье наступает тогда, когда уровень кислорода в воздухе сокращается на 75% или становится ниже нормальной концентрации.
В больших количествах он очень вреден и опасен для организма человека.
Хранение и транспортировка азота
Выпускают азот по ГОСТ 9293 газообразным и жидким. Для сварки и плазменной резки применяют газообразный 1-го (99,6% N2) и 2-го (99,0% N2) сортов.
Хранят и транспортируют его в сжатом состоянии в стальных баллонах по ГОСТ 949.
Баллоны окрашены в черный цвет и надписью желтыми буквами «АЗОТ» на верхней цилиндрической части.
Характеристики азота
Характеристики N2 указаны в таблицах ниже:
Коэффициенты перевода объема и массы N2 при Т=15°C и Р=0,1 МПа
Масса, кг | Объем | |
|---|---|---|
Газ, м3 | Жидкость, л | |
| 1,170 | 1 | 1,447 |
| 0,809 | 0,691 | 1 |
| 1 | 0,855 | 1,237 |
Коэффициенты перевода объема и массы N2 при Т=0°C и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м3 | Жидкость, л | |
| 1,251 | 1 | 1,548 |
| 0,809 | 0,646 | 1 |
| 1 | 0,799 | 1,237 |
Азот в баллоне
| Наименование | Объем баллона, л | Масса газа в баллоне, кг | Объем газа (м3) при Т=15°C, Р=0,1 МПа |
|---|---|---|---|
| N2 | 40 | 7,37 | 6,3 |
Благодаря информации в таблице можно дать ответы на вопросы, которые часто задают сварщики:
- Сколько литров в баллоне азота?
Ответ: 40 литров - Сколько азота в баллоне 40л?
Ответ: 6,3 м3 или 7,37 кг - Сколько весит баллон с азотом 40 литров
Ответ:
58,5 кг — масса пустого баллона из углеродистой стали согласно ГОСТ 949;
7,37 — кг масса N2 в баллоне;
Итого: 58,5 + 7,37 = 65,87 кг вес баллона с азотом.
Давление азота в баллоне при различной температуре окружающей среды
| Температура окружающей среды | Давление в баллоне, МПа |
|---|---|
-40 | 11,2 |
-30 | 11,9 |
-20 | 12,6 |
-10 | 13,4 |
0 | 14,0 |
+10 | 14,7 |
+20 | 15,3 |
+30 | 15,9 |
Определение газа — химический словарь
Газы — это одно из четырех общих состояний вещества, остальные — твердые тела, жидкости, газы и плазма.
В общем, но не во всех конкретных случаях, при повышении температуры и понижении давления вещества проходят через четыре различных состояния.
твердое тело → жидкость → газ → плазма
Состояние газа
Газообразное состояние вещества характеризуется следующими свойствами:
- его объем не фиксирован; он расширяется, чтобы заполнить контейнер — в отличие от твердых тел и жидкостей
- сжимаемый — его объем изменяется при изменении давления — в отличие от твердых тел и жидкостей
- газы — это жидкости, поэтому они могут течь.Их формы адаптируются к форме их контейнеров
- : атомы или молекулы в газе распределены намного тоньше, чем частицы в твердых телах и жидкостях.
Например, при температуре 0 ° C и давлении 1 атм 1 моль воды в жидком состоянии имеет объем 18 мл, а в парообразном — 22,4 литра.
(При 0 ° C и 1 атм. Небольшое количество пара находится в равновесии с жидкой / твердой водой.)
Газовые элементы
При комнатной температуре и атмосферном давлении одиннадцать химических элементов существуют в виде газов.
Благородные газы
Шесть из них — благородные газы, существующие в виде отдельных атомов: гелий, неон, аргон, криптон, ксенон и радон.
Двухатомные газы
Пять существуют в виде двухатомных молекул: H 2 , N 2 , O 2 , F 2 и Cl 2 .
Воздух
Воздух представляет собой смесь газов.
В составе сухого воздуха более 99,9% составляют три элемента: N 2 , O 2 и Ar.
Законы о газе
Идеальные газы
Отношение между количеством молей газа и его давлением, объемом и температурой можно рассчитать с помощью закона идеального газа:
PV = nRT
P — давление в паскалях
V — объем, м 3
n — количество молей
R — постоянная идеального газа = J K -1 моль -1
T — температура в K
Уравнение также можно использовать с другими единицами измерения.
Реальные газы
Закон идеального газа основан на предположении, что частицы газа не имеют объема и не притягиваются и не отталкиваются друг от друга.Он наиболее точен для газов при низком давлении.
При более высоких давлениях можно использовать другие уравнения, например уравнение Ван-дер-Ваальса:
(P + 2 / V 2 ) (V — nb) = nRT
a и b — константы, которые меняются в зависимости от газа.
химическая реакция | Определение, уравнения, примеры и типы
Химическая реакция , процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов.Вещества — это химические элементы или соединения. Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов.
горение
Полено горело в огне. Сжигание древесины является примером химической реакции, в которой древесина в присутствии тепла и кислорода превращается в двуокись углерода, водяной пар и золу.
© chrispecoraro / iStock.com
Популярные вопросы
Каковы основы химических реакций?
- Химическая реакция — это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, известных как продукты.Вещества — это химические элементы или соединения.
- Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов. Свойства продуктов отличаются от свойств реагентов.
- Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.
Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современным представлениям о химических реакциях, связи между атомами в реагентах должны быть разорваны, а атомы или части молекул снова собираются в продукты, образуя новые связи. Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше, чем энергия, выделяемая при создании новых связей, и конечным результатом является поглощение энергии.Следовательно, в реакции могут образовываться разные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, составляющей, которая поставляет электронную пару, и кислотой Льюиса, разновидностью, которая может принимать электронную пару. Аммиак — это пример базы Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типам реагентов, по исходу реакции и по механизму реакции.Часто данную реакцию можно разделить на две или даже три категории, включая реакции газообразования и осаждения. Многие реакции производят газ, такой как диоксид углерода, сероводород, аммиак или диоксид серы. Подъем теста для кексов вызван реакцией газообразования между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и реакции окисления-восстановления, которые включают перенос одного или нескольких электронов от восстанавливающего агента к окислителю.Примеры классификации по результатам реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая предоставляет подробные сведения о том, как атомы перемешиваются и собираются заново при образовании продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и самой жизни. Сжигание топлива, плавка чугуна, изготовление стекла и глиняной посуды, пивоварение и изготовление вина и сыра — вот многие примеры деятельности, включающей химические реакции, которые были известны и использовались на протяжении тысяч лет.Химические реакции изобилуют геологией Земли, атмосферы и океанов, а также огромным количеством сложных процессов, которые происходят во всех живых системах.
Следует отличать химические реакции от физических изменений. Физические изменения включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. Вне зависимости от физического состояния вода (H 2 O) представляет собой одно и то же соединение, каждая молекула которого состоит из двух атомов водорода и одного атома кислорода.Однако, если вода в виде льда, жидкости или пара встречает металлический натрий (Na), атомы будут перераспределены, давая новым веществам молекулярный водород (H 2 ) и гидроксид натрия (NaOH). Этим мы знаем, что произошло химическое изменение или реакция.
тающий лед
Тающий лед, водопад Нижнее Чистилище, на притоке реки Суеган между Мон-Верноном и Линдборо, Нью-Гэмпшир. Таяние льда — это физическое изменение, а не химическая реакция.
Уэйн Дионн / © Отдел развития туризма и путешествий Нью-Гэмпшира
Исторический обзор
Концепция химической реакции возникла около 250 лет назад.Он возник в ранних экспериментах, в которых вещества классифицировались как элементы и соединения, а также в теориях, объясняющих эти процессы. Разработка концепции химической реакции сыграла первостепенную роль в определении современной химии.
Получите эксклюзивный доступ к контенту нашего 1768 First Edition с подпиской.
Подпишитесь сегодня
Первые существенные исследования в этой области были посвящены газам. Особое значение имело определение кислорода в XVIII веке шведским химиком Карлом Вильгельмом Шееле и английским священником Джозефом Пристли.Особенно заметно влияние французского химика Антуана-Лорана Лавуазье, поскольку его идеи подтвердили важность количественных измерений химических процессов. В своей книге Traité élémentaire de chimie (1789; Элементарный трактат по химии ) Лавуазье определил 33 «элемента» — вещества, не разбитые на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, набранный при окислении элементов, и приписал результат объединению элемента с кислородом.Концепция химических реакций, включающих комбинацию элементов, ясно появилась из его работ, и его подход побудил других исследовать экспериментальную химию как количественную науку.
Другим исторически значимым событием в области химических реакций было развитие теории атома. В этом большая заслуга английского химика Джона Далтона, который сформулировал свою атомную теорию в начале XIX века. Дальтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны и что химические реакции участвуют в перегруппировке атомов с образованием новых веществ.Такой взгляд на химические реакции точно определяет текущую тему. Теория Дальтона послужила основой для понимания результатов ранних экспериментаторов, включая закон сохранения материи (материя не создается и не разрушается) и закон постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Таким образом, эксперимент и теория, два краеугольных камня химической науки в современном мире, вместе определили концепцию химических реакций.Сегодня экспериментальная химия предоставляет бесчисленное количество примеров, а теоретическая химия позволяет понять их значение.
Основные понятия химических реакций
Создавая новое вещество из других веществ, химики говорят, что они проводят синтез или синтезируют новый материал. Реагенты превращаются в продукты, и процесс символизируется химическим уравнением. Например, железо (Fe) и сера (S) объединяются с образованием сульфида железа (FeS).Fe (s) + S (s) → FeS (s) Знак плюс указывает, что железо реагирует с серой. Стрелка означает, что реакция «образует» или «дает» сульфид железа, продукт. Состояние вещества реагентов и продуктов обозначается символами (s) для твердых веществ, (l) для жидкостей и (g) для газов.
Учебное пособие по химии сжигания углеводородов
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Полное сжигание углеводородов
Любой углеводород сгорает в избытке кислорода с образованием газообразного диоксида углерода и водяного пара.
Для полного сгорания углеводорода:
⚛ газообразный кислород — избыток реагента
⚛ углеводород — ограничивающий реагент
Мы можем написать общее словесное уравнение для полного сгорания любого углеводорода, как показано ниже:
углеводород + избыточный газообразный кислород → газообразный диоксид углерода + водяной пар
Углеводороды включают алканы, алкены и алкины, поэтому мы можем сказать, что:
⚛ любой алкан сгорает в избытке кислорода с образованием газообразного диоксида углерода и водяного пара
алкан + избыток газообразного кислорода → газообразный диоксид углерода + водяной пар
⚛ любой алкен сгорает в избытке кислорода с образованием газообразного диоксида углерода и водяного пара
алкен + избыток газообразного кислорода → газообразный диоксид углерода + водяной пар
⚛ любой алкин сгорает в избытке кислорода с образованием газообразного диоксида углерода и водяного пара
алкин + избыток газообразного кислорода → газообразный диоксид углерода + водяной пар
Пример: полное сгорание метана
Метан, CH 4 (г) , является углеводородом.Это соединение, состоящее только из элементов углерода (C) и водорода (H).
Метан — это газ при комнатной температуре и давлении.
Это обычный компонент природного газа, который используется в качестве топлива.
Метан сгорает в избытке кислорода с образованием газообразного диоксида углерода (CO 2 (г) ) и водяного пара (H 2 O (г) ).
Сгорание с избытком кислорода называется полным сгоранием.
Мы можем написать сбалансированное химическое уравнение для представления полного сгорания газообразного метана, как показано ниже:
- Напишите словесное уравнение для полного сгорания метана:
общее уравнение: реактивы → товаров словесное уравнение: метан + газообразный кислород → углекислый газ + водяной пар - Запишите молекулярную формулу для каждого реагента и продукта в словесном уравнении:
Реагенты Продукты метан: газообразный кислород:
CH 4 (г) O 2 (г)
углекислый газ: водяной пар:
CO 2 (г) H 2 O (г)
- Напишите несбалансированное химическое уравнение, подставив молекулярную формулу для названия каждого реагента и продукта в словесное уравнение:
общее уравнение: реактивы → товаров словесное уравнение: метан + газообразный кислород → углекислый газ + водяной пар несбалансированное химическое уравнение: CH 4 (г) + O 2 (г) → CO 2 (г) + H 2 O (г) - Уравновесить химическое уравнение:
несбалансированное химическое уравнение: CH 4 (г) + O 2 (г) → CO 2 (г) + H 2 O (г) №Атомы C: 1 = 1 атомов углерода сбалансировано Кол-во атомов H: 4 ≠ 2 атомов H НЕ сбалансировано Необходимо умножить количество молекул воды на 2 , чтобы уравновесить атомы водорода.Затем проверьте баланс этого нового химического уравнения, как показано ниже. CH 4 (г) + O 2 (г) → CO 2 (г) + 2 H 2 O (г) Кол-во атомов C: 1 = 1 атомов углерода сбалансировано №Атомы H: 4 = 4 атомов H сбалансировано Кол-во атомов O: 2 ≠ 2 + 2 Атомы O НЕ сбалансированы Необходимо умножить количество молекул кислорода на 2 , чтобы уравновесить атомы кислорода.Затем проверьте баланс этого нового химического уравнения, как показано ниже: CH 4 (г) + 2 O 2 (г) → CO 2 (г) + 2H 2 O (г) Кол-во атомов C: 1 = 1 атомов углерода сбалансировано №Атомы H: 4 = 4 атомов H сбалансировано Кол-во атомов O: 4 = 2 + 2 Атомов О сбалансировано - Сбалансированное химическое уравнение полного сгорания газообразного метана:
CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O (г)
Неполное сжигание углеводородов
Если присутствует недостаточно газообразного кислорода для сгорания углеводорода, чтобы произвести наиболее окисленную форму углерода, которой является газообразный диоксид углерода, мы называем реакцию неполным сгоранием углеводорода.
Для неполного сгорания углеводорода:
⚛ газообразный кислород — ограничивающий реагент
⚛ углеводород — избыток реагента
Неполное сгорание углеводорода обычно приводит к возникновению «сажистого» пламени из-за присутствия углерода (C) или сажи как продукта реакции неполного сгорания.
Водород в углеводороде будет окисляться до воды, H 2 O, но углерод в углеводороде может или не может быть окислен до газообразного монооксида углерода (CO (г) ).
Пример: Неполное сгорание метана
В конкретном эксперименте избыточный газообразный метан (CH (g) ) сжигался в ограниченном количестве газообразного кислорода с образованием сажи (твердого углерода) и водяного пара.
Мы можем написать сбалансированное химическое уравнение, чтобы представить это неполное сгорание метана в этом эксперименте, как показано ниже:
- Напишите словесное уравнение неполного сгорания метана:
общее уравнение: реактивы → товаров словесное уравнение: метан + газообразный кислород → твердый углерод + водяной пар - Запишите молекулярную формулу для каждого реагента и продукта в слове уравнение:
Реагенты Продукты метан: газообразный кислород:
CH 4 (г) O 2 (г)
твердый углерод: водяной пар:
C (с) H 2 O (г)
- Напишите несбалансированное химическое уравнение, подставив формулу названия каждого реагента и продукта в словесное уравнение:
общее уравнение: реактивы → товаров словесное уравнение: метан + газообразный кислород → твердый углерод + водяной пар несбалансированное химическое уравнение: CH 4 (г) + O 2 (г) → C (т) + H 2 O (г) - Уравновесить химическое уравнение:
несбалансированное химическое уравнение: CH 4 (г) + O 2 (г) → C (т) + H 2 O (г) №Атомы C: 1 = 1 атомов углерода сбалансировано Кол-во атомов H: 4 ≠ 2 атомов H НЕ сбалансировано Необходимо умножить количество молекул воды на 2 , чтобы уравновесить атомы водорода.Затем проверьте баланс нового уравнения: CH 4 (г) + O 2 (г) → C (т) + 2 H 2 O (г) Кол-во атомов C: 1 = 1 атомов углерода сбалансировано №Атомы H: 4 = 4 атомов H сбалансировано Кол-во атомов O: 2 = 2 Атомов О сбалансировано - Уравновешенное химическое уравнение неполного сгорания газообразного метана в этом эксперименте:
CH 4 (г) + O 2 (г) → C (с) + 2H 2 O (г)
Химия и ее ветви ~ ChemistryGod
Что такое химия
Химия — это отрасль науки, которая занимается изучением материи, состоящей из атомов и молекул, их свойств, состава, структуры, поведения и взаимодействия между составляющими материи.
Химия — очень увлекательный предмет. Все мы окружены химией. Все вокруг нас состоит из атомов и молекул, включая само наше тело. Мы можем видеть химию в нашей повседневной деятельности; прямо от производства продуктов питания на фермах до их приготовления на кухне, от велосипеда до космической ракеты, от телефонов до компьютеров. Сталь, используемая в зданиях, полимеры, из которых делают полиэтиленовые пакеты, аккумуляторы для мобильных телефонов, фотосинтез, моющие средства, одежду, красители, напитки и т. Д., это некоторые из примеров применения химии. Химия помогает нам понять мир, который мы видим и переживаем.
Отрасли химии
Сегодня химия превратилась в очень разнообразный предмет с большим количеством отраслей. Современную химию можно разделить на пять основных разделов, которые обсуждаются ниже.
Основные отрасли химии
Пять основных областей химии — это физическая химия, аналитическая химия, неорганическая химия, органическая химия и биохимия.
Основные разделы химии
Физическая химия
Физическая химия, как следует из названия, представляет собой сочетание физики и химии. Физическая химия хорошо пересекается с некоторыми разделами физики. Это раздел науки, который занимается изучением макроскопических свойств, таких как давление, объем и т. Д .; атомные свойства, такие как энергия ионизации, электроотрицательность, валентность и т. д. Это также касается структуры вещества и энергии.
Некоторые из областей изучения физической химии упомянуты ниже:
- Химическая кинетика: это изучение скорости химической реакции.
- Термохимия: это область, относящаяся к термодинамике, которая имеет дело с теплом в химической системе и его отношением к работе.
- Химия поверхности: это область изучения химических процессов на поверхности материалов.
- Фотохимия: Изучение химических реакций, протекающих в присутствии света.
- Спектроскопия: касается электромагнитных излучений и их взаимодействия с атомами и молекулами.
- Статистическая механика: это статистическое исследование большого количества атомов и молекул.Статистическая механика — это один из предметов, в которых физика и химия пересекаются.
- Квантовая химия: это приложение квантовой механики к химической системе.
- Электрохимия: это раздел физической химии, который занимается химическими изменениями, связанными с движением электронов между электродами.
- Фемтохимия: это исследование химических реакций на фемтоуровне (10 −15 секунд). Это помогает нам понять каждое движение молекул.
Аналитическая химия
Это раздел химии, который специализируется на качественных и количественных методах анализа свойств материи. Короче говоря, это анализ химикатов. Он широко применяется в химической промышленности для поддержания качества конечного готового продукта. В реальной жизни этапы анализа — это разделение, идентификация и, наконец, количественная оценка. При разделении мы отделяем компоненты от смеси. После выделения желаемого образца мы определяем его составляющую с помощью качественного анализа.И, наконец, мы оцениваем концентрацию аналитов путем количественного анализа.
В аналитической химии используются два классических метода: качественный и количественный. Качественный метод предполагает идентификацию химических компонентов (атомов, молекул, ионов и т. Д.) В веществах. В количественном методе определяется концентрация вещества в заданной пробе. С развитием науки и техники мы можем разрабатывать различные инструменты, которые могут обеспечить лучшую точность и точность.
Аналитическая химия — это не только анализ веществ, но и совершенствование существующих методов анализа и разработка новых.
Вот некоторые из распространенных методов анализа:
- Испытания на пламя: Испытание включает в себя воздействие пламени (восстанавливающего или окислительного) на образец с последующим наблюдением за цветом пламени. Цвет пламени дает нам представление о компонентах, присутствующих в образце. Этот тест практически не используется в промышленности или в профессиональном мире.
- Химические тесты: он используется для идентификации функциональных групп в данном образце путем проведения серии химических реакций на образце.
- Титрование (или волюметрический анализ): включает добавление известного титранта в раствор до достижения точки эквивалентности.
- Гравиметрия: это количественный метод, который используется для оценки количества присутствующего вещества на основе разницы масс после изменения.
- Хроматография: это метод разделения, состоящий из подвижной фазы (жидкости, несущей данный образец), которая течет по неподвижной фазе.На основании сродства ингредиентов подвижной фазы к стационарной фазе происходит удержание ингредиентов на стационарной фазе.
- Спектроскопия: это исследование того, как атомы и молекулы взаимодействуют с электромагнитным излучением.
- Электрохимический анализ: это метод анализа, при котором аналит изучается путем пропускания электричества и измерения напряжения и тока с течением времени.
- Электрофорез: это метод разделения, при котором диспергированные частицы разделяются под действием электрического поля.
Неорганическая химия
Это раздел химии, который занимается изучением неорганических соединений. Неорганические соединения — это соединения, не содержащие углерод-водородной связи. Неорганические соединения в основном находятся под поверхностью земли: горные породы и минералы, а также другие вещества производятся в химической промышленности. Неорганические химические вещества находят применение в красках, пигментах, покрытиях, удобрениях, поверхностно-активных веществах, дезинфицирующих средствах и в солнечной энергетике. Крупнейшие производимые в мире неорганические химические вещества — это серная кислота, водород, азот, аммиак, хлор, пентаоксид фосфора, азотная кислота, соляная кислота, гидроксид натрия.
Некоторые из областей неорганической химии следующие:
- Координационная химия: она состоит из изучения координационных комплексов. Координационные комплексы состоят из центрального атома, обычно металла, окруженного лигандами или комплексообразующим агентом.
- Металлоорганическая химия: это исследование металлоорганических соединений, которые состоят из соединений, имеющих связь металл-углерод-водород (металлоорганическая связь). Эта область входит как в органическую, так и в неорганическую химию.
- Биоинорганическая химия: охватывает взаимодействие неорганических веществ, таких как металлы, в клетках и тканях.
- Химия твердого тела (или химия материалов): это исследование свойств, структуры твердой фазы. Это часть физики твердого тела.
Органическая химия
Это раздел химии, который занимается изучением органических соединений. органические соединения — это соединения, содержащие углерод-водородную связь. Углерод способен образовывать длинные цепочки C-C (так называемое сцепление).Именно из-за этого свойства углерода он образует огромное количество соединений. Это причина того, почему органические соединения превосходят неорганические соединения. Помимо углерода и водорода, элементами, широко присутствующими в органических соединениях, являются кислород, азот, сера, фосфор и галогены (фтор, хлор и йод). Органические соединения используются в сельском хозяйстве, пищевой промышленности, медицине, полимерах, текстиле, инсектицидах, фармацевтике, резине, топливе и производстве товаров народного потребления. Некоторые из важных промышленных органических химикатов: метан, этилен, пропилен, 1,2-дихлорэтилен, метанол, изопропиловый спирт, бутан, ацетилен, полистирол, глицерин, ацетон, уксусная кислота, уксусный ангидрид, мочевина, толуол, фенол, анилин.глюкоза, фруктоза, крахмал и т. д.
Важные области органической химии упомянуты ниже.
- Химия полимеров: изучает синтез и свойства полимеров.
- Металлоорганические химические соединения: это исследование металлоорганических соединений, которые состоят из соединений, имеющих связь металл-углерод-водород (металлоорганическая связь). Эта область входит как в органическую, так и в неорганическую химию.
- Физико-органическая химия: это исследование реакционной способности и структуры органических химикатов.
- Стереохимия: это химия, изучающая стереоизомеры. Он фокусируется на пространственном расположении атомов.
- Медицинская химия: включает применение химии для медицины и разработки лекарств.
- Биоорганическая химия: это сочетание органической и биохимии.
Биохимия
Биохимия — это область науки, в которой основное внимание уделяется изучению химических процессов внутри биологической системы. Биохимия — новая область по сравнению с указанными выше разделами химии.Профессионалов в этой области химии называют биохимиками. Биохимия фокусируется на использовании химии для лучшего понимания биологических систем, таких как дыхание, пищеварение, клеточный метаболизм и т. Д. Биохимики работают над такими заболеваниями, как рак, чтобы разработать лучшее лечение; они также изучают молекулярную генетику, чтобы улучшить гены.
Важными областями исследований в области биохимии являются следующие:
- Молекулярная генетика: включает изучение генов. Это тесно связано с генной инженерией.
- Сельскохозяйственная биохимия: основное внимание уделяется внедрению биохимии для улучшения сельскохозяйственного производства.
- Молекулярная биохимия: занимается изучением макромолекул, таких как белки, мембраны, ферменты, нуклеиновые кислоты, аминокислоты, вирусы и т. Д.
- Клиническая биохимия: это все о болезнях и связанных с ними темах.
- Иммунохимия: это раздел биохимии, связанный с химической реакцией, связанной с иммунной системой.
Другие дисциплины химии
Химия не ограничивается указанными выше пятью разделами, но есть много других специализированных областей химии, разработанных в течение определенного периода времени.
Астрохимия
Это исследование химических реакций в космическом пространстве. Астрохимия тесно связана с астрономией.
Геохимия
Это исследование химических систем в геологической среде. Геохимики изучают такие виды деятельности, как горное дело, добыча нефти, образование горных пород, образование нефти.
Химия пищевых продуктов
Химики-пищевые химики изучают различные биологические составляющие пищи. Основными составляющими любой биологической системы являются углеводы, жиры и белки.Химики-пищевые химики улучшают качество еды. Качество пищи может быть улучшено за счет увеличения продолжительности жизни пищи, правильного хранения и сохранения таких сенсорных аспектов, как запах, цвет и вкус пищи.
Химическая инженерия
Работу инженеров-химиков можно разделить на две основные категории: создание инновационных продуктов и промышленное применение. В промышленности они работают над обработкой химикатов, устранением неисправностей, поддержанием ежедневного объема производства. Это в основном полевые работы.Они также работают над разработкой и улучшением новых методов для лучшего производства химикатов. Находясь в лаборатории, они в основном тратят время на разработку новых материалов.
Судебная химия
Судебная химия — это приложение аналитической химии. Он включает в себя анализ различных образцов аналитическими методами для выявления преступников. Судебные химики работают в лабораториях и в основном работают в государственных учреждениях.
Ядерная химия
Этот раздел химии занимается изучением реакций на атомном уровне, таких как деление, синтез.Ученые-ядерщики работают над созданием ядерных бомб, ядерной энергетики. Преобразование ядерной энергии в электричество — одно из главных достижений ученых-ядерщиков.
Нейрохимия
Это исследование химических веществ, связанных с нервной системой (также называемых нейрохимическими веществами). Нейрохимические вещества включают глутамат, глицин, дофамин, норэпинефрин, аденозин, гистамин и т. Д.
Космохимия
Это исследование химических компонентов материи во Вселенной.
Атмосферная химия
Основное внимание уделяется пониманию сложных химических процессов в атмосфере планеты. Это очень важная область для понимания изменения климата.
Фитохимия
Это тесно связано с ботаникой. Это изучение фитохимических веществ, полученных из растений.
Ocean Chemistry
Это также называется «Морская химия», которая занимается изучением химических процессов в океанах.
Нефтехимия
Отрасль химии, занимающаяся сырой нефтью, нефтью, природным газом, их переработкой и переработкой.Нефтехимия — очень важный сегмент, поскольку большая часть наших потребностей в энергии удовлетворяется за счет конечных нефтепродуктов, таких как бензин, дизельное топливо, сжиженный газ и т. Д.
Математическая химия
Это реализация математики для моделирования различных химических процессов. Это сочетание математики и химии.
Механохимия
В механохимии химические реакции происходят путем приложения механической энергии к молекулам. Это новая область. Это сочетание химии и машиностроения.
Радиохимия
Он занимается использованием радиоактивных веществ для изучения обычных химических реакций.
Сонохимия
Это отрасль науки, которая фокусируется на том, как ультразвуковые волны (высокочастотный звук) влияют на химические системы.
Супрамолекулярная химия
Эта ветвь включает изучение межмолекулярных сил, образованных нековалентными связями, таких как силы Ван-дер-Вааль, водородные связи, координация металлов и т. Д.
Промышленная химия
Это исследование промышленных процессов преобразования сырья в продукты.Это происходит между лабораторными исследованиями и производством в промышленных масштабах. Химик-промышленник и инженер-химик тесно связаны. промышленный химик больше сосредоточен на химическом аспекте процесса. В то время как инженер-химик больше озабочен масштабированием процесса экономичным способом.
Химия окружающей среды
Химия окружающей среды занимается изучением химических взаимодействий в воздухе, почве и водной среде. Химики-экологи применяют знания химии, чтобы понять окружающую среду.
Зеленая химия
Зеленая химия направлена на сокращение вредных веществ в окружающей среде путем улучшения химических процессов и разработки альтернативных способов. Это также называется устойчивой химией; Не следует путать с химией окружающей среды.
Многие отрасли химии пересекаются друг с другом.
Связанные статьи
Что такое синтез-газ — информация о биотопливе
Синтез-газ — это сокращение от синтез-газа, который представляет собой смесь, состоящую из окиси углерода, двуокиси углерода и водорода.Синтез-газ получают путем газификации углеродсодержащего топлива до газообразного продукта, имеющего некоторую теплотворную способность. Некоторые из примеров производства синтез-газа включают газификацию выбросов угля, выбросы отходов для энергетической газификации и паровой риформинг кокса.
Название «синтез-газ» происходит от его использования в качестве промежуточного продукта при производстве синтетического природного газа и для производства аммиака или метанола. Это газ, который можно использовать для синтеза других химических веществ, отсюда и название синтез-газ, которое было сокращено до синтез-газа.Синтез-газ также является промежуточным звеном в создании синтетической нефти для использования в качестве смазочного материала или топлива.
Синтез-газ имеет 50% плотности энергии природного газа. Его нельзя сжигать напрямую, но он используется в качестве источника топлива. Другое использование — в качестве промежуточного продукта для производства других химикатов. Производство синтез-газа для использования в качестве сырья при производстве топлива осуществляется путем газификации угля или городских отходов. В этих реакциях углерод соединяется с водой или кислородом с образованием диоксида углерода, монооксида углерода и водорода.Синтез-газ используется в качестве промежуточного продукта в промышленном синтезе аммиака и удобрений. Во время этого процесса метан (из природного газа) соединяется с водой, образуя окись углерода и водород.
Процесс газификации используется для преобразования любого материала, содержащего углерод, в более длинные углеводородные цепи. Одно из применений синтез-газа — это топливо для производства пара или электричества. Другое использование — это базовый химический строительный блок для многих нефтехимических и нефтеперерабатывающих процессов.
Основным сырьем, используемым для газификации (создания синтез-газа), является уголь, материалы на основе нефти или другие материалы, которые могут быть выброшены как отходы. Из этих материалов готовят сырье. Он вводится в газогенератор в сухом виде или в виде суспензии. В газификаторе это сырье реагирует в среде с недостатком кислорода с паром при повышенных давлении и температуре. Полученный синтез-газ состоит на 85% из моноксида углерода и водорода и небольших количеств метана и диоксида углерода.
Синтез-газ может содержать некоторые следовые элементы примесей, которые удаляются путем дальнейшей обработки и либо восстанавливаются, либо направляются в газификатор. Например, сера извлекается в элементарной форме или в виде серной кислоты, и обе они могут быть проданы. Синтез-газ — это основной источник серной кислоты. Если синтез-газ содержит значительное количество азота, азот необходимо отделить, чтобы избежать образования оксидов азота, которые являются загрязнителями и способствуют образованию кислотных дождей.И окись углерода, и азот имеют схожие точки кипения, поэтому для извлечения чистого окиси углерода требуется криогенная обработка, что очень сложно.
Если синтез-газ должен использоваться для выработки электроэнергии, то он обычно используется в качестве топлива в конфигурации выработки электроэнергии IGCC (интегрированный комбинированный цикл газификации). Затем энергия используется фактором, производящим синтез-газ, тем самым снижая эксплуатационные расходы. Существуют коммерчески доступные технологии обработки синтез-газа для производства промышленных газов, удобрений, химикатов, топлива и других продуктов.
Что такое СТП в химии?
Химия
Наука
Анатомия и физиология
Астрономия
Астрофизика
Биология
Химия
науки о Земле
Наука об окружающей среде
.



