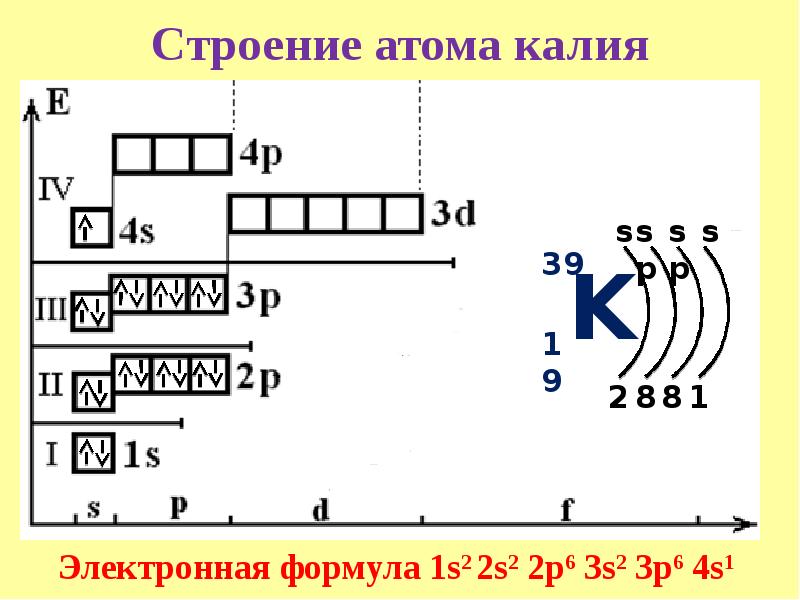
Атомы и электроны, подготовка к ЕГЭ по химии
Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома —
порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.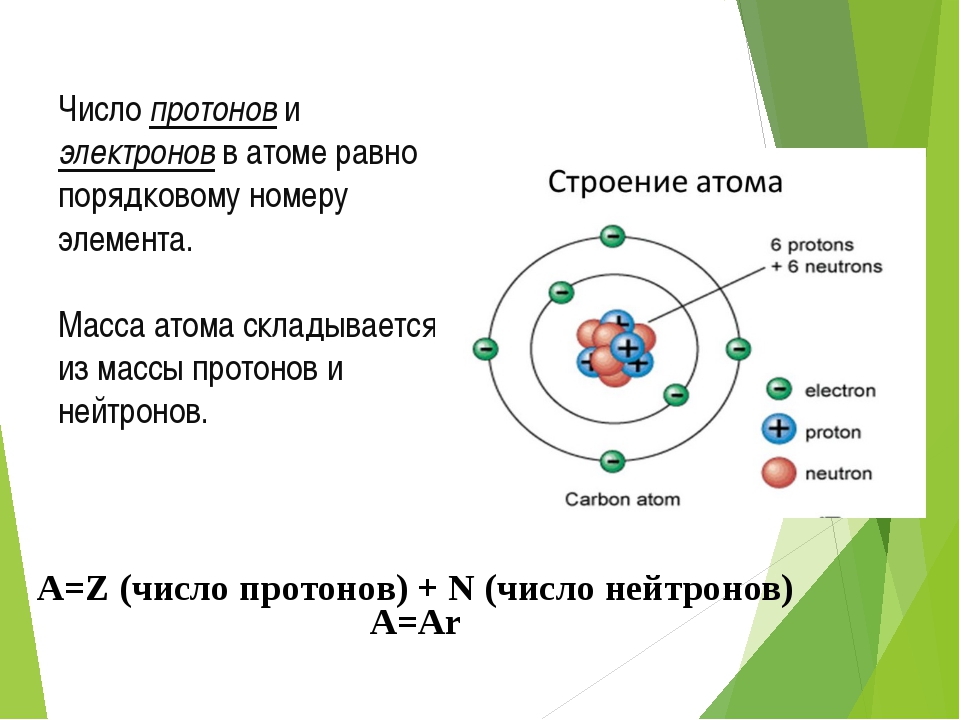
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s2)
Состоит из s-подуровня: одной «s» ячейки (2s2) и p-подуровня: трех «p» ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s2), p-подуровня: трех «p» ячеек (3p6) и d-подуровня:
пяти «d» ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s2), p-подуровня: трех «p» ячеек (4p6), d-подуровня:
пяти «d» ячеек (4d10) и f-подуровня: семи «f» ячеек (4f14), на которых помещается 14
электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.
Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень.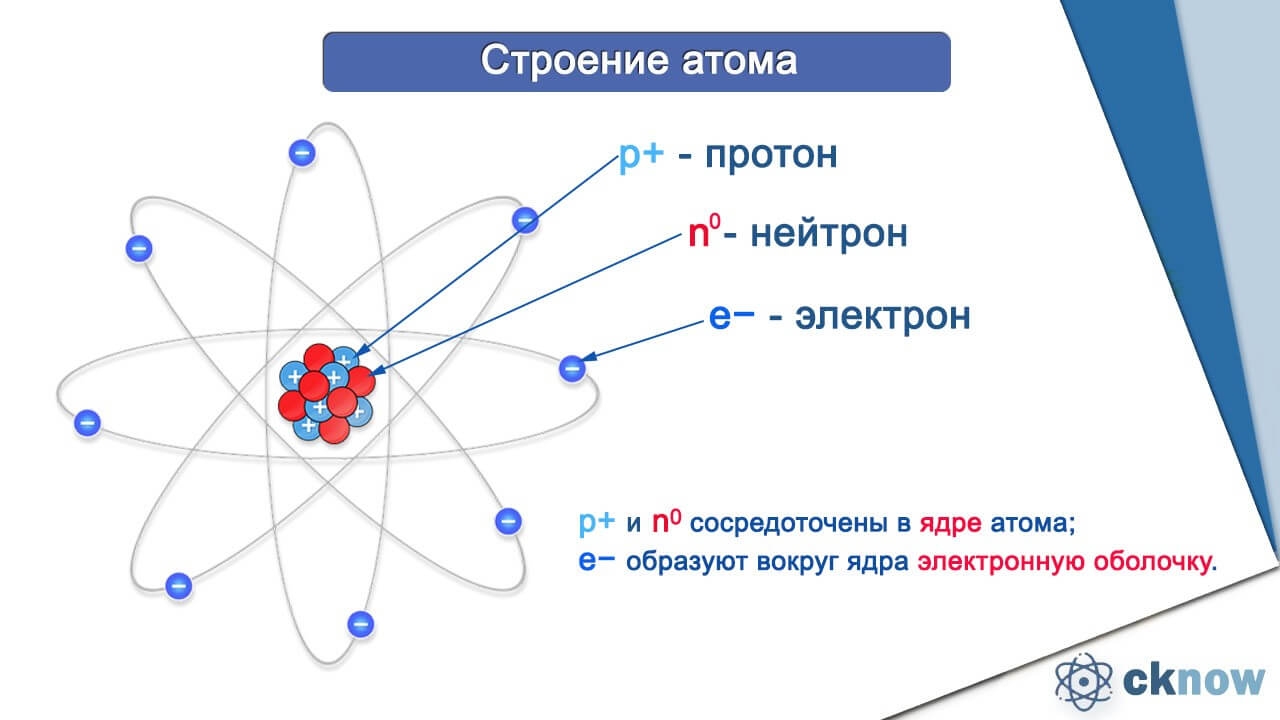 Однако природа распорядилась иначе.
Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s22s22p2
- Серы — 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.
Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.
- Углерод — 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.
Запишем получившиеся электронные конфигурации магния и фтора:
- Магний — 1s22s22p63s2
- Скандий — 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением — провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую «неправильную» (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.
Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора — возбужденное состояние невозможно, так как отсутствуют свободные орбитали («ячейки») — электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Строение атома — материалы для подготовки к ЕГЭ по Химии
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Атом — в переводе с древнегреческого – неделимый — это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов. Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
| Заряд z | Масса m | |
| Протон p+ | +1 | 1 |
| Нейтрон n0 | 0 | 1 |
| Электрон e— | -1 | 0 |
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности атомной массы и номера элемента.
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов. Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.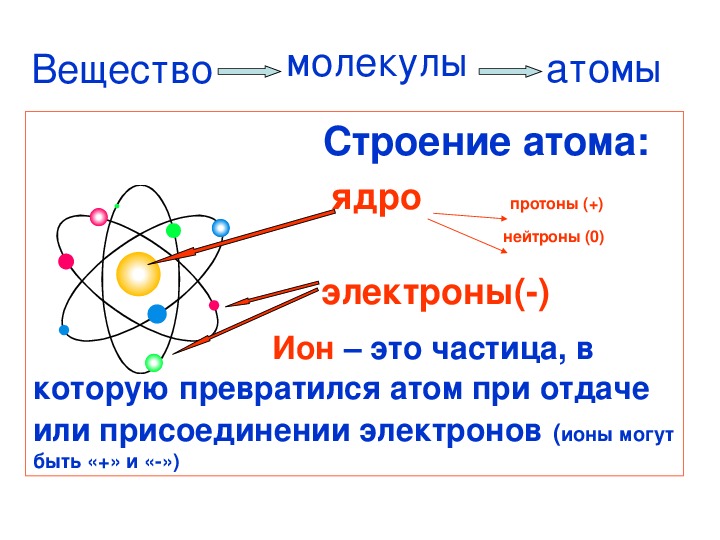
Например, 35Cl и 37Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
| Число протонов | Число нейтронов | Число электронов | |
| 35Cl | 17 | 18 | 17 |
| 37Cl | 17 | 20 | 17 |
Вокруг ядра по различным траекториям — орбиталям движутся электроны. Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Порядок заполнения орбиталей:
Электроны располагаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии: в первую очередь электроны заполняют наиболее низкие по энергии уровни (ближайшие к ядру).

Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p . (●)
| Тип орбитали | Число орбиталей на энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Перед оставшимися двумя принципами введем понятие спина электрона. Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки.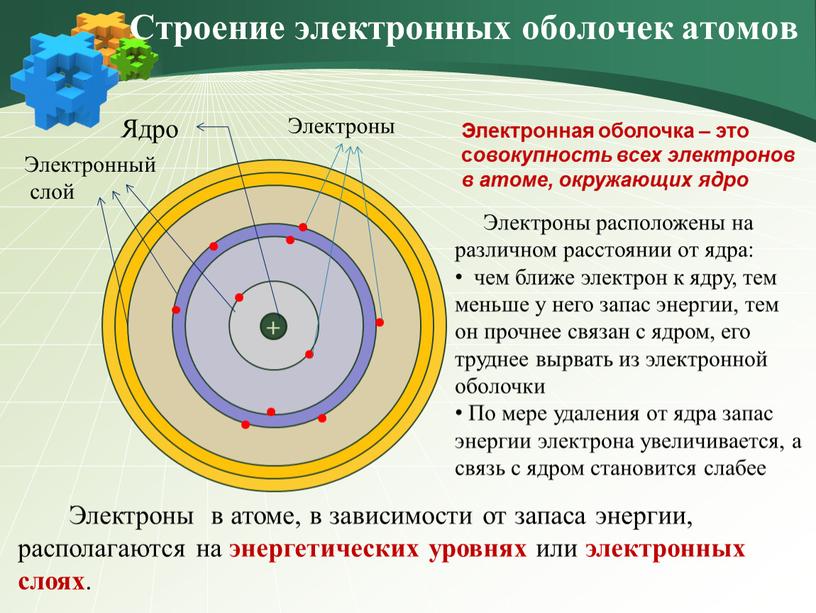 Возможных значений всего два: +1/2 и -1/2.
Возможных значений всего два: +1/2 и -1/2.
- Принцип Паули: на каждой орбитали может быть не более двух электронов, причем их спины должны быть различными.
- Правило Хунда: суммарный спин системы должен быть максимально возможным.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов n-го периода заполнены предыдущие n-1 электронные уровни.
— магний – двенадцатый элемент, имеет по 12 протонов и электронов. Распределим эти электроны в соответствии с (●), не забывая, что на каждом подуровне может быть не более двух электронов.
Магний – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Магний находится во второй группе, значит, на третьем уровне у него два электрона — 3s2. Итого получаем1s22s22p63s2.
Итого получаем1s22s22p63s2.
В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).
— фосфор – пятнадцатый элемент, распределяем 15 электронов: Фосфор — элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов — 3s23p3. Итого получаем1s22s22p63s23p3.
В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).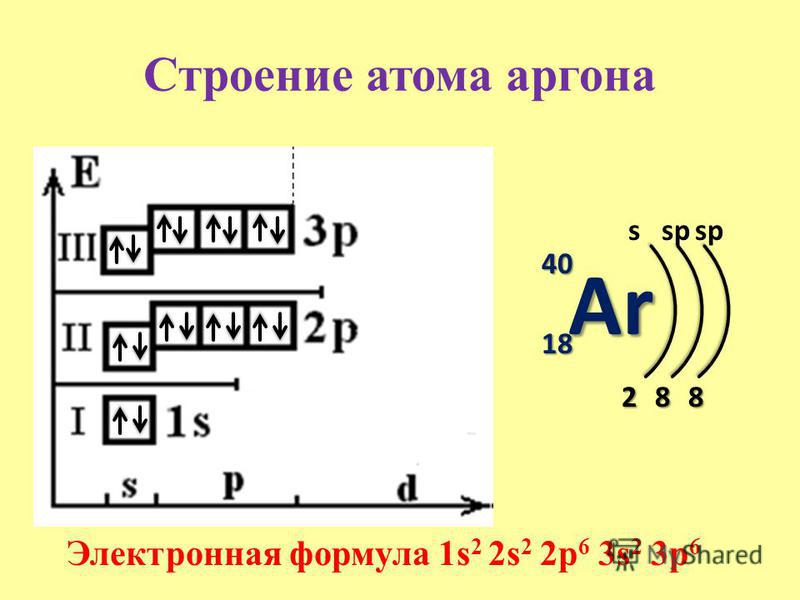
— цирконий – сороковой элемент, распределяем 40 электронов. Цирконий — элемент пятого периода, следовательно, первые четыре энергетических уровня полностью заполнены — 1s22s22p63s23p64s23d104p6.Заполнение пятого уровня начинается с 5s2. Цирконий – второй d – элемент в пятом периоде, значит, он содержит 2 электрона на 4d – подуровне. Итого получаем: 1s22s22p63s23p64s23d104p65s24d2.
В атоме циркония в основном состоянии 2 неспаренных электрона.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. Например, электронные конфигурации хрома и меди вместо 4s23d4 и 4s23d9 имеют вид 4s13d5 и 4s13d10.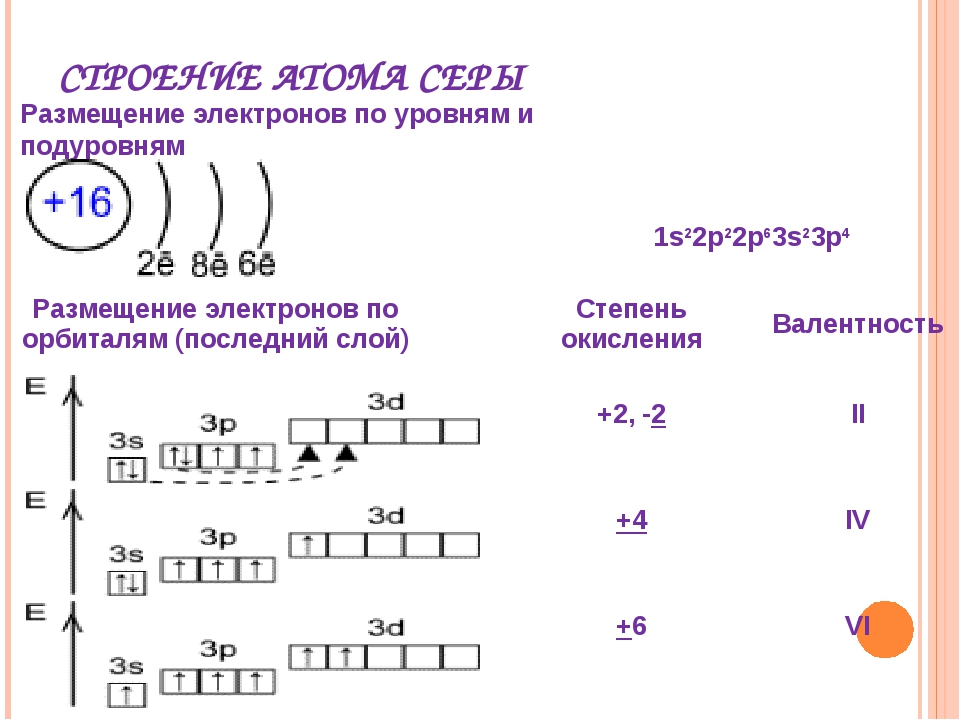
Задания для тренировки:
- Сколько протонов и электронов содержит ион NO2—
1) 46p, 46e
2) 23p, 24e
3) 23р, 23e
4) 46p, 47e - Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом - Укажите атом, в котором больше всего электронов:
1) 2Н
2) 40Аr
3) 41Ar
4) 39К - Изобразить электронно-графическую схему атома хлора в основном и всех возможных возбужденных состояниях. Какие валентности способен проявлять хлор?
- Объяснить, почему сера проявляет валентность VI, а кислород – не проявляет, хотя оба эти элемента содержат по 6 электронов на внешнем слое.
Ты нашел то, что искал? Поделись с друзьями!
Электронное строение атома, схема и примеры
Понятие «атом»
Понятие «атом» знакомо человечеству ещё со времен Древней Греции. Согласно высказыванию древних философов, атом представляет собой мельчайшую частицу, входящую в состав вещества.
Согласно высказыванию древних философов, атом представляет собой мельчайшую частицу, входящую в состав вещества.
Электронное строение атома
Атом состоит из положительно заряженного ядра внутри которого находятся протоны и нейтроны. Вокруг ядра по орбитам движутся электроны, каждый из которых можно охарактеризовать набором из четырех квантовых чисел: главного (n), орбитального (l), магнитного (ml) и спинового (ms или s).
Главное квантовое число определяет энергию электрона и размеры электронных облаков. Энергия электрона главным образом зависит от расстояния электрона от ядра: чем ближе к ядру находится электрон, тем меньше его энергия. Другими словами, главное квантовое число определяет расположение электрона на том или ином энергетическом уровне (квантовом слое). Главное квантовое число имеет значения ряда целых чисел от 1 до бесконечности.
Орбитальное квантовое число характеризует форму электронного облака. Различная форма электронных облаков обусловливает изменение энергии электронов в пределах одного энергетического уровня, т.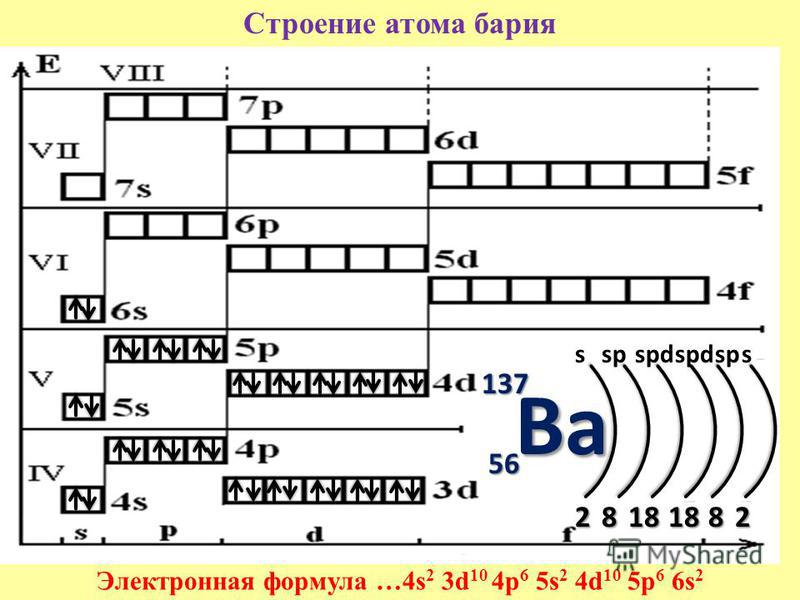 е. расщепление её на энергетические подуровне. Орбитальное квантовое число может имеет значения от нуля до (n-1), всего n значений. Энергетические подуровни обозначают буквами:
е. расщепление её на энергетические подуровне. Орбитальное квантовое число может имеет значения от нуля до (n-1), всего n значений. Энергетические подуровни обозначают буквами:
|
Значение l
|
1
|
2
|
3
|
4
|
5
|
|
Обозначение
|
s
|
p
|
d
|
f
|
h
|
|
Форма
|
шар
|
объемная восьмерка
|
более сложная форма
| ||
Магнитное квантовое число показывает ориентацию орбитали в пространстве.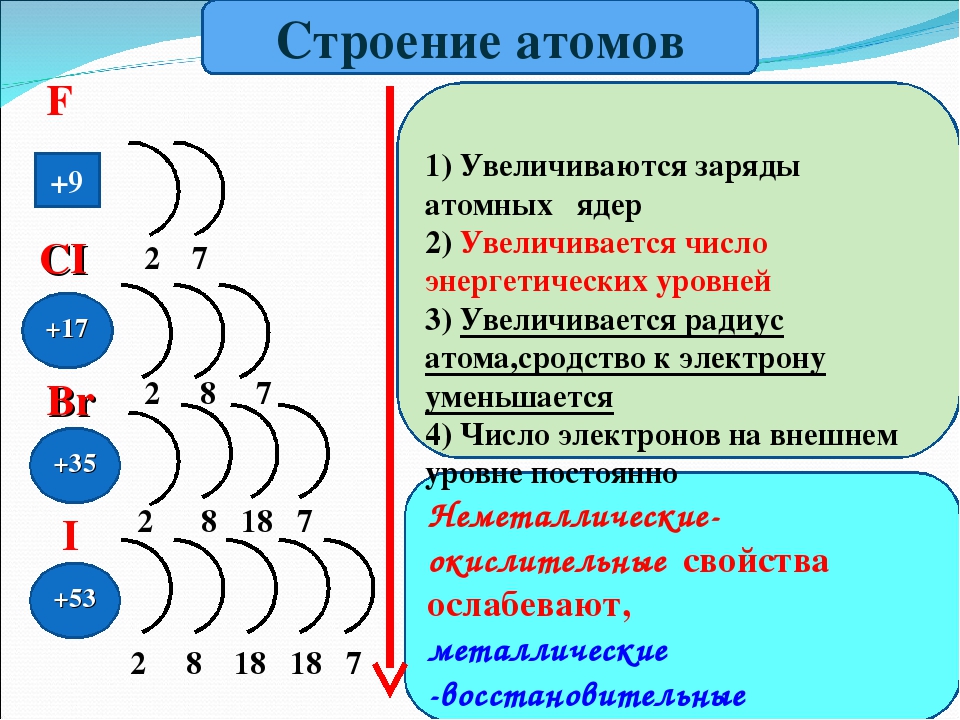 Оно принимает любое целое числовое значение от (+l) до (-l), включая нуль. Число возможных значений магнитного квантового числа равна (2l+1).
Оно принимает любое целое числовое значение от (+l) до (-l), включая нуль. Число возможных значений магнитного квантового числа равна (2l+1).
Электрон, двигаясь в поле ядра атома, кроме орбитального момента импульса обладает также собственным моментам импульса, характеризующим его веретенообразное вращение вокруг собственной оси. Это свойства электрона получило название спина. Величину и ориентацию спина характеризует спиновое квантовое число, которое может принимать значения (+1/2) и (-1/2). Положительное и отрицательное значения спина связаны с его направлением.
До того, как все вышеописанное стало известно и подтверждено экспериментально существовало несколько моделей строения атома. Одна из первых моделей строения атома была предложена Э. Резерфордом, который в опытах по рассеянию α-частиц показал, что почти вся масса атома сосредоточена в очень малом объеме – положительно заряженном ядре. Согласно его модели, вокруг ядра на достаточно большом расстоянии движутся электроны, причем их число таково, что в целом атом электронейтрален.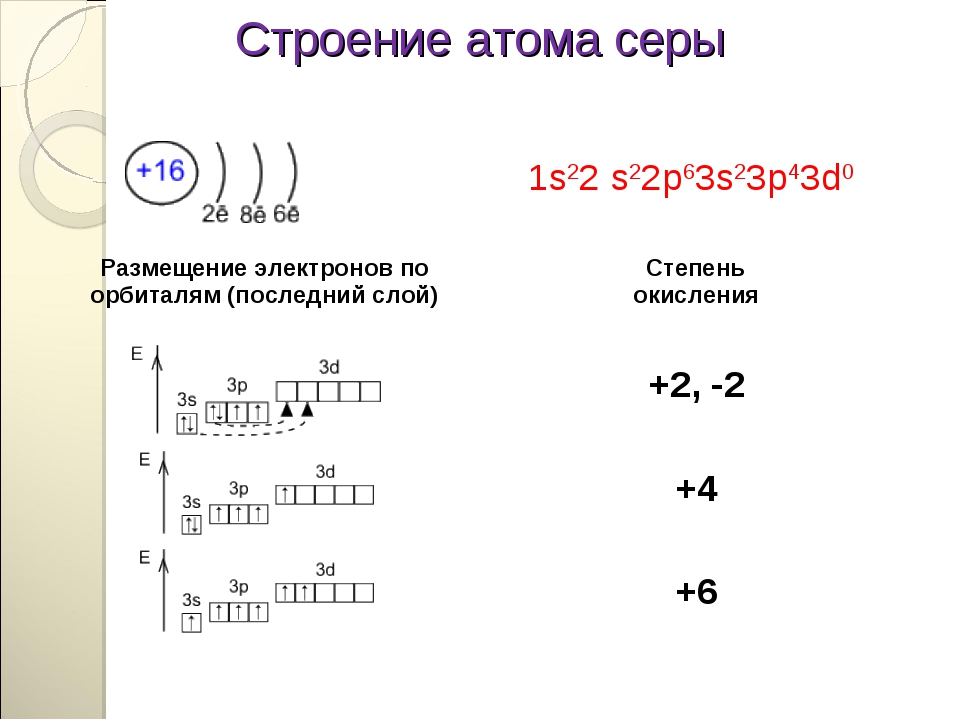
Развивать модель строения атома Резерфорда стал Н. Бор, который в своем исследовании также объединил учения Эйнштейна о световых квантах и квантовую теорию излучения Планка. Завершили начатое и представили миру современную модель строения атома химического элемента Луи де Бройль и Шредингер.
Примеры решения задач
Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов / Справочник :: Бингоскул
Электронная конфигурация атомов
Записать распределение электронов по энергетическим уровням можно несколькими способами.
Запись по электронным оболочкам (схема электронного строения)
Показывает заряд ядра и количество электронов на каждом энергетическом уровне.
Легче всего начинать с неё, потому что она показывает структуру атома «крупным планом».
Запись с обозначением энергетических уровней и подуровней
Каждая орбиталь обозначается квадратной ячейкой. Электрон обозначается стрелкой.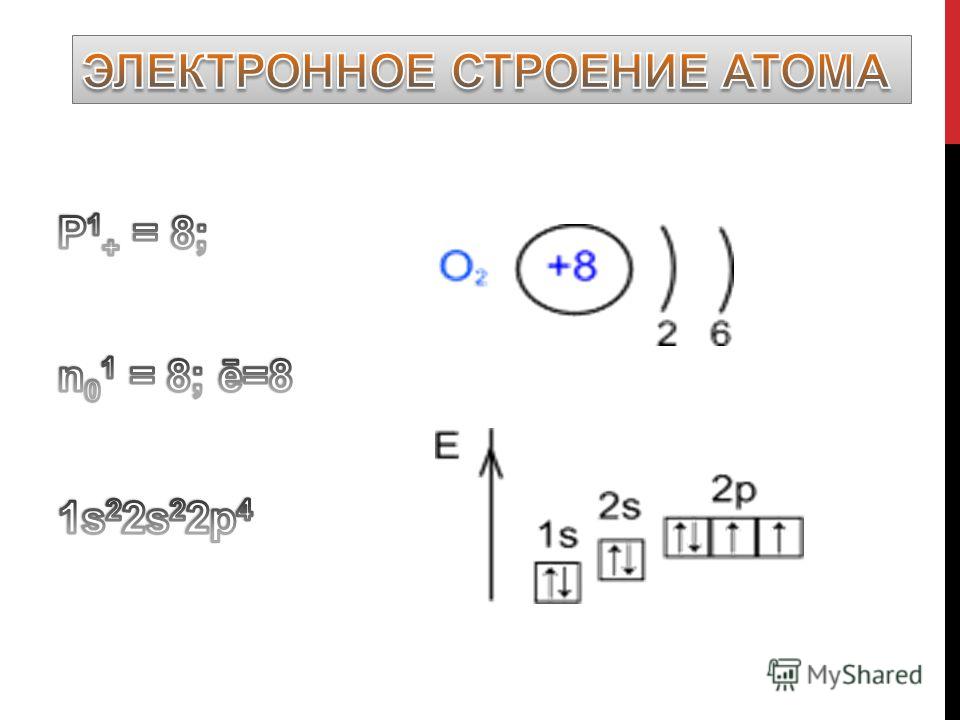 Различное направление стрелок указывает на противоположные спины.Под ячейкой подписывают номер энергетического уровня, буквенное обозначение орбитали и количество электронов на ней.
Различное направление стрелок указывает на противоположные спины.Под ячейкой подписывают номер энергетического уровня, буквенное обозначение орбитали и количество электронов на ней.
Буквенно-числовое обозначение такого «адреса» электрона – это электронная формула. Электронная конфигурация – это электронная формула, которая показывает распределение электронов по энергетическим уровням.
Электронная конфигурация атомов 1 и 2 периодов
Электронная конфигурация атомов 3 периода
Строение электронных оболочек атомов элементов третьего периода
Электронная конфигурация атомов 4 периода
Заполнение орбиталей атомов 4 периода имеет свои особенности.
На движение электрона влияют поле ядра и поле других электронов. Поэтому в атомах с большим количеством электронов энергия электрона определяется главным и орбитальным квантовыми числами.
Здесь уже надо смотреть на сумму обоих квантовых чисел (n+l). Если для двух подуровней эта сумма равна: 3d, 4p, 5s (n+l=5), то сначала заполняются уровни с меньшими значениями n. То есть последовательность заполнения будет следующей: 3d – 4p – 5s.
Если для двух подуровней эта сумма равна: 3d, 4p, 5s (n+l=5), то сначала заполняются уровни с меньшими значениями n. То есть последовательность заполнения будет следующей: 3d – 4p – 5s.
Поэтому в 4 периоде сначала заполняется подуровень 4s, а потом подуровень 3d.
Есть ещё одна особенность, которая появляется в 4 периоде. Хром и медь имеют на 4s-орбитали по одному электрону. Всё дело в заполнении d-оболочек. Полузаполненные или заполненные d-оболочки устойчивее частично заполненных. В атоме хрома на каждой из 5 3d-орбиталей есть по одному электрону. В атоме меди на каждой на каждой 3d-орбитали есть по два электрона.
Алгоритм записи электронной конфигурации атома
- По порядковому номеру химического элемента в таблице Менделеева определяем количество электронов в атоме.
- Распределяем электроны по энергетическим уровням, то есть составляем схему электронного строения.
- Выписываем s-, p-, d-подуровни в каждом энергетическом уровне.
- Заполняем подуровни электронами: сначала по одному электрону на орбиталь, потом достраиваем электронные пары.

Электронная конфигурация ионов
Электронная конфигурация ионов составляется по тем же принципам. Нужно учитывать изменения количества электронов на внешнем энергетическом уровне.
Атом электронейтрален, то есть сколько протонов ядре, столько же электронов в атоме. Если атом принимает электроны, он становится отрицательно заряженным ионом (анионом), если отдаёт электроны – положительно заряженным ионом (катионом).
Атому легче всего отдать электроны внешнего энергетического уровня, «чужие» электроны он тоже примет на внешний энергетический уровень. На внешнем энергетическом уровне не может находиться более 8 электронов. Теория «октета» была предложена в 1916 году Гилбертом Ньютоном Льюисом и Вальтером Косселем
Атом «стремится» добрать электроны на внешний уровень или избавиться от них, поэтому и становится ионом. Полное заполнение s- и p-подуровней внешнего уровня придаёт атому стабильность. Только атом гелия имеет на единственном внешнем энергетическом уровне 2 электрона, а не 8, потому что первый энергетический уровень состоит только из одной s-орбитали.
Количество электронов на внешнем энергетическом уровне определяется по таблице Менделеева. У элементов главных подгрупп номер группы – это и есть количество электронов на внешнем уровне. У элементов побочных подгрупп количество электронов на внешнем уровне не больше двух.
Основное и возбуждённое состояния атома
На первый взгляд кажется, что атом хлора может образовывать только одну связь и соединения одного типа – например, хлориды. Но откуда берутся хлорная, хлорноватая, хлористая и хлорноватистая кислоты?
Дело в том, что атом можно перевести из основного состояния в возбуждённое.
Основное состояние – это состояние атома с наименьшей энергией. Атом обладает наименьшей энергией в основном состоянии. Но если ему передать дополнительную энергию, он перейдёт в возбуждённое состояние. Электроны перейдут на уровень или подуровень с большей энергией.
Сначала разрываются электронные пары на 3p-подуровне, электроны переходят на 3d-подуровень. Если атом хлора получит ещё больше энергии, спаренный электрон покинет даже 3s-орбиталь и перейдёт на 3d-подуровень.
Если атом хлора получит ещё больше энергии, спаренный электрон покинет даже 3s-орбиталь и перейдёт на 3d-подуровень.
Благодаря этому атом хлора может образовывать больше химических связей. Затраты энергии, потраченные на распаривание электронов, окупаются при образовании новых химических связей.
Но в возбуждённое состояние могут перейти атомы, у которых есть неспаренные электроны и свободные орбитали. Длится возбуждённое состояние недолго: атом отдаст энергию и вернётся в основное состояние. Хотя если сообщить атому слишком много энергии, электрон покинет его и атом станет ионом.
Смотри также:
s-, p-, d-элементы / Справочник :: Бингоскул
Тема строения атома – это место встречи химии и квантовой физики. В атоме всё подчиняется строгим законам, но в то же время атом не совсем понятен для человеческого ума. Например, количество электронов строго равно количеству протонов, но невозможно точно сказать, в каком месте атома находится электрон.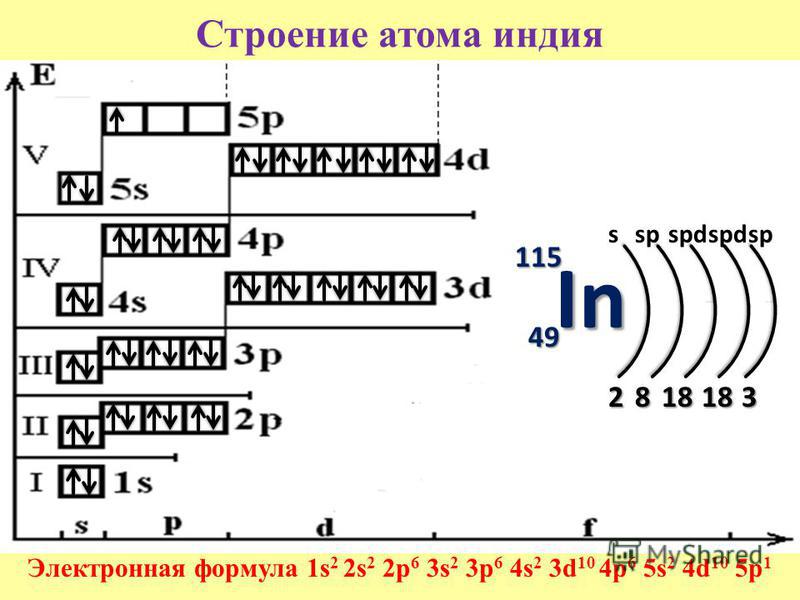 Шрёдингер рассматривал электрон как облако с отрицательным зарядом. Большинство своего времени электрон в отдельном участке атома – орбитали.
Шрёдингер рассматривал электрон как облако с отрицательным зарядом. Большинство своего времени электрон в отдельном участке атома – орбитали.
Все электроны в атоме расположены на своём расстоянии от ядра – в электронной оболочке. Электрон не может приблизиться к ядру, но и отдалиться тоже не может. Дело в том, что у электрона есть свой запас энергии. Чем её меньше, тем ближе от ядра располагается электрон. Электроны с одинаковым уровнем энергии группируются в один слой – энергетический уровень.
Главное квантовое число и энергетический уровень
Квантовые числа — это своеобразный код записи положения электрона в атоме. Если сравнить атом с домом, то квантовые числа – это адрес электрона: этаж, квартира, комната.
Электроны в атоме сосредоточены на энергетических уровнях – «этажах». Их нумеруют числами 1, 2, 3, … или буквами K, L, M, N, O, P, Q. Главное квантовое число n – это и есть номер энергетического уровня.
С удалением от ядра число электронов возрастает. Чем выше энергетический уровень, тем больше электронов на нём находится. Их максимальное число для каждого уровня определяется по формуле:
Чем выше энергетический уровень, тем больше электронов на нём находится. Их максимальное число для каждого уровня определяется по формуле:
N = 2n2
- N – максимальное число электронов
- n – номер уровня (главное квантовое число)
На внешнем энергетическом уровне не может находиться больше 8 электронов.
В энергетических уровнях также выделяют подуровни. Их количество также соответствует главному квантовому числу. Это напоминает расположение квартир в доме: на первом этаже располагается одна квартира, на втором – две, на третьем – три и т.д.
| Номер уровня (n) и его буквенное обозначение | Количество подуровней | Максимальное количество электронов на уровне |
| 1 К | 1 (s) | 2 |
| 2 L | 2 (s, p) | 8 |
| 3 M | 3 (s, p, d) | 18 |
| 4 N | 4 (s, p, d, f) | 32 |
Орбитальное (побочное), магнитное квантовые числа и форма орбитали
Конкретное место в атоме, «комната», в которой почти постоянно находится электрон, называется орбиталью. Орбитали напоминают облака разной формы из электронов. Подуровни и форму орбиталей обозначают латинскими буквами: s, p, d, f.
Орбитали напоминают облака разной формы из электронов. Подуровни и форму орбиталей обозначают латинскими буквами: s, p, d, f.
Эту схему предложил Бор, она помогает разобраться в строении атома, но не отражает реальной картины. Наши представления об атоме расходятся с реальностью. И выглядит это примерно так:
На первом энергетическом уровне есть только сферическая s-орбиталь. На втором энергетическом уровне появляются три p-орбитали. Их форма напоминает гантель или восьмёрку. На третьем энергетическом уровне уже есть пять d-орбиталей, которые как бы состоят из нескольких лепестков. На четвёртом уровне возникают семь f-орбиталей.
Форму орбиталей обозначают орбитальным (побочным) квантовым числом l (эль). Оно на единицу меньше главного квантового числа, то есть l = n – 1. Тогда получается, что орбитальное число единственной s-орбитали первого энергетического уровня равно нулю. Орбиталь p имеет число 1, орбиталь d – 2, f – 3.
Но как же располагаются орбитали внутри одного подуровня? Дело в том, что движущийся электрон создаёт магнитное поле, в котором по осям x, y, z ориентируются орбитали.
Сферическая s-орбиталь не имеет ориентации в пространстве. Три p-орбитали располагаются в трёх различных проекциях, d – в пяти, f – в семи проекциях. Другими словами, сколько орбиталей одного типа, столько и проекций.
Магнитное квантовое число ml показывает, какие проекции есть у орбитали. Количество таких вариантов определяется по формуле 2l+1.
Для s-орбитали l = 0 и ml = 0, так и получается, что сфера принимает только одно положение в пространстве.
Для p-орбитали l = 1, ml принимает три значения -l, 0, +l. При l = 3, магнитный момент принимает семь (2l + 1 = 7) значений: -3, -2, -1, 0, +1, +2, +3.
| Орбитально квантовое число I | Магнитное квантовое число II | Число орбиталей 2l + 1 |
| 0 (s) | 0 | 1 |
| 1 (p) | -1, 0, 1 | 3 |
| 2 (d) | -2, -1, 0, 1, 2 | 5 |
| 3 (f) | -3, -2, -1, 0, 1, 2, 3 | 7 |
Спин электрона
Еще два квантовых числа – спиновое и проекция спина – характеризуют уникальное квантовое свойство электрона. Спин не имеет аналогов в классической механике. Можно представить, что электрон вращается вокруг своей оси в одну или другую сторону.
Спин не имеет аналогов в классической механике. Можно представить, что электрон вращается вокруг своей оси в одну или другую сторону.
Квантовые числа
| Главное квантовое число | n = 1, 2, 3, … | Определяет общую энергию электрона на данной орбитали. |
| Орбитальное (побочное) квантовое число | l (любое целое число от 0 до n-1, где n — главное квантовое число. | Показывает различия в энергетическом состоянии электронов внутри одного уровня. Форма атомной орбитали. |
| Магнитное квантовое число | ml = от -1 до +1, включая 0, т.е. (2l + 1) значений. | Ориентация орбитали в пространстве. |
| Спиновое квантовое число | m | |
| Проекция спина | ms | Показывает направление вращения электрона в атоме |
В атомах первого периода таблицы Менделеева есть один энергетический уровень. В нём один или два электрона движутся по s-единственной орбитали.
В нём один или два электрона движутся по s-единственной орбитали.
В атомах второго периода появляется второй уровень. Он состоит из s-и p-подуровней. Второй s-подуровень – это тоже s-орбиталь, на p-подуровне есть три орбитали, которые по-разному расположены в пространстве. Каждая p-орбиталь вмещает 1 или 2 электрона, поэтому максимально на p-подуровне их может быть 6.
В атомах третьего периода появляется d-подуровень с пятью d-орбиталями, в атомах четвёртого периода – f-подуровень с семью f-орбиталями.
Как заполняются орбитали?
Электроны заполняют орбитали в соответствии с 3 принципами (правилами).
- Принцип минимума энергии. Электрон «стремится» занять положени в атоме с наименьшей энергией. То есть электроны сначала «заселяют» низкоэнергетические орбитали. Рейтинг желаемых орбиталей выглядит так: 1s22s22p63s23p64s23d104p65s24d105р66s25d14f14.
 ..
..
Как будто электроны сначала выбирают малозаселённые этажи с небольшим количеством квартир. - Принцип Паули. В атоме не может быть двух электронов с одинаковыми свойствами. То есть на каждой орбитали может находиться либо один неспаренный электрон, либо два электрона с разными спинами. Это похоже на дорогу с двусторонним движением: либо едет один автомобиль, либо два, но навстречу друг другу.
- Правило Хунда. Наиболее устойчивое (основное) состояние атома достигается тогда, когда на одном уровне находится как можно больше неспаренных электронов. Можно провести такую аналогию: электроны сначала селятся по одному, а потом ищут себе пару.
Смотри также:
Конспект «Строение электронных оболочек атомов»
«Строение электронных оболочек атомов»
Ключевые слова конспекта: строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева, завершенный электронный слой, валентный слой, энергетические уровни, правило октета, орбиталь,
Электронная оболочка атома — это все электроны атома.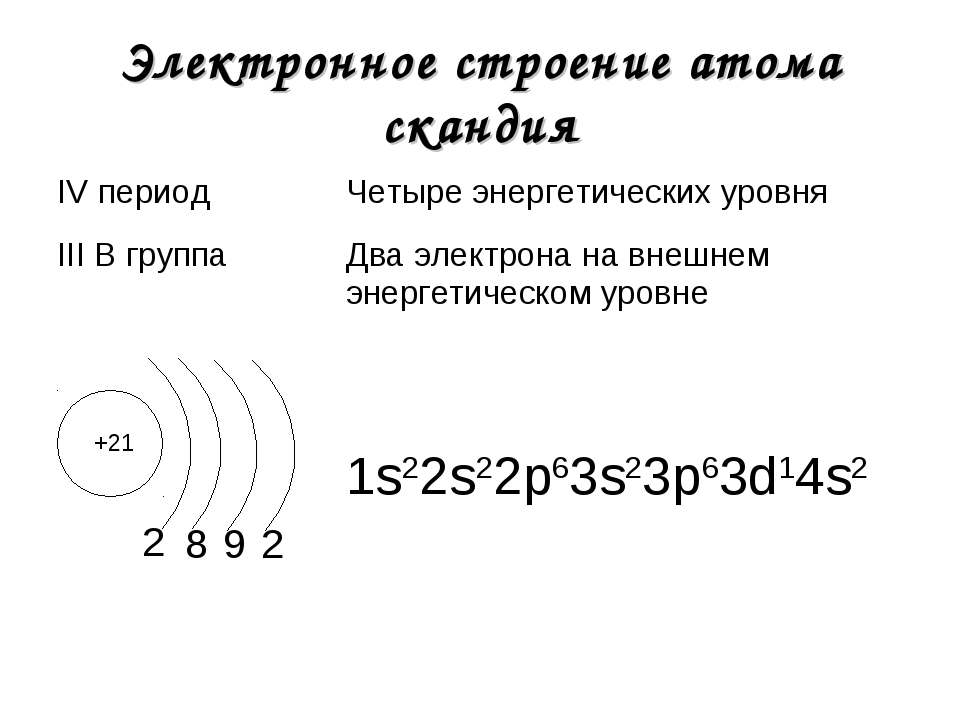 Электроны в электронной оболочке атома расположены слоями. Электроны в разных слоях различаются энергией взаимодействия с ядром атома. Чем дальше от ядра находится электрон, тем меньше энергия его взаимодействия с ядром.
Электроны в электронной оболочке атома расположены слоями. Электроны в разных слоях различаются энергией взаимодействия с ядром атома. Чем дальше от ядра находится электрон, тем меньше энергия его взаимодействия с ядром.
Вместимость электронных слоев различная. В слое № 1, или в первом слое, у всех элементов, кроме водорода, находится 2 электрона. (В атоме водорода всего 1. электрон, и он — в первом слое.) Во втором слое может находиться не больше восьми электронов. В третьем слое максимально может расположиться 18 электронов. В четвертом слое максимально бывает 32 электрона.
Если N — максимальное число электронов на электронном слое с номером n, то для определения числа N можно воспользоваться формулой N = 2n2.
Завершенный электронный слой — это слой в атоме, содержащий максимально возможное для него число электронов.
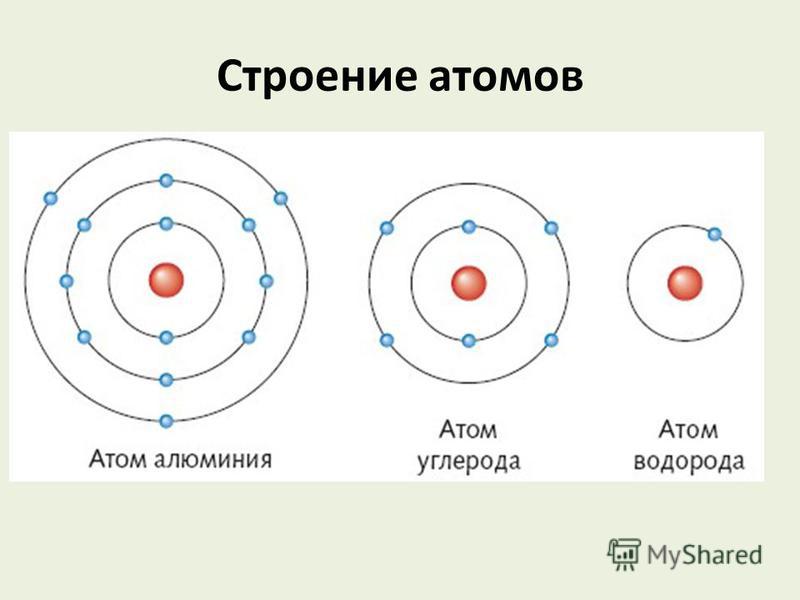
Электронные слои заполняются так: сначала первый, потом второй и последующие — по мере уменьшения энергии их взаимодействия с ядром. Расположение по слоям электронов в атомах водорода, кислорода и магния:
Число электронных слоев атома равно номеру периода химического элемента в таблице Менделеева. Поэтому у атома водорода один электронный слой, у кислорода — два слоя, а у магния — три слоя.
Валентный слой — это внешний электронный слой. У водорода это 1-й слой, у кислорода — 2-й слой, у магния — 3-й слой. Валентные электроны — это электроны внешнего слоя. Внешний слой всегда содержит не больше восьми электронов. Восьми-электронный внешний слой характеризуется повышенной устойчивостью. (Это — «правило октета».)
Зная максимальное число электронов в каждом электронном слое атома, можно составить схему расположения электронов по слоям в заданном элементе. Электронные слои атомов называют энергетическими уровнями.
Химические свойства атомов определяются свойствами их электронов. Движение электронов в атоме описывают с привлечением понятия орбитали. Каждый электрон в атоме находится на своей орбитали.
Орбиталь — это часть электронного облака, создаваемого электронами при движении в атоме. Орбиталь — это пространство около ядра, где чаще всего находится электрон.
Электроны первых 30 химических элементов от водорода до цинка размещены на орбиталях трех видов — s, р и d. Вместимость любой орбитали — два электрона. На 1-м энергетическом уровне одна s-орбиталь.
Таблица. Строение электронных оболочек атомов
первых 20 элементов Периодической системы Д.И. Менделеева
Приведем некоторые сведения, которые следуют из электронной формулы атома на примере атома фтора: F 1s2 2s2 2р5.
Фтор — элемент 2-го периода, т.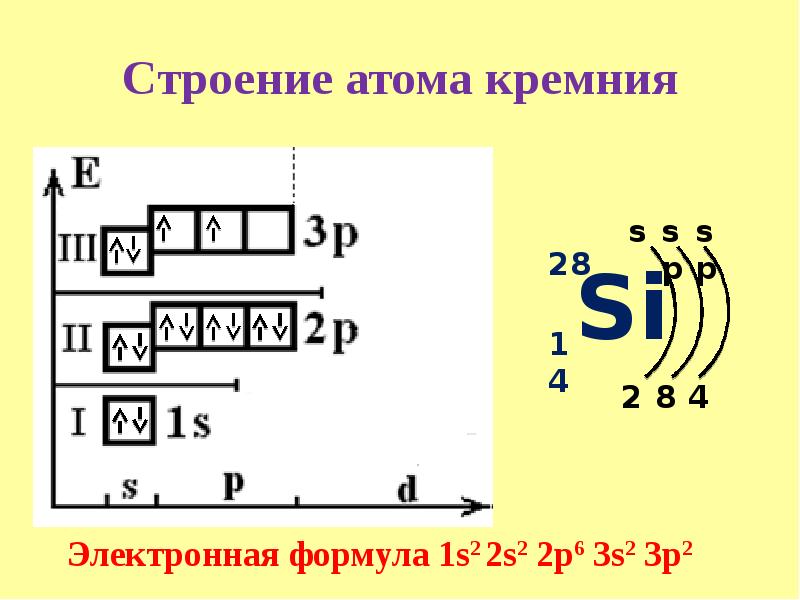 к. в его электронной формуле два электронных слоя. Сумма всех надстрочных индексов — 9 (общее число электронов), это и атомный номер фтора. Элементы, у которых очередные электроны помещаются на s- и р-орбиталях, относятся к главным подгруппам таблицы Менделеева. Сумма электронов 2-го внешнего слоя дает номер группы — VII.
к. в его электронной формуле два электронных слоя. Сумма всех надстрочных индексов — 9 (общее число электронов), это и атомный номер фтора. Элементы, у которых очередные электроны помещаются на s- и р-орбиталях, относятся к главным подгруппам таблицы Менделеева. Сумма электронов 2-го внешнего слоя дает номер группы — VII.
Конспект урока «Строение электронных оболочек атомов».
Следующая тема: «».
Структура атома
Атомное и электромагнитное излучение
Фундаментальный субатомный
Частицы
| Частица | Обозначение | Заряд | Масса | |
| электрон | e — | -1 | 0.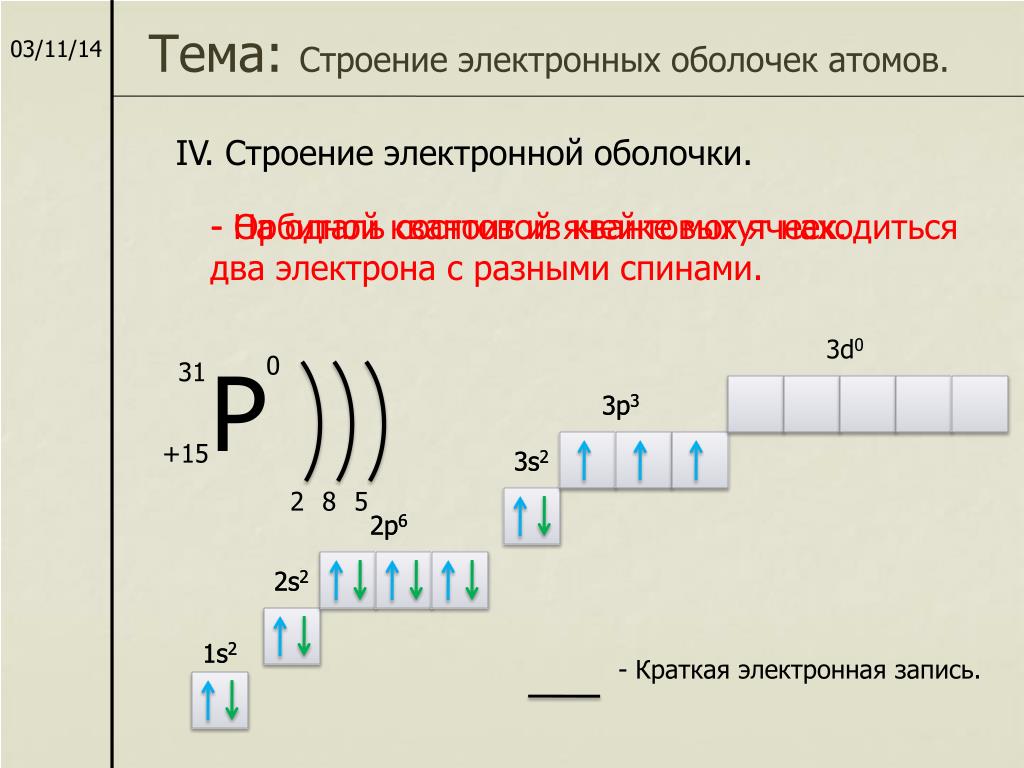 0005486 а.е.м. 0005486 а.е.м. | |
| протон | п + | +1 | 1,007276 а.е.м. | |
| нейтрон | n o | 0 | 1,008665 аму | |
Число протонов, нейтронов и электронов в атоме может
определяться из набора простых правил.
- Количество протонов в ядре атома равно
к атомному номеру ( Z ). - Число электронов в нейтральном атоме равно
к числу протонов. - Массовое число атома ( M ) равно
сумма количества протонов и нейтронов в ядре. - Количество нейтронов равно разнице между
массовое число атома ( M ) и атомное
номер ( Z ).
Примеры: Определим количество протонов, нейтронов и
электроны в следующих изотопах.
| 12 С | 13 С | 14 С | 14 № |
Различные изотопы элемента обозначаются письмом.
массовое число атома в верхнем левом углу
символ элемента. 12 C, 13 C и 14 C
являются изотопами углерода ( Z = 6) и поэтому содержат шесть
протоны. Если атомы нейтральны, они также должны содержать шесть
электроны. Единственная разница между этими изотопами — это
количество нейтронов в ядре.
12 C: 6 электронов, 6 протонов и 6
нейтроны
13 C: 6 электронов, 6 протонов и 7
нейтроны
14 С:
6 электронов, 6 протонов и 8 нейтронов
Электромагнитный
Радиация
Многое из того, что известно о структуре электронов в
атом был получен путем изучения взаимодействия между
материя и различные формы электромагнитного излучения . Электромагнитное излучение обладает некоторыми свойствами как
Электромагнитное излучение обладает некоторыми свойствами как
частица и волна.
Частицы имеют определенную массу и занимают пространство. Волны
не имеют массы, но при этом несут энергию, путешествуя через
Космос. Помимо способности переносить энергию, волны имеют
четыре других характерных свойства: скорость, частота,
длина волны и амплитуда. Частота ( v ) — это
количество волн (или циклов) в единицу времени.Частота
волна сообщается в единицах циклов в секунду (с -1 )
или герц (Гц).
Идеализированный рисунок волны на рисунке ниже
иллюстрирует определения амплитуды и длины волны. Длина волны
( l ) — наименьшее расстояние между повторяющимися точками на
волна. Амплитуда волны — это расстояние
между самой высокой (или самой низкой) точкой волны и центром
силы тяжести волны.
Если мы измерим частоту ( v ) волны в циклах на
секунды и длины волны ( l ) в метрах, произведение
эти два числа имеют единицы измерения в метрах в секунду. Продукт
Продукт
частоты ( v ), умноженной на длину волны ( l )
волна — это скорость ( с ), с которой волна распространяется
через пространство.
vl = с
Легкие и другие формы
Электромагнитное излучение
Свет — это волна с электрическими и магнитными
составные части.Следовательно, это форма электромагнитных
радиация .
Видимый свет содержит узкую полосу частот и
длины волн в той части электромагнитного спектра, которая
наши глаза могут обнаружить. Он включает излучение с длинами волн
примерно от 400 нм (фиолетовый) до 700 нм (красный). Потому что это
волна, свет искривляется, когда попадает в стеклянную призму. Когда белый
свет сфокусирован на призме, световые лучи разных
длины волн изгибаются на разную величину, и свет
превращается в спектр цветов.Начиная со стороны
спектр, в котором свет отклоняется на наименьший угол,
цвета — красный, оранжевый, желтый, зеленый, синий и фиолетовый.
Как видно из следующей диаграммы, переносимая энергия
светом увеличивается по мере перехода от красного к синему в видимом
спектр.
Поскольку длина волны электромагнитного излучения может быть как
длиной от 40 м до 10 -5 нм, видимая
спектр — лишь небольшая часть всего диапазона
электромагнитное излучение.
Электромагнитный спектр включает радио и телевизионные волны,
микроволны, инфракрасный, видимый свет, ультрафиолет, рентгеновские лучи, g-лучи,
и космические лучи, как показано на рисунке выше. Эти разные
все формы излучения распространяются со скоростью света ( c ).
Однако они различаются по частоте и длине волны. В
произведение частоты на длину волны электромагнитного
излучение всегда равно скорости света.
vl = c
В результате электромагнитное излучение
длинноволновый, имеет низкую частоту, а излучение
с высокой частотой имеет короткую длину волны.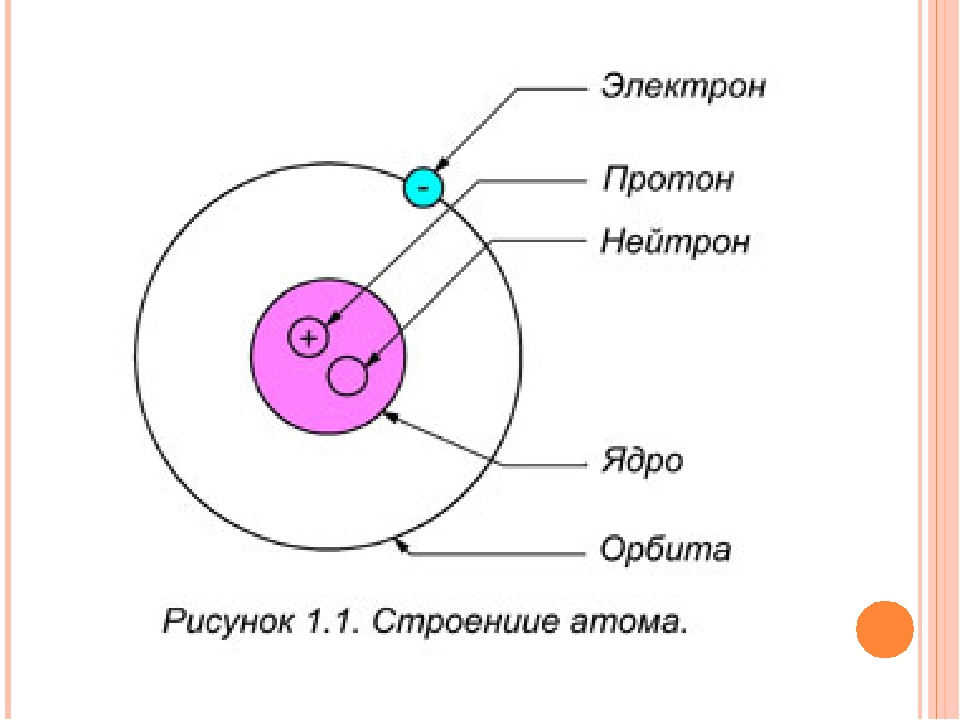
Chem4Kids.com: Атомы: структура
Атомы — основа химии. Они являются основой всего во Вселенной. Как известно, материя состоит из атомов. Твердые тела состоят из плотно упакованных атомов, а газы — из рассредоточенных атомов. Мы собираемся охватить такие основы, как атомная структура и связь между атомами. По мере того, как вы узнаете больше, вы можете перейти к страницам реакций и биохимии и увидеть, как атомы образуют соединения, которые помогают выжить биологическому миру.
Существуют ли куски материи меньше атомов? Конечно, есть. Внутри кусков атомов можно найти сверхмалые частицы. Эти субатомные частицы включают нуклонов и кварков . Химики-ядерщики и физики работают вместе на ускорителях частиц , чтобы обнаружить присутствие этих крошечных, крошечных кусочков материи. Однако наука основана на атоме, потому что это мельчайшая отдельная единица материи.
Несмотря на то, что существует множество сверхмалых атомных частиц, вам нужно помнить только о трех основных частях атома: электронах, протонах и нейтронах.Что такое электроны, протоны и нейтроны? Электроны — самые маленькие из трех частиц, составляющих атомы. Электроны находятся в оболочках или орбиталях, окружающих ядро атома. Протоны и нейтроны находятся в ядре . Они группируются вместе в центре атома. Это все, что вам нужно запомнить. Три легких штуки!
В периодической таблице около 120 известных элементов. (117, пока мы пишем это) Химики и физики каждый день пытаются создавать новые в своих лабораториях.Атомы разных элементов имеют разное количество электронов, протонов и нейтронов. Каждый элемент уникален и имеет атомный номер. Это число говорит вам количество протонов в каждом атоме элемента. Атомный номер также называют числом протона.
Вы можете видеть, что каждая часть атома помечена знаком «+», «-» или «0». Эти символы относятся к заряду частицы.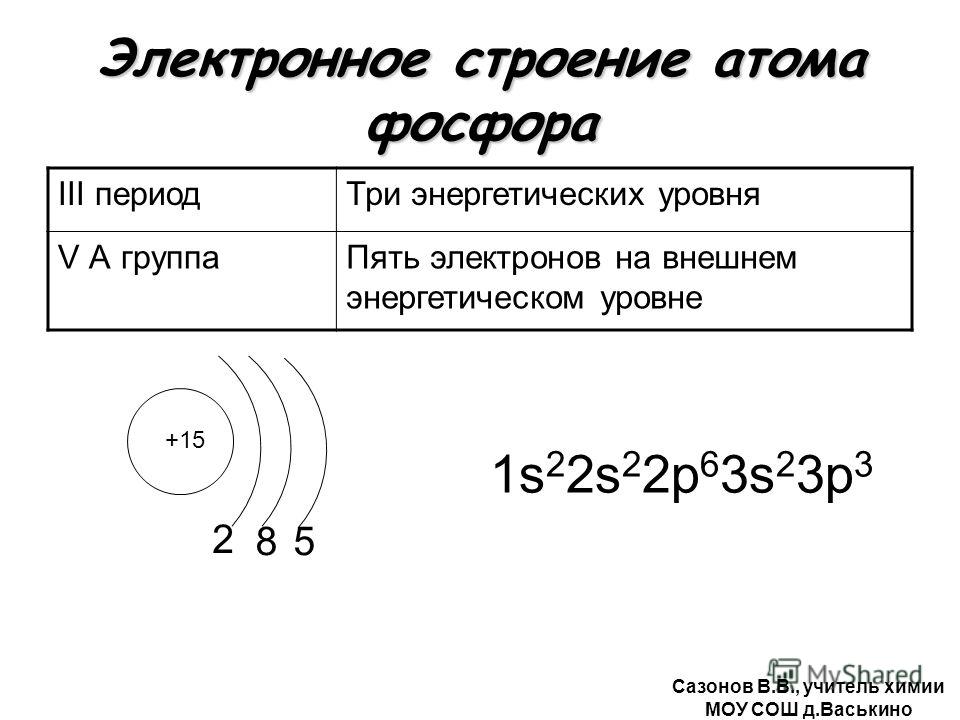 Вы когда-нибудь слышали о поражении электрическим током от розетки, статическом электричестве или молнии? Все это связано с электрическими зарядами.Заряды также находятся в крошечных частицах вещества.
Вы когда-нибудь слышали о поражении электрическим током от розетки, статическом электричестве или молнии? Все это связано с электрическими зарядами.Заряды также находятся в крошечных частицах вещества.
Электрон всегда имеет «-» или отрицательный заряд. Протон всегда имеет «+» или положительный заряд. Если заряд всего атома равен «0» или нейтрален, имеется равное количество положительных и отрицательных зарядов. Нейтральные атомы имеют равное количество электронов и протонов. Третья частица — нейтрон. Он имеет нейтральный заряд, также известный как нулевой заряд.
Поскольку количество протонов в атоме не меняется, меньшее количество или больше электронов могут создать особый атом, называемый ионом. Катионы имеют меньше электронов и положительный заряд. Анионы имеют дополнительные электроны, которые создают отрицательный заряд.
Самая маленькая письменность в мире (видео Стэнфордского университета)
структура атома для классов 9 и 11
что такое атом?
«Атом — мельчайшая частица элемента, обладающего уникальными характеристиками этого элемента». Вся материя состоит из атомов, все атомы состоят из электронов, протонов и нейтронов, кроме обычного водорода, у которого нет нейтрона.Каждый элемент в периодической таблице имеет уникальную атомную структуру, и все атомы в данном элементе имеют одинаковое количество протонов. Сначала это считалось крошечной неделимой сферой. Позже было показано, что атом не был отдельной частицей. но он состоял из небольшого плотного ядра, вокруг которого электроны вращаются на больших расстояниях от ядра, подобно тому, как планеты вращаются вокруг Солнца. Нильс Бор предположил, что электроны в атоме вращаются вокруг ядра по разным орбитам, подобно тому, как планеты вращаются вокруг Солнца в нашей солнечной системе.Модель Бора часто называют планетарной моделью. Другой взгляд на атом, называемый квантовой моделью, считается более точным представлением, но его трудно визуализировать. Для большинства практических целей в электронах достаточно модели Бора, которая обычно используется. потому что это легко визуализировать.
Наше тело также состоит из нескольких триллионов атомов. Греческий философ Демокрит впервые дал идею атома. Затем, в 19 веке, Джон Далтон из Англии представил первую модель атома.По его словам, вся материя состоит из атомов. Атомы нельзя ни создать, ни уничтожить.
Структура атомных частиц
Есть ли частица меньше атома? Конечно, есть. Атомы состоят из еще более мелких частиц, называемых электронами, протонами и нейтронами. Центральная часть атома называется ядром. Протоны и нейтроны присутствуют в ядре.
Электроны
Электроны вращаются вокруг ядра, и электроны имеют отрицательный заряд.Его масса крайне мала.
Протоны
Протон имеет положительный заряд. Число протонов в атоме равно количеству электронов, вращающихся вокруг ядра. Его масса в 1837 раз больше массы электрона.
Нейтрон
Нейтрон не имеет заряда. Эта нейтральная частица также находится в ядре. Масса нейтрона почти равна массе протона.
Какой заряд на ядре?
Ядро имеет положительный заряд, потому что оно состоит из протонов и нейтронов, заряд на протоне положительный, а на нейтроне нейтральный, что означает, что нейтрон не имеет заряда.Таким образом, ядро имеет положительный заряд за счет протонов.
Почему атом нейтрален?
Хотя электроны и протоны в атоме имеют заряды, но он не имеет заряда. В атоме количество протонов равно количеству электронов. В результате общий положительный заряд протонов уравновешивает общий отрицательный заряд электроны, поэтому атом нейтрален.
Модель Бора:
Атом — самая маленькая частица элемента, которая сохраняет характеристики этого элемента.Каждый из известных 118 элементов имеет атомы, которые отличаются от атомов всех других элементов. Это придает каждому элементу уникальную атомную структуру. Согласно классической модели Бора, атом имеет планетарный тип структуры, которая содержит центральное ядро, окруженное вращаются вокруг электронов. Ядро состоит из положительно заряженных частиц, называемых протонами, и незаряженных частиц, называемых нейтронами. Основные частицы с отрицательным зарядом называются электронами.
Нилс Хенрик Давид Бор (7 октября 1885 — 18 ноября 1962) был датским физиком, который внес важный вклад в понимание структуры атома и квантовой механики, постулировав планетарную модель атома.Он получил Нобелевскую премию по физике в 1922 году. Бор опирался на эту работу или сотрудничал с такими учеными, как Далтон, Томсон и Резерфорд, среди прочих, и был описан как один из самых влиятельных физиков 20-го века.
Разница между атомным номером и атомной массой с примерами
Атомный номер
Все элементы расположены в периодической таблице элементов в порядке их атомного номера. Атомный номер равен количеству протонов в ядре, то есть такое же, как количество электронов в электрически сбалансированном нейтральном атоме.Например, водород имеет атомный номер 1, а гелий — 2 атомный номер. В своем нормальном или (нейтральном) состоянии все атомы данного элемента имеют такое же количество электронов, что и протоны; положительные заряды нейтрализуют отрицательные заряды, Чистый заряд атома равен нулю. Атомный номер обозначен буквой (Z).
Массовое число (атомная масса)
Сумма протонов и нейтронов в ядре называется его массовым числом и обозначается буквой A. У атома водорода в ядре только один протон, его массовое число также равно 1.Углерод состоит из 6 протонов и 6 нейтронов, а его массовое число равно 12. Мы можем использовать атомные и массовые числа, чтобы найти количество нейтронов в атомах.
Массовое число (A) = Число протонов (z) + Число нейтронов
Электронов в оболочках
Мы знаем, что электроны вращаются вокруг ядра атома. Пути движения электронов вокруг ядра называются оболочками. распределены по разным оболочкам. Оболочки также называются уровнями энергии. Эти оболочки обозначаются буквами K, L, M, N, O, P, Q и т. д.K — это первая оболочка. Мы можем рассчитать количество электронов в оболочке по формуле:
Ne = 2n²
Где «n» — номер оболочки.
Максимальное количество электронов можно рассчитать в 1-й (k) оболочке как:
Ne = 2 (1) ² = 2
Максимальное количество электронов во 2-й (L) оболочке можно рассчитать как:
Ne = 2 (2) ² = 8
Максимальное количество электронов может быть рассчитано в 3-ей (M) оболочке как:
Ne = 2 (3) ² = 18
Максимальное количество электронов можно рассчитать в 4-й ( N) оболочки как:
Ne = 2 (4) ² = 32
Максимальное количество электронов в 5-й (O) оболочке можно рассчитать как:
Ne = 2 (5) ² = 50
И так далее для следующих оболочек…
Почему атомы соединяются с другими атомами?
Атомы объединяются с другими атомами, но они перестают реагировать с другими атомами (становятся стабильными), когда их внешняя оболочка завершена с 8 электронами или у них есть только одна оболочка (k-оболочка) с 2 электронами.С этой целью атом может терять, приобретать или делиться своими электронами с другими атомами. Два атома водорода объединяются, образуя молекулу водорода (h3), разделяя электроны.
Структура атомов
В атомную теорию Дальтона внесено несколько незначительных, но важных изменений. Во-первых, Дальтон считал атомы неделимыми. Теперь мы знаем, что атомы не только могут быть разделены, но также состоят из трех различных типов частиц со своими собственными свойствами, отличными от химических свойств атомов.
Субатомные частицы
Первая субатомная частица была идентифицирована в 1897 году и названа электроном. Субатомная частица с отрицательным электрическим зарядом. Это чрезвычайно крошечная частица с массой около 9,109 × 10 −31 кг. Эксперименты с магнитными полями показали, что электрон имеет отрицательный электрический заряд.
К 1920 году экспериментальные данные указали на существование второй частицы. Протон — субатомная частица с положительным зарядом.имеет такой же заряд, что и электрон, но его заряд положительный, а не отрицательный. Еще одно важное различие между протоном и электроном — это масса. Хотя масса протона все еще невероятно мала, она составляет 1,673 × 10 −27 кг, что почти в 2000 раз больше массы электрона. Поскольку противоположные заряды притягиваются друг к другу (в то время как одинаковые заряды отталкиваются), протоны притягивают электроны (и наоборот).
Наконец, дополнительные эксперименты указали на существование третьей частицы.Доказательства, полученные в 1932 году, установили существование нейтрона — субатомной частицы без электрического заряда, частицы с массой примерно такой же, как у протона, но без электрического заряда.
Теперь мы понимаем, что все атомы можно разбить на субатомные частицы: протоны, нейтроны и электроны. В таблице 2.4 «Свойства субатомных частиц» перечислены некоторые из их важных характеристик и символы, используемые для обозначения каждой частицы.
Таблица 2.4 Свойства субатомных частиц
| Частица | Символ | Масса (кг) | Относительная масса (протон = 1) | Относительный заряд |
|---|---|---|---|---|
| протон | п. + | 1,673 × 10 −27 | 1 | +1 |
| нейтрон | n 0 | 1.675 × 10 −27 | 1 | 0 |
| электрон | e — | 9,109 × 10 −31 | 0,00055 | -1 |
Ядро
Как устроены эти субатомные частицы? Между 1909 и 1911 годами Эрнест Резерфорд, кембриджский физик, и его соратники Ганс Гейгер и Эрнест Марсден провели эксперименты, которые предоставили убедительные доказательства внутренней структуры атома.Они взяли очень тонкую металлическую фольгу, такую как золото или платина, и направили пучок положительно заряженных частиц (называемых альфа-частицами, которые представляют собой комбинацию двух протонов и двух нейтронов) от радиоактивного источника к фольге. Фольгу окружал детектор — либо сцинтиллятор (материал, который светится при попадании таких частиц), либо неэкспонированная пленка (которая обнажается там, где на нее попадают частицы). Детектор позволил ученым определить распределение альфа-частиц после их взаимодействия с фольгой.Рисунок 2.3 «Экспериментальная установка Гейгера-Марсдена» показывает схему экспериментальной установки.
Рисунок 2.3 Экспериментальная установка Гейгера-Марсдена
Эксперименты с использованием этой установки были использованы для исследования структуры атомов.
Большинство частиц проходило прямо через фольгу, но некоторые альфа-частицы отклонялись в сторону. Некоторые даже были отклонены назад к источнику. Это было неожиданно. Резерфорд однажды сказал: «Это было почти так же невероятно, как если бы вы выстрелили 15-дюймовым снарядом по куску папиросной бумаги, а он вернулся и попал в вас.”
Резерфорд предложил следующую модель, чтобы объяснить эти экспериментальные результаты. Протоны и нейтроны сосредоточены в центральной области, которую он назвал ядром. Центральная часть атома, которая содержит протоны и нейтроны. (множественное число, ядер, ) атома. Электроны находятся вне ядра и вращаются вокруг него, потому что их притягивает положительный заряд ядра. Большая часть массы атома находится в ядре, а вращающиеся электроны определяют размер атома.В результате атом состоит в основном из пустого пространства. Резерфорд назвал свое описание «планетарной моделью» атома. Рисунок 2.4 «Эксперименты Резерфорда с металлической фольгой» показывает, как эта модель объясняет экспериментальные результаты.
Рисунок 2.4 Эксперименты Резерфорда с металлической фольгой
Резерфорд объяснил результаты экспериментов с металлической фольгой, предположив, что большая часть массы и положительного заряда атома сосредоточена в его ядре, в то время как относительно маломассивные электроны вращаются вокруг ядра.Большинство альфа-частиц проходят прямо через пустое пространство, несколько частиц отклоняются, и еще меньшее количество отрикошетирует обратно к источнику. Ядро пропорционально намного меньше, чем изображено здесь.
Примечание
Планетарная модель атома заменила модель сливового пудинга, в которой электроны бесцельно плавали, как сливы в «пудинге» положительного заряда.
Модель Резерфорда — это, по сути, та же модель, которую мы используем сегодня для описания атомов, но с одной важной модификацией.Планетарная модель предполагает, что электроны занимают определенные круговые орбиты вокруг ядра. Теперь мы знаем, что эта модель слишком упрощена. Лучшее описание состоит в том, что электроны образуют нечеткие облака вокруг ядер. На рисунке 2.5 «Современное изображение атомной структуры» показана более современная версия нашего понимания атомной структуры.
Рисунок 2.5 Современное изображение атомной структуры
Более современное понимание атомов, отраженное в этих представлениях об электроне в атоме водорода, состоит в том, что электроны занимают области пространства вокруг ядра; они не находятся на дискретных орбитах, как планеты вокруг Солнца.(а) Чем темнее цвет, тем выше вероятность того, что электрон окажется в этой точке. (b) В двумерном поперечном сечении электрона в атоме водорода чем больше точек, тем выше вероятность того, что электрон окажется в этой точке. В обоих (а) и (б) ядро находится в центре диаграммы.
Упражнения по обзору концепции
Каковы заряды и относительные массы трех субатомных частиц?
Опишите структуру атома, используя протоны, нейтроны и электроны.
ответов
протон: +1, большой; нейтрон: 0, большой; электрон: -1, маленький
Протоны и нейтроны расположены в центральном ядре, а электроны вращаются вокруг ядра.
Основные выводы
- Атомы состоят из трех основных субатомных частиц: протонов, нейтронов и электронов.
- Протоны и нейтроны сгруппированы в ядре атома, а электроны вращаются вокруг ядра.
Упражнения
Что меньше — электрон или атом гелия?
Что больше — протон или атом свинца?
Какая субатомная частица имеет положительный заряд? Какая субатомная частица имеет отрицательный заряд?
Какая субатомная частица электрически нейтральна? Он существует внутри ядра или вне его?
Протоны являются одними из (наиболее, менее) массивных субатомных частиц, и они находятся (внутри и снаружи) ядра.
Электроны являются одними из (наиболее, менее) массивных субатомных частиц, и они находятся (внутри и снаружи) ядра.
Опишите, почему Резерфорд использовал термин модель планеты для описания своей модели атомной структуры.
Почему модель планеты не подходит для описания структуры атома?
Что случилось с большинством альфа-частиц в эксперименте Резерфорда? Объясните, почему это произошло.
Электроны составляют (большинство, меньшинство) (масса, объем) атома.
ответов
Электроны вращаются по орбите вокруг ядра.
Большая часть альфа-частиц прошла через металлический лист, потому что атомы в основном представляют собой пустое пространство.
атом | Определение, структура, история, примеры, диаграммы и факты
Атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц.Это также мельчайшая единица вещества, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Оболочечная модель атома
В оболочечной модели атома электроны занимают разные энергетические уровни или оболочки. Оболочки K и L показаны для атома неона.
Encyclopædia Britannica, Inc. Изучение различных электронных конфигураций в электронных оболочках вокруг ядра атома
Атомная модель электронных конфигураций.
Encyclopædia Britannica, Inc. Посмотреть все видео по этой статье
Большая часть атома — это пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что, таким образом, вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств.В некоторых отношениях электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других случаях электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группами, известными как оболочки.
Эта статья открывается широким обзором фундаментальных свойств атома и составляющих его частиц и сил.После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, сформулированных на протяжении веков. Для дополнительной информации, относящейся к структуре ядра и элементарным частицам, см. субатомных частиц.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской.
Подпишитесь сегодня
Большая часть вещества состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать.Каждый отдельный атом состоит из более мелких частиц, а именно из электронов и ядер. Эти частицы электрически заряжены, и электрические силы, действующие на заряд, несут ответственность за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом состоит в основном из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы.Он состоит из протонов, которые имеют положительный заряд, и нейтронов, которые не имеют заряда. Протоны, нейтроны и окружающие их электроны — долгоживущие частицы, присутствующие во всех обычных, встречающихся в природе атомах. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов.Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, имеют размер 1 см (0,4 дюйма). Удобной единицей длины для измерения размеров атомов является ангстрем (Å), определяемый как 10 −10 метр. Радиус атома составляет 1-2 Å. По сравнению с общим размером атома, ядро еще более миниатюрное. Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метр пространства в атоме, то есть 1 часть на 100 000.Удобной единицей длины для измерения размеров ядер является фемтометр (фм), который равен 10 −15 метр. Диаметр ядра зависит от количества содержащихся в нем частиц и колеблется от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, практически вся масса атома сосредоточена в нем. Протоны — массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов.Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их широкую вариацию массы. Самое легкое ядро, ядро водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500000 раз массивнее.
Основные свойства
Самой важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z ), который определяется как количество единиц положительного заряда (протонов) в ядре.Например, если у атома Z из 6, это углерод, тогда как Z из 92 соответствует урану. Нейтральный атом имеет равное количество протонов и электронов, так что положительный и отрицательный заряды точно уравновешиваются. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно количество протонов в ядре определяет химические свойства атома.
атом | Определение, структура, история, примеры, диаграммы и факты
Атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц.Это также мельчайшая единица вещества, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Оболочечная модель атома
В оболочечной модели атома электроны занимают разные энергетические уровни или оболочки. Оболочки K и L показаны для атома неона.
Encyclopædia Britannica, Inc. Изучение различных электронных конфигураций в электронных оболочках вокруг ядра атома
Атомная модель электронных конфигураций.
Encyclopædia Britannica, Inc. Посмотреть все видео по этой статье
Большая часть атома — это пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что, таким образом, вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств.В некоторых отношениях электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других случаях электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группами, известными как оболочки.
Эта статья открывается широким обзором фундаментальных свойств атома и составляющих его частиц и сил.После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, сформулированных на протяжении веков. Для дополнительной информации, относящейся к структуре ядра и элементарным частицам, см. субатомных частиц.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской.
Подпишитесь сегодня
Большая часть вещества состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать.Каждый отдельный атом состоит из более мелких частиц, а именно из электронов и ядер. Эти частицы электрически заряжены, и электрические силы, действующие на заряд, несут ответственность за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом состоит в основном из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы.Он состоит из протонов, которые имеют положительный заряд, и нейтронов, которые не имеют заряда. Протоны, нейтроны и окружающие их электроны — долгоживущие частицы, присутствующие во всех обычных, встречающихся в природе атомах. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов.Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, имеют размер 1 см (0,4 дюйма). Удобной единицей длины для измерения размеров атомов является ангстрем (Å), определяемый как 10 −10 метр. Радиус атома составляет 1-2 Å. По сравнению с общим размером атома, ядро еще более миниатюрное. Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метр пространства в атоме, то есть 1 часть на 100 000.Удобной единицей длины для измерения размеров ядер является фемтометр (фм), который равен 10 −15 метр. Диаметр ядра зависит от количества содержащихся в нем частиц и колеблется от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, практически вся масса атома сосредоточена в нем. Протоны — массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов.Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их широкую вариацию массы.


 ..
..