Химический источник тока: принцип действия, классификация

Химические источники тока — это устройства и приборы которые в процессе химической окислительно-восстановительной реакции выделяют напряжение. Также они называются электрохимическими, гальваническими элементами. Основной принцип действия их основан на взаимодействии химических реагентов которые вступая, в реакцию друг с другом вырабатывают электроэнергию, в виде постоянного тока. Этот процесс происходит без механического или теплового воздействия, что является основными факторами играющими превосходящую роль среди других генераторов постоянного напряжения. Химические источники тока, сокращённо ХИТ, уже давно нашли применение не только в быту, но и на производстве.
Немного истории создания ХИТ
Ещё в восемнадцатом веке итальянский учёный Луиджи Гальвани придумал простейший элемент который химическим способом выделял электрический ток. Однако он был не только учёным, но и физиком, врачом, физиологом. Он интересовался и проводил опыты которые были направлены на изучение реакции животных на внешние раздражители. Как и всё гениальное первый химический источник энергии был получен Луиджи абсолютно случайно, во время многочисленных экспериментов над лягушками. После присоединения двух пластин из металла к лягушачьей мышце на лапке, было замечено мускульное сокращение. Гальвани посчитал это нервной реакцией на внешний раздражитель и изложил это в результатах своих исследований, попавших в руки другого великого учёного Алессандро Вольта. Он и выложил свою теорию о возникновении напряжения в результате химической реакции, возникшей между двумя металлическими пластинами в среде мускульной ткани лягушки.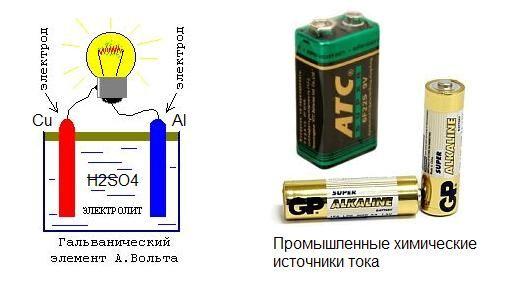
Первый химический источник электрического тока представлял собой емкость с соляным составом, в который было погружено две пластины из разных материалов. Одна из меди, другая из цинка. Именно это устройство в будущем, а конкретнее во второй половине девятнадцатого века, было применено при изобретении и создании марганцево-цинкового элемента внутри которого был тот же солевой электролит.
Принцип действия
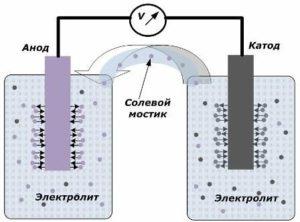 Устройства вырабатывающее электрический ток содержит два электрода, которые помещаются между электролитом. Именно на их границе соприкосновения и появляется небольшой потенциал. Один из них называют катодом, а другой анодом. Все эти элементы вместе образуют электрохимическую систему.
Устройства вырабатывающее электрический ток содержит два электрода, которые помещаются между электролитом. Именно на их границе соприкосновения и появляется небольшой потенциал. Один из них называют катодом, а другой анодом. Все эти элементы вместе образуют электрохимическую систему.
Во время возникновения окислительно-восстановительной реакции между электродами один элемент отдаёт мельчайшие частицы электроны другому. Поэтому она и не может происходить вечно, а со временем просто теряются свойства каждого элемента этой цепи.
Электроды могут быть представлены в виде пластин или решёток из металла. После погружения их в среду с электролитом меду их выводами возникает разность потенциалов, которая именуется напряжением разомкнутой цепи. Даже при удалении хотя бы одного из электродов с электролита процесс генерации напряжения прекращается.
Состав электрохимических систем
В качестве электролита используются следующие химические вещества:
- Водные растворы на основе щелочей, кислот, солей и т. д.;
- Растворы с ионной проводимостью на неводной основе, которые получены при растворении солей в неорганических или органических растворителях;
- Твердые соединения, содержащие ионную решетку, где один из ионов является подвижным;
- Матричные электролиты. Это особый вид жидких растворов и расплавов, которые находятся в порах твёрдого непроводящего элемента — электроносителя;
- Расплавы солей;
- Ионообменные электролиты с униполярной системой проводимости. Твёрдые тела с фиксированной ионогенной группой одного знака.
Классификация гальванических элементов и их подбор
Генераторы электрического тока получающегося во время химической реакции разделяются по:
- Размерам;
- Конструктивным особенностям;
- Способу и реагенту, за счёт которого, и получается электроэнергия.
Все элементы вырабатывающее ток во время химической реакции делятся на:
- Заряжаемые, которые в процессе эксплуатации могут неоднократно заряжаться от источника постоянного тока, они называются аккумуляторами;
- Не заряжаемые, то есть источники одноразового использования которые после завершения химической реакции просто приходят в негодность и должны быть утилизированы. Попросту это гальванический элемент или батарейка.
Для того чтобы подобрать источник электроэнергии, основанный на химической реакции, нужно понимать его характеристики, к которым относятся:
- Напряжение между анодом и катодом при разомкнутой цепи. Этот показатель чаще всего зависит от выбранной электрохимической системы, а также концентрации и вылечены всех составляющих;
- Мощность источника;
- Показатель силы тока;
- Емкость;
- Электротехнические показатели, то есть количество циклов заряда и разряда;
- Диапазон рабочих температур;
- Срок хранения между тем временем как элемент был создан и до начала его эксплуатации;
- Полный срок службы;
- Прочность, то есть защита корпуса от различных механических повреждений и влияний, а также вибраций;
- Положение работы, некоторые из них работают только в горизонтальных положениях;
- Надёжность;
- Простота в эксплуатации и обслуживании. В идеале отсутствие необходимости малейшего вмешательства в работу в течение всего срока эксплуатации.
При выборе нужной батареи или аккумулятора обязательно нужно учесть его электрические номиналы такие как напряжение и ток, а также ёмкость. Именно она является ключевой для сохранения работоспособности, подключаемого к источнику прибора.
Современные химические источники тока и их применение
Современный быт человека тяжело приставить без этих мобильных генераторов энергии, с которыми он сталкивается в течение всей жизни, начиная с детских игрушек и заканчивая, допустим, автомобилем. Сферы применения различных батареек и аккумуляторов настолько разнообразны что перечислить их очень сложно. Работа любого мобильного телефона, компьютера, ноутбука, часов, пульта дистанционного управления была бы невозможна без этого переносного и очень компактного устройства для создания стабильного электрического заряда.
Сферы применения различных батареек и аккумуляторов настолько разнообразны что перечислить их очень сложно. Работа любого мобильного телефона, компьютера, ноутбука, часов, пульта дистанционного управления была бы невозможна без этого переносного и очень компактного устройства для создания стабильного электрического заряда.
В медицине широко используются источники химической энергии при создании любого аппарата, помогающего человеку полноценно жить. Например, для слуховых аппаратов и электрокардиостимуляторов которые могут работать только от переносных источников напряжения, чтобы не сковывать человека проводами.
В производстве применяются целые системы аккумуляторных батарей для обеспечения напряжением цепей отключения и защит в случае пропадания входящего высокого напряжения на подстанциях. И также широко применяется это питание во всех транспортных средствах, военной и космической технике.
Одним из видов распространённых батарей являются литиевые источники электрического тока, так как именно этот элемент обладает высоким показателем удельной энергии. Дело в том что только этот химический элемент, оказывается, обладает сильным отрицательным потенциалом среди всех известных и изученных человеком веществ. Литий-ионные батареи выделяются среди всех остальных элементов питания по величине вырабатываемой энергии и низким габаритам, что позволяет применять их в самых компактных и мелких электронных устройствах.
Способы утилизации химических источников энергии
 Проблема утилизации разных по габаритах химических источников напряжения является экологической проблемой всей планеты. Современные источники содержат в себе до тридцати химических элементов которые могут нанесите ощутимый вред природным ресурсам, поэтому для их утилизации разработаны целые программы и построены специализированные цеха по переработке. Некоторые методы позволяют не только качественно перерабатывать эти вредные вещества, но и возвращать в производство, тем самым защитив окружающую среду. В целях извлечения цветных металлов из батарей и аккумуляторов в настоящий момент разработаны и применены в цивилизованных странах, следящих и заботящихся об окружающей среде, целые пирометаллургические и гидрометаллургические комплексы. Самый же распространённый способ утилизации отработанных химических источников тока является метод, работающий на соединении этих процессов. Главным его достоинством считается высокая степень извлечения с минимальным количеством отходов.
Проблема утилизации разных по габаритах химических источников напряжения является экологической проблемой всей планеты. Современные источники содержат в себе до тридцати химических элементов которые могут нанесите ощутимый вред природным ресурсам, поэтому для их утилизации разработаны целые программы и построены специализированные цеха по переработке. Некоторые методы позволяют не только качественно перерабатывать эти вредные вещества, но и возвращать в производство, тем самым защитив окружающую среду. В целях извлечения цветных металлов из батарей и аккумуляторов в настоящий момент разработаны и применены в цивилизованных странах, следящих и заботящихся об окружающей среде, целые пирометаллургические и гидрометаллургические комплексы. Самый же распространённый способ утилизации отработанных химических источников тока является метод, работающий на соединении этих процессов. Главным его достоинством считается высокая степень извлечения с минимальным количеством отходов.
Этот метод пирометаллургической, гидрометаллургической и механической переработки включает в себя восемь основных стадий:
- Измельчение;
- Магнитная сепарация;
- Обжиг;
- Дополнительное измельчение;
- Выделение крупных и мелких элементов с помощью грохочения;
- Водное очищение и выщелачивание;
- Сернокислотное выщелачивание;
- Электролиз.
Организация правильного сбора и утилизации ХИТ позволяет максимально уменьшить негативное влияние как на окружающую природу, так и на здоровье самого человека.
Видео о химических источниках тока
Химические Источники Тока (ХИТ): Характеристики, Применение

Любая батарейка или аккумулятор дает ток за счет протекающих внутри них химических реакций
Химические источники тока (сокращенно ХИТ) – это источники электродвижущей силы (ЭДС), в которых в электрическую энергию превращается энергия протекающих внутри химических реакций. Используют их сегодня повсеместно – это и современные электромобили и портативная радиоэлектроника, и медицинское оборудование, и портативные компьютеры.
Все это делает источники тока электрохимические очень важным изобретением, которым пользуются вот уже 2-ю сотню лет. Именно про ХИТ мы подробно и поговорим в сегодняшней статье.
Классификация химических источников тока

Классификация ХИТ
Все ХИТ принято подразделять на три основные категории:

Как устроены гальванические батареи
- Первичные гальванические элементы – внутри таких источников происходят химические окислительно-восстановительные реакции, энергия которых и переходит в электрическую. Данные реакции являются необратимыми, поэтому элементы невозможно перезарядить.
- Состоят такие батареи из двух электродов, которые имеют разный электродный потенциал, металлического проводника, по которому могут перемещаться электроны, и электролита, который помогает перемещению ионов между электродами.
Интересно знать! Напомним, что именно поток электронов и приводит к возникновению электрического тока.

Вторичный химический источник тока
- Вторичные ХИТ, они же электрические аккумуляторы – тоже являются гальваническими элементами, однако их особенность заключается в том, что возможна перезарядка.
- В отличие от батарей, которые исчерпывают свою работоспособность при разряде, аккумуляторы могут регенерироваться, то есть повторно накапливать энергию и перезапускать цикл химических реакций.
- Возобновление заряда происходит при пропускании через элемент электрического тока, для чего нужна внешняя цепь. Все мы ежедневно заряжаем свои телефоны и смартфоны, ноутбуки и планшеты. Аккумуляторы применяются практически везде, и это не удивительно – их ресурс намного выше, чем у любой первичной батареи в сотни раз, при том, что цена больше до 10-ти раз.
- Прообраз первой аккумуляторной батареи был создан в далеком 1803 году немецким физиком-химиком И. Риттером. Его устройство имело в составе пятьдесят медных кружков, между которыми было проложено влажное сукно. Когда через него проходил ток от Вольтова столба, изделие само становилось источником электрического тока.

Топливный источник тока химический
- Последним типом химических источников тока являются топливные элементы, или электрохимические генераторы. Основное отличие их от гальванических элементов это то, что вещества необходимые для электрохимической реакции подаются внутрь извне, а продукты от реакций, наоборот, удаляются.
- Подобный подход позволяет организовать долгую непрерывную работу без фактической перезарядки.
- Впервые применять топливные источники тока стали во второй половине 20-го века, несмотря на то, что основные принципы функционирования были открыты в далеком 1839 году. В 1965 году их впервые задействовали в космической технике – это был элемент КК «Джемини». Его изначальное расчетное время работы составляло от суток, до 2-х месяцев. Эти элементы имели достаточное преимущество перед солнечными батареями с буферными химическими батареями в плане массы и габаритов, а также удельной мощности.
- Первая топливная батарея КК «Джемини» состояла из 3 блоков по 32 элемента, каждый из которых выдавал напряжение в 0,8В, и работала на газообразном топливе (кислород и водород).
Характеристики гальванических источников тока

Щелочные аккумуляторы и их свойства
Характеристика химических источников тока включает в себя следующие параметры:

Уравнение Нернста для электродного потенциала
- Электродвижущая сила – этот параметр гальванического элемента зависит от состава используемого электролита и типов металлов, из которых изготовлены электроды. Описывают ЭДС термодинамические функции (уравнение Нернста), приложенные к протекающим электрохимическим процессам.

Измеряется емкость обычно в миллиамперах в час
- Емкость элемента питания – тут все просто, имеется в виду количество энергии, которое элемент может отдать при разряде. Данный параметр напрямую зависит от массы запасенного в батарее реагентов и скорости их превращения. Емкость элемента будет снижаться, если элемент будет охлажден, либо вырастет ток разряда.
- Энергия гальванического элемента. Этот параметр высчитывается путем перемножения емкости на выдаваемое напряжение. Энергия будет уменьшаться по мере роста разрядного тока. Обратный эффект будет достигнут при росте температуры (до определенного уровня) и увеличении используемых реагентов.

Прототип гальванической батареи
- Сохраняемость – по сути, срок годности элемента, в течение которого он способен не менять своих основных характеристик в допустимых пределах.
Совет! Чем выше температура, тем быстрее сокращается срок хранения.
- Плотность энергии – количество запасенной энергии в расчете на единицу массы аккумулятора или его объема.
- Саморазряд первичного химического источника тока – очень важный параметр, указывающий на потерю емкости батареей без подключенной к ней нагрузки. То есть параметр фактически сопоставим со сроком службы элемента.
- Саморазряд химических источников тока вторичных, по сути, то же самое, однако этот параметр меняется во времени. Особенно высоко его значение после полной подзарядки аккумулятора, но по мере разрядки он ослабевает.
Интересно знать! Для никель-кадмиевых аккумуляторов, функционирующих исправно, не допускается потеря более 10% от максимального заряда за 1 сутки. Никель-металлгидридные имеют меньший показатель, а у литий-ионных этот эффект практически отсутствует, растягиваясь на месяцы. Герметичные кислотные аккумуляторы потеряют за год всего 40% своего заряда, однако, если температура воздуха будет выше 20 градусов, процесс потечет куда быстрее, и наоборот, приближаясь к нулю – будет замедляться.
Более подробное строение элементов

Гальваническая батарейка в разрезе
Мы уже дали определение химических источников тока и назвали их основные типы. Теперь давайте рассмотрим немного глубже, как они устроены, и какие химические реакции внутри протекают.

Элемент Даниэля-Якоби
- Итак, начнем с первичных гальванических элементов. В их состав входят реагенты (окислители и восстановители), которые участвуют в прямом преобразовании энергии. Выработка тока прекращается после того, как реагенты полностью израсходуются.
- В качестве примера того, как функционирует элемент, давайте опишем давно известное устройство Даниэля-Якоби. Выше представлена его схема.
- Итак, два электрода (цинковый и медный) опущены в колбы наполненные растворами сульфатов цинка и меди, соответственно.
- Растворы разъединены внутренней цепью (полупроницаемой перегородкой), а электроды соединяются внешней цепью (металлический проводник) через гальванометр, обозначенный на схеме как 2.

Элемент Даниэля
- Когда цепь замкнута, на обоих электродах протекают процессы гидратации ионов металлов. Между самим металлом и его ионами в растворе устанавливается химическое равновесие.
- В связи с тем, что цинк и медь имеют разную активность электродных потенциалов, электроды приобретают разный заряд по величине, то есть концентрация свободных электронов на них будет значительно отличаться.
- Как только будет замкнута внешняя цепь, концентрация электронов придет в равновесие и они по внешнему проводнику начнут перемещаться от цинкового электрода к медному.
- По этой причине концентрация электронов на цинковом электроде начинает уменьшаться, из-за чего происходит смещение равновесия на границе Zn|ZnSO4 в сторону катионов цинка (их образования). Другими словами цинк начинает растворяться.
- С медным электродом происходит обратный процесс – равновесие смещается в другую сторону и начинает образовываться металлическая медь, или другими словами – медь начинает восстанавливаться.
- Если говорить более конкретно, то на цинковом электроде происходит процесс окисления, который в электрохимии называется анодным процессом, а сам электрод – анодом. На медном электроде (катоде) – процесс восстановления, называемый еще катодным.

Классическая солевая батарейка
- Наиболее широко распространились элементы питания, состоящие из марганца и цинка. Они не содержат раствора электролита, поэтому называются сухими.
- Эти элементы при всем конструкционном многообразии делят всего лишь на два типа, в зависимости от рН электролита и состава: солевые и щелочные. Для солевых марганцево-цинковых элементов (МЦ) используется электрохимическая схема Лекланше (Zn|Nh5Cl|MnO2) – в качестве катода выступает цинковый электрод, в качестве анода – электрод их диоксида марганца и графита, а электролитом является паста из муки или крахмала с раствором хлорида аммония.
- В щелочных элементах питания применяется другая схема (Zn|KOH|MnO2). При этом электроды делаются из тех же материалов, а в качестве электролита применяется паста из гидроксида калия.
- Такие элементы обладают большей емкостью, лучше переносят низкие температуры и высокие разрядные токи. Однако они намного сложнее солевых источников, почему и имеют значительно большую цену.
- Данные элементы имеют многоцелевое назначение и применяются в быту повсеместно. Они могут выступать источниками автономного питания для любой радиоаппаратуры, фотоаппаратов, калькуляторов, различных тестовых приборов, часов, фонариков, для запитки схем Биоса материнских плат персональных компьютеров и прочего.

Процесс зарядки аккумуляторных батарей
- Аккумуляторы, или вторичные химические источники тока – отличает эти элементы то, что благодаря воздействию внешнего тока, электрическая энергия может переходить в химическую, а при подключении внешней цепи происходит обратный процесс.
- Одним из часто встречающихся типов таких устройств являются свинцовые аккумуляторы, которые также называют и кислотными.
- В качестве электролита выступает 25-30%-ый раствор серной кислоты, а материалом для электродов служат свинцовые решетки. При взаимодействии этих веществ свинец превращается в следующее соединение — PbSO
- Процессы, протекающие на аккумуляторных электродах, до сих пор до конца не изучены, что говорит об их высокой сложности. Допускается, что одновременно происходят изменения в твердой фазе и в растворе, с зависимостью скоростей этих реакций от условий поляризации.
- Применяются такие элементы в основном в качестве источников питания в автомобилях.
- Помимо кислотных существуют и щелочные аккумуляторы, среди которых больше остальных распространились никель-металлгидридные и никель-кадмиевые устройства, электролитом в которых является гидроксид калия (КОН).
- Для переносной электроники, например, ноутбуков, планшетов, смартфонов используются в основном литий-ионные аккумуляторы, а также литий-полимерные, обладающие приличной емкостью и отсутствием эффекта памяти.
Про литий-ионные аккумуляторы мы поговорим в отдельной главе, так как эти устройства на сегодня в быту самые часто встречающиеся.

Строение электрохимического генератора тока
- Топливные элементы питания, по сути, тоже являются гальваническими, только восстановитель и окислитель находятся вне самого элемента. Они подаются во время работы к электродам раздельно и непрерывно.
- При работе такого элемента сами электроды не расходуются, как в обычных батарейках.
- В качестве окислителя обычно применяется кислород (чистый или из воздуха), а в качестве восстановителя – водород, метан и метанол, которые могут быть как в жидком, так и в газообразном состоянии.
- Электролитом при этом является щелочь.
Литий-ионные аккумуляторные батареи
Теперь, как и обещали, давайте подробно обсудим, что такое литий-ионные аккумуляторы, как они устроены и как ими правильно пользоваться. Тема очень интересная, и поможет не только увеличить объем теоретических знаний, но и практических, которые, к примеру, помогут продлить срок службы вашего телефонного или любого другого аккумулятора.
Строение

На фото — литий-ионный аккумулятор от сотового телефона
- В качестве катода (отрицательного электрода) используется алюминий, а в качестве анода (положительного электрода) – медь. Выполняются они обычно в виде фольги, в форме цилиндра или продолговатого пакета.
- Разделяются электроды пористым сепаратором, который пропитал электролитом.

Схематическое строение литий-ионного аккумулятора
- Все электроды устанавливаются в прочный корпус и подсоединяются к токосъемным клеммам.
- Попутно внутри корпуса могут устанавливаться и отдельные устройства, которые призваны продлить срок службы аккумулятора и сделать эксплуатацию безопасной. К таковым относятся:
- Устройства, реагирующие на изменения температурного коэффициента изменением сопротивления.
- Устройство разрыва контакта между катодом и клеммой, в случае превышения допустимого давления газов внутри.
- Предохранительные клапаны, способные сбрасывать аварийное давление.
- Также используются и внешние устройства электронной защиты, которые также предупреждают аварийный перегрев, перезаряд и короткое замыкание.
- Конструктивно аккумуляторы изготавливают цилиндрического типа (как обычные батарейки) либо призматического (как в телефонах). В первом случае электроды с сепаратором сворачиваются рулоном, а во втором они накладываются друг на друга.
- Литий-ионные аккумуляторы абсолютно герметичные устройства, что продиктовано необходимостью защиты от утечки электролита, а также защитой от попадания внутрь паров воды и кислорода, что приводит к выходу элемента из строя.
Принцип работы

Как работает аккумулятор
Разберем сначала разряд.
- При подключении во внешнюю цепь заряженного аккумулятора, начинает протекать химическая реакция, благодаря которой образуются свободные электроны, которые, как мы помним, «хотят» попасть на катод. Через электролит им не пройти, поэтому они «отправляются в путь» через внешнюю цепь – так образуется ток, который питает подключенные к источнику устройства.
- «Улетевшие» электроны оставляют ионы лития (положительно заряженные), которые через электролит направляются к катоду.
- После полного перемещения электронов, аккумулятор остается разряженным.
Чтобы восполнить запас энергии, процесс нужно обратить вспять. К аккумулятору подключается зарядное устройство, из-за чего электроны устремляются обратно к аноду, пока тот не соберет прежнее количество электронов. Далее цикл может повторяться большое количество раз.
Емкость литий-ионной батареи – это ни что иное, как количество ионов лития, которые могут «прилипнуть» к электродам. Попадают они в кратеры (микроскопические поры на аноде и катоде).

При выходе аккумулятора из строя требуется его замена на новый
- Со временем материал электродов начинает деградировать. По этой причине они уже не могут удерживать прежнее количество ионов лития, то есть происходит потеря емкости. Данный процесс будет продолжаться до тех пор, пока элемент полностью не утратит свою работоспособность.
- Строение литий-ионных аккумуляторов таково, что постоянно требуется контроль за уровнем заряда. С этой целью в симбиозе с ними применяют контроллеры заряда. Эти устройства полностью ведут процесс зарядки, выставляя необходимое напряжение в зависимости от стадии.

Зарядное устройство
- Процесс зарядки через контроллер протекает обычно в следующей последовательности. Вначале подается ток, составляющий 10% от номинального. Напряжение при этом составляет 2,8 Вольт. Далее происходит увеличение тока при достижении напряжением отметки в 4,2 Вольта. Приближаясь к финалу, ток постепенно ослабевает, но напряжение так и остается на достигнутом уровне.
- Описанный процесс, в принципе, универсален, но может отличаться в зависимости от типов аккумулятора и применяемого контроллера.
Характеристики аккумуляторов

Именно такие аккумуляторы установлены в батареи для ноутбуков
Изготавливаемые сегодня литий-ионные аккумуляторы бывают двух видов: таблеточные и цилиндрические.
Все они могут иметь следующие рабочие параметры и характеристики:
- Минимальное рабочее напряжение составляет 2,2-2,5 В;
- Максимальное напряжение обычно не превышает 4,35 В, тогда как маркировка указывает 5 В.
- Время зарядки зависит от мощности зарядного устройства и емкости самого аккумулятора, поэтому обобщить данные достаточно сложно. Обычно этот параметр составляет 2-4 часа.
- Саморазряд при комнатной температуре не превышает 7% в год, что как понимаете, очень мало.
- Работать аккумуляторы могут при температурах от -20 до +60 градусов, естественно, меняя свои рабочие характеристики.
- Аккумуляторы теряют около 20% своей емкости по истечении от 500 до 1000 циклов заряда\разряда.
Для таких аккумуляторов характерны следующие плюсы:
- Высокая плотность энергии, по сравнению с никель-кадмиевыми и никель-металлгидридными аккумуляторами.
- Высокое напряжение одного элемента. Для сравнения один никель-металлгидридный аккумулятор выдает всего лишь 1,2 В, поэтому их используют в количестве 4-х штук, чтобы получить то же рабочее напряжение.
- «Эффект памяти» у них отсутствует, что намного упрощает процесс эксплуатации.

«Эффект памяти» требует особого подхода к заряду аккумулятора
Интересно знать! Эффект памяти – это изменение полезной емкости аккумулятора, из-за нарушения режима зарядки. То есть, если постоянно заряжать не до конца севший аккумулятор, он «запомнит» нижний порог и будет «считать» его нулевым.
- Большое число циклов перезарядки.
- Достаточно длительная эксплуатация.
- Высокий диапазон рабочих температур, что позволяет использовать такие устройства в разных погодных условиях.
- Литий-ионные аккумуляторы более безопасны в плане экологии.
Советы по эксплуатации аккумуляторов
А теперь самые простые советы, которые помогут прослужить вашим аккумуляторам максимально долго.
- Берегите элементы питания от огня и воды – оба фактора чреваты выходом из строя.
- Чрезмерное охлаждение и нагревание, а также резкая смена температур тоже губительны.
- Применяйте соответствующий вашему аккумулятору тип зарядки, коих есть аж 4 штуки.
- Первый – это медленный заряд низким постоянным током. Происходит он в течение довольно длительного времени – до 18 часов. Такой метод подходит почти для всех аккумуляторов и является самым безопасным.
- Второй – быстрый заряд. Происходит в течение 3-5 часов при постоянном токе в 1/3С.
- Третий – дельта V заряд (ускоренный) — начальные ток равен номинальной емкости элемента, напряжение постоянно меняется. Заряд происходит за 1-1,5 часа. При этом возможен перегрев и разрушение устройства.
- Четвертый тип называется реверсивным. При нем длинные импульсы заряда сменяются короткими импульсами разряда. Такой метод наиболее полезен для аккумуляторов с «эффектом памяти».
Совет! Прилагаемая к аккумуляторным батареям инструкция обычно содержит рекомендации по режиму зарядки.
На этом закончим наш обзор. Мы разобрали электрохимические источники тока и получили простейшее представление об их работе. Если вы хотите изучить тему глубже, то уже не обойтись без учебных пособий и видео, которые можно легко отыскать в сети.
Химические источники тока. Виды и особенности. Устройство и работа
Химические источники тока (ХИТ) — эта тема имеет высокое практическое значение. Это кардиостимуляторы, электромобили, которые пытаются сохранить экологию, портативные устройства, включая фото и видеотехнику, компьютерную технику, навигаторы. За последние годы прогресс химических источников тока произошел большой, от известных свинцовых аккумуляторов, которые постепенно вытесняются литий-ионными, литий-полимерными и другими аккумуляторами.
В этой области борьба идет за мощность, емкость, которая позволяет максимально долго использовать источники тока. Дополнительным стимулом к их развитию является создание гибких источников тока. Научная составляющая в этой области лежит в плане разработки материалов для таких химических элементов.
Устройство и работа
Химические источники тока состоят из электродов и электролита, который находится в емкости. Электрод, на котором окисляется восстановитель, называется анодом. Электрод, на котором восстанавливается окислитель, называется катодом. В общем получается электрохимическая система.
Попутным результатом такой реакции стало возникновение тока. Восстановитель передает электроны на окислитель, который восстанавливается. Электролит, который находится между электродами, нужен для прохождения реакции. Если перемешать порошки различных двух металлов, то электричество не возникнет, энергия появится в виде теплоты. Электролит необходим для упорядочения процесса движения электронов. Электролит состоит обычно из раствора соли или расплавленного вещества.
Электроды имеют вид решеток или пластин из металла. При помещении их в раствор электролита получается разность потенциалов пластин. Анод отдает электроны, а катод их принимает. На поверхности возникают химические реакции. Когда цепь размыкается, то реакции прекращаются. Если реагенты закончились, то реакция также больше не идет. Если удалить один из электродов, то цепь размыкается.
Из чего состоят химические источники тока
В качестве окислителей применяются соли и кислородосодержащие кислоты, а также нитроорганические вещества, кислород. В качестве восстановителей применяются металлы, оксиды, углеводороды.
Электролит может состоять из:
- Соли, щелочи и кислоты, растворенные в воде.
- Соли в растворе, с возможностью электронной проводимости.
- Расплавленные соли.
- Твердые вещества с подвижным ионом.
- Электролиты в виде матрицы. Это растворы жидкости, расплавы, которые находятся в порах электроносителя.
- Электролиты с ионным обменом. Твердые вещества с закрепленными ионогенными группами, с одним знаком. С другим знаком ионы подвижны. Эта характеристика позволяет создать однополярную проводимость.
Гальванические элементы
Напряжение на ячейке составляет 0,5-4 вольта. В химических образцах источника применяют гальваническую батарею, которая состоит из элементов. Может использоваться параллельная схема нескольких элементов. При последовательной схеме в цепь включены одинаковые батареи. Они должны обладать одинаковыми свойствами, с одной конструкцией, технологией, типоразмером. Для схемы параллельного соединения подойдут элементы с различными свойствами.
Классы
Химические источники тока делятся по следующим свойствам:
- Размерности.
- Конструктивным особенностям.
- Применяемым химическим веществам.
- Источнику реакции.
Эти свойства создают эксплуатационные параметры источников, которые подходят для определенной области использования.
Деление на классы электрохимических источников основывается на отличии в способе действия устройства. По этим свойствам их различают:
- Первичные источники – для однократного применения. В них заключен определенный запас веществ, который будет израсходован при реакции. Когда произойдет разряд, ячейка исчерпывает свою способность к работе. Первичные источники, основанные на химических реакциях, называются элементами. Наиболее простой элемент – это батарейка типа АА.
- Химические источники тока, которые имеют возможность перезаряжаться, называются аккумуляторами, это вторичные многоразовые элементы. Израсходованные химические элементы могут регенерироваться и снова накопить энергию, путем подключения к ним тока. Это называется зарядкой элементов. Такие элементы применяют длительное время, так как их легко зарядить. В процессе разряда вырабатывается электрический ток. К таким источникам можно причислить элементы питания различных видов приборов и устройств, таких как смартфоны, ноутбуки и т.д.
- Тепловые химические источники тока – это приборы постоянного действия. В результате их работы постоянно поступает новая порция веществ и удаляется использованный продукт реакции.
- В смешанных элементах находится запас реагента. Другой реагент поступает в устройство снаружи. Время действия устройства имеет зависимость от резерва первого вещества. Комбинированные элементы применяются в качестве аккумуляторов, когда имеется возможность регенерации их заряда через прохождение тока от внешнего питания.
- Химические источники тока, которые могут возобновлять заряд, заряжаются разными способами. В них можно заменять израсходованные реагенты. Такие источники действуют не постоянно.
Свойства
Основные характеристики ХИТ можно перечислить в таком виде:
- Разрядное напряжение. Это свойство имеет зависимость от определенной электрохимической системы. А также оказывает влияние процент концентрации электролита, температура, ток.
- Мощность.
- Разрядный ток, зависящий от сопротивления цепи.
- Емкость, наибольшее количество энергии, которое источник выдает при общем разряде.
- Запас энергии – наибольшая энергия, которая получена при полном разряде устройства.
- Энергетические свойства и характеристики. Для батарей аккумуляторов это число циклов заряда и разряда, без уменьшения емкости и напряжения (ресурс).
- Температурный интервал работы.
- Сохраняемый срок – наибольший допускаемый период времени от изготовления до первого разряда элемента.
- Время службы – наибольший допускаемый срок работы и хранения. Для элементов на топливе имеют значение сроки работы при постоянной и периодической работе.
- Полная энергия, отданная за все время работы.
- Механическая, вибрационная прочность.
- Возможность функционирования в любом положении.
- Надежная работа.
- Простота в уходе.
Сахарная батарея
Чтобы произвести литий-ионные аккумуляторы в Японии закупают материалы в других странах. Это негативно сказывается на экономическом положении страны. Поэтому ученые ищут способы изготовления аккумуляторов из того сырья, которое имеется в наличии. Таким сырьем в Японии стал сахар. Аккумулятор на сахаре в Японии по свойствам имеет надежность и энергоемкость выше обычных аналогов, и стоимость его ниже.
Большой спрос на литий, который вызван резким распространением переносных аккумуляторов, озаботил производителей аккумуляторов, так как этот элемент добывается только в странах с политической нестабильностью. Это явилось вторым фактором поиска альтернативных материалов для недорогих аккумуляторов с высокой надежностью. Сахароза легко преобразуется в дешевый материал для анодного сырья в литий-ионных батареях.
Сахар нагревают в условиях вакуума под давлением до 1500 градусов. Он превращается в порошок, состоящий из углерода, который может повысить заряд на 20% больше аналогичных изделий. Это явилось первым шагом в разработке дешевых батарей. Пока такие виды батарей не составляют конкуренции современным аккумуляторам. Но ученые предполагают, что в будущем подобные разработки вытеснят дорогие изделия.
Требования
Конструктивные особенности химических источников тока должны создавать условия, которые способствовали бы максимальной эффективности химических реакций.
К таким условиям можно отнести:
- Недопущение утечек тока.
- Постоянная работа.
- Герметичность.
- Раздельное помещение реагентов.
- Качественное контактирование электролита с электродами.
- Хороший отвод тока из объекта химической реакции до наружного вывода с наименьшими потерями.
К химическим элементам предъявляются требования:
- Повышенные значения свойств.
- Максимальный диапазон температуры работы.
- Наибольшее напряжение.
- Минимальная себестоимость электричества.
- Постоянное значение напряжения.
- Хорошее сохранение заряда.
- Безопасное функционирование.
- Простое обслуживание, или ее отсутствие.
- Долговременная работа.
Эксплуатация источников тока
Основное достоинство первичных элементов состоит в отсутствии надобности обслуживания. Перед работой нужно просто осмотреть их, определить срок годности. При включении в цепь нельзя путать полярность и допускать повреждения контактов. Сложные конструкции источников требуют особого ухода. Цель его заключается в удлинении срока службы до максимума.
Уход за аккумуляторами требует выполнения следующих мероприятий:
- Обеспечение чистоты.
- Контроль параметра напряжения отключенной цепи.
- Обеспечение необходимого уровня электролита, доливки дистиллированной воды.
- Проверка концентрации электролита ареометром.
При использовании батареек (гальванических элементов) нужно выполнять требования, которые относятся к применению электрических приборов.
Сфера использования
В современное время химические источники тока используются в:
- Транспорте.
- Переносных устройствах.
- Космической технике.
- Оборудовании научных исследований.
- Медицинских приборах.
Применяются в бытовой сфере:
- Батарейки (сухие).
- Батареи аккумуляторов электроники.
- Аккумуляторы на автомобилях.
Большое распространение нашли литиевые химические источники тока. Это обусловлено наличием у лития максимальной удельной энергии. Он отличается наиболее отрицательным потенциалом электрода из металлов. Батареи литий ионного типа опередили все другие источники по размеру значений удельной энергии. В настоящее время ученые разрабатывают различные усовершенствования литиевых аккумуляторов. Разработки ведутся в направлении получения конструкций корпуса сверхмалой толщины, которые будут использоваться для питания смартфонов и подобных им гаджетов, а также создание сверхмощных батарей аккумуляторов.
В последнее время серьезные работы ученых ведутся по изобретению и модернизации топливных батарей – устройств, которые создают электрическую энергию, за счет проведения химических реакций веществ, постоянно подающихся к электродам снаружи. Для окисления берут кислород, а в качестве топлива пытаются использовать водород. На основе таких батарей уже действуют некоторые опытные образцы на электростанциях.
Похожие темы:
Химический источник тока — Википедия
Хими́ческий исто́чник то́ка (аббр. ХИТ) — источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию.
История создания
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был «элемент Вольта» — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, с проволочными токовыводами. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа «вольтовым столбом». Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Даниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниеля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор, поместив скрученную в рулон тонкую свинцовую пластину в серную кислоту. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 в качестве деполяризатора с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Хьюберт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Самый старый, поныне работающий гальванический элемент — серебряно-цинковая батарея, изготовленная в Лондоне в 1840 году. Подключенный к двум таким последовательно соединенным батареям звонок работает и по сей день в Кларендонской лаборатории Оксфорда[1].
Принцип действия
Основу химических источников тока составляют два электрода (отрицательно заряженный анод, содержащий восстановитель, и положительно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
Классификация
По возможности или невозможности повторного использования химические источники тока делятся на:
- гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций невозможно перезарядить;
- электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
- топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор).
Некоторые виды химических источников тока
Гальванические элементы
Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
- Смотрите также Категория: Гальванические элементы.
| Тип | Катод | Электролит | Анод | Напряжение, В |
|---|---|---|---|---|
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1,56 |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1,65 |
| Марганцево-магниевый элемент | MnO2 | MgBr2 | Mg | 2,00 |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2,55 |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2,42 |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1,92 |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1,36 |
| Ртутно-кадмиевый элемент | HgO2 | KOH | Cd | 1,92 |
| Окисно-ртутно-оловянный элемент | HgO2 | KOH | Sn | 1,30 |
| Хром-цинковый элемент | K2Cr2O7 | H2SO4 | Zn | 1,8—1,9 |
Другие типы:
Электрические аккумуляторы
Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
- Смотри также Категория: Аккумуляторы.
Топливные элементы
Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
- Смотри также Категория: Топливные элементы.
Примечания
- ↑ Exhibit 1 — The Clarendon Dry Pile». Oxford Physics Teaching, History Archive. Retrieved 18 January 2008
- ↑ В демонстрационных экспериментах зачастую используют мякоть плодов апельсина, яблоки и пр.
Литература
- Дасоян М. А. Химические источники тока. — 2-е изд. — Л., 1969.
- Романов В. В., Хашев Ю. М. Химические источники тока. — М., 1968.
- Орлов В. А. Малогабаритные источники тока. — 2-е изд. — М., 1970.
- Вайнел Д. В. Аккумуляторные батареи. — пер. с англ., 4-е изд. — М. — Л., 1960.
- The Primary Battery / ed. G. W. Heise, N. C. Cahoon. — N. Y. — L., 1971. — Т. v. 1.
Ссылки
| |||
Химические источники тока.
Обозначение на схеме и устройство химических источников тока
К химическим источникам тока причисляют гальванические элементы и аккумуляторы. Есть и другие химические источники тока, но они менее распространены. В обиходе гальванический элемент получил название батарейка. Это не совсем верное определение, так как батарейкой можно назвать несколько отдельных гальванических элементов соединённых вместе – это и есть батарея питания или батарейка.
Узнайте подробнее о правильном соединении элементов питания.
На принципиальных схемах гальванический элемент обозначается так.

Так обозначают один гальванический элемент или один элемент аккумулятора.
Но поскольку номинальное напряжение на одном гальваническом элементе обычно не более 1,5 вольта, их соединяют в батареи питания. Батарея питания на принципиальной схеме обозначается вот так.

Здесь показано, что батарея питания состоит из двух отдельных гальванических элементов. Общее напряжение на полюсах этой составной батареи — 3 вольта из расчёта, что каждый из элементов имеет на полюсах напряжение 1,5 вольта. Также на схемах можно встретить и такое обозначение.

Это тоже условное изображение батареи питания или батарейки на принципиальной схеме, только здесь не уточняется, сколько именно гальванических элементов используется в батарее, а указано лишь общее напряжение на полюсах батареи.
Одиночный аккумуляторный элемент обозначается на схемах так же, как и отдельный гальванический элемент. Номинальное напряжение одного аккумуляторного элемента обычно составляет около 1,25 вольт. Чтобы получить аккумулятор с большим напряжением аккумуляторные элементы соединяют вместе – получается аккумуляторная батарея или просто аккумулятор. Обозначение аккумуляторной батареи на схемах такое же, как и батареи, составленной из гальванических элементов.
Чем гальванический элемент отличается от аккумулятора?
Дело в том, что гальванический элемент сам является источником постоянного тока, который образуется за счёт необратимой химической реакции. Гальванический элемент причисляют к первичным источникам тока.
Аккумулятор является так называемым вторичным источником тока. Почему? Потому, что перед тем, как использовать аккумулятор, его нужно предварительно зарядить от источника постоянного тока — зарядника. Только после полной зарядки аккумулятор сможет питать электронное устройство. Отличительным качеством аккумуляторов является то, что их можно заряжать и разряжать много раз. В отличие от аккумулятора, гальваническая батарея питания после своего полного разряда не может быть использована повторно.
Какие существуют батарейки?
Наибольшее распространение в настоящее время получили щелочные батареи питания. Их ещё называют алкалиновыми – производное от английского слова alkaline – «щелочь».
Работа щелочной батарейки основана на окислительно-восстановительной химической реакции между цинком и диоксидом марганца. Результатом, а точнее полезным продуктом этой реакции является электрический постоянный ток и тепло, которое не используется. Электрическая ёмкость щелочной батарейки составлет около 1700 — 3000 мАч. По величине своей ёмкости, щелочные батарейки лидируют по сравнению с солевыми батарейками, электроёмкость которых меньше и составляет 550 — 1100 мАч.
Щелочная батарейка устроена следующим образом. Взглянем на рисунок.

Корпусом элемента является никелированный стальной стакан. Он же является плюсовым контактом батарейки «+». Активная масса представляет собой смесь диоксида марганца (MnO2) и графита. Анодная паста – это смесь порошка цинка (Zn) и густого щелочного электролита. Электролитом обычно служит раствор гидроксида калия (KOH). Анодная паста отделена от активной массы сепаратором. Сепаратор разделяет реагенты, исключая их перемешивание и нейтрализацию заряда. Также сепаратор пропитан электролитом.
Отрицательный потенциал снимается с латунного стержня, который окружён анодной пастой. Стальная тарелка контактирует с латунным стержнем – токосъёмником и является отрицательным контактом элемента «—».
Прокладка изолирует никелированный стальной стакан от стальной тарелки, препятствуя тем самым короткому замыканию. Кроме этого прокладка сдерживает давление газа, который в незначительном количестве образуется при химической реакции. В толще прокладки имеется защитный клапан или по-другому предохранительная мембрана. Защитный клапан служат для того, чтобы при чрезмерном давлении газа сработать и выпустить его наружу. Это предотвращает взрыв щелочного элемента, но и приводит к его разгерметизации. Как правило, разгерметизация приводит к течи электролита.
Иногда, забыв вынуть уже подсевшие батарейки, через некоторое время можно обнаружить, что в батарейном отсеке появилась какая-то жидкость. Это и есть потёкший электролит. Он может вызвать коррозию контактов. Поэтому на упаковке с батарейками можно найти предупреждение о том, что севшие элементы нужно вынимать из электроприборов. Теперь вы знаете, зачем это нужно делать.
Итак, с устройством разобрались, теперь поговорим о том, как работает щелочной элемент.
Как работает щелочной элемент.
Для начала, маленькое отступление…
Как вы заметили, почему то анодная паста соединяется с помощью токосъёмника с отрицательным контактом элемента – стальной тарелкой. А ведь анод – это «+». Получается нестыковочка…
В чём тут дело? А дело в том, что в электронике есть один каламбур. По умолчанию, за направление тока в электрической цепи считается направление от плюса (анода) к минусу (катоду) – так повелось ещё с тех времён, когда электроника ещё зарождалась.
Но ведь электрический ток, как известно, это упорядоченное движение электронов, которые имеют отрицательный заряд. И поэтому, ток течёт оттуда, где есть избыток электронов, в направлении, где есть нехватка отрицательных зарядов (это и есть плюс – недостаток электронов). При этом получается, что ток течёт в реальности от отрицательного контакта к положительному. Именно поэтому образуется эта нестыковка, которая порой вводит начинающих радиолюбителей в ступор.
В электрохимии анодом принято считать тот электрод, на котором происходит процесс окисления. Так вот в щелочной батарейке (и не только) на аноде в результате окисления образуется избыток электронов. То есть по сути – это катод, «минус». Но, как уже говорилось, в электрохимии всё наоборот. Итак, электроны вырабатываются анодной пастой – смесью цинкового порошка (Zn) и густого электролита (раствора KOH).
Катодом же считается электрод, где происходит реакция восстановления. Далее электроны, которые были получены в результате реакции окисления, проходят по электрической цепи электронного прибора, и возвращаются опять в батарейку, но уже на катод, где эти электроны используются для восстановительной химической реакции. Катод – это диоксид марганца. Токоприёмником катода служит никелированный стальной стакан, который контактирует с активной массой – диоксидом марганца (MnO2).
Вот такая игра в наоборот. Напомню ещё раз, что в электронике за направление тока в цепи считается направление от плюса-«анода» к минусу-«катоду». В электрохимии всё наоборот. С этим и связаны особенности в названии реагентов химического источника тока.
Можно ли заряжать батарейки?
 Также часто можно слышать вопрос: «Можно ли заряжать батарейки?» Ответим: «Лучше не стоит». Дело в том, что для вырабатывания электрической энергии в батарейках используется необратимая химическая реакция. Поэтому батарейка и является первичным источникам тока.
Также часто можно слышать вопрос: «Можно ли заряжать батарейки?» Ответим: «Лучше не стоит». Дело в том, что для вырабатывания электрической энергии в батарейках используется необратимая химическая реакция. Поэтому батарейка и является первичным источникам тока.
А вот в аккумуляторах используется обратимая химическая реакция, которая позволяет заряжать и разряжать их множество раз. Поэтому аккумуляторы и называют вторичными источниками тока.
Несмотря на это, известно, что щелочные элементы допускают перезарядку, т.е. их можно зарядить и использовать повторно. Но такие, перезаряжаемые щелочные элементы имеют свою особую конструкцию. Также стоит отметить, что даже такие элементы нельзя перезаряжать много раз, обычно не более 25. В широкой продаже такие щелочные элементы не встречаются. Их маркируют как Rechargeable Alkaline Manganese.
Из всего этого следует, что заряжать обычные щелочные батарейки категорически не стоит. Такие эксперименты могут завершиться взрывом батарейки и разбрызгиванием электролита. А это не есть гуд +опасно для здоровья  .
.
Чтобы замедлить химическую реакцию в щелочном элементе и, тем самым, продлить срок её хранения и снизить саморазряд батареи, в них раньше добавляли кадмий и ртуть. Эти вещества замедляли химическую реакцию, и цинк окислялся медленнее. Но, из-за токсичности ртути и кадмия их сейчас не используют, а применяют другие, менее вредные ингибиторы.
На многих батарейках можно даже увидеть надпись – 0% кадмия и ртути или 0% Hg & Cd. Это своеобразный маркетинговый ход, как бы намекающий на то, что данные батарейки безопасны.
Если вы с успехом дошли до этих строк, то теперь вас можно поздравить, ведь теперь вы знаете, как устроена и работает щелочная батарейка. И поэтому её и не обязательно разбирать  . Кроме щелочных элементов питания существуют и другие, но об их устройстве мы расскажем в другой раз.
. Кроме щелочных элементов питания существуют и другие, но об их устройстве мы расскажем в другой раз.
Главная » Радиоэлектроника для начинающих » Текущая страница
Также Вам будет интересно узнать:
Химический источник тока — Википедия. Что такое Химический источник тока
Хими́ческий исто́чник то́ка (аббр. ХИТ) — источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию.
История создания
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был «элемент Вольта» — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, с проволочными токовыводами. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа «вольтовым столбом». Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Даниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниеля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор, поместив скрученную в рулон тонкую свинцовую пластину в серную кислоту. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 в качестве деполяризатора с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Хьюберт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Самый старый, поныне работающий гальванический элемент — серебряно-цинковая батарея, изготовленная в Лондоне в 1840 году. Подключенный к двум таким последовательно соединенным батареям звонок работает и по сей день в Кларендонской лаборатории Оксфорда[1].
Принцип действия
Основу химических источников тока составляют два электрода (отрицательно заряженный анод, содержащий восстановитель, и положительно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
Классификация
По возможности или невозможности повторного использования химические источники тока делятся на:
- гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций невозможно перезарядить;
- электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
- топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор).
Некоторые виды химических источников тока
Гальванические элементы
Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
- Смотрите также Категория: Гальванические элементы.
| Тип | Катод | Электролит | Анод | Напряжение, В |
|---|---|---|---|---|
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1,56 |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1,65 |
| Марганцево-магниевый элемент | MnO2 | MgBr2 | Mg | 2,00 |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2,55 |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2,42 |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1,92 |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1,36 |
| Ртутно-кадмиевый элемент | HgO2 | KOH | Cd | 1,92 |
| Окисно-ртутно-оловянный элемент | HgO2 | KOH | Sn | 1,30 |
| Хром-цинковый элемент | K2Cr2O7 | H2SO4 | Zn | 1,8—1,9 |
Другие типы:
Электрические аккумуляторы
Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
- Смотри также Категория: Аккумуляторы.
Топливные элементы
Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
- Смотри также Категория: Топливные элементы.
Примечания
- ↑ Exhibit 1 — The Clarendon Dry Pile». Oxford Physics Teaching, History Archive. Retrieved 18 January 2008
- ↑ В демонстрационных экспериментах зачастую используют мякоть плодов апельсина, яблоки и пр.
Литература
- Дасоян М. А. Химические источники тока. — 2-е изд. — Л., 1969.
- Романов В. В., Хашев Ю. М. Химические источники тока. — М., 1968.
- Орлов В. А. Малогабаритные источники тока. — 2-е изд. — М., 1970.
- Вайнел Д. В. Аккумуляторные батареи. — пер. с англ., 4-е изд. — М. — Л., 1960.
- The Primary Battery / ed. G. W. Heise, N. C. Cahoon. — N. Y. — L., 1971. — Т. v. 1.
Ссылки
| |||
Химический источник тока — Википедия
Хими́ческий исто́чник то́ка (аббр. ХИТ) — источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию.
История создания
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был «элемент Вольта» — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, с проволочными токовыводами. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа «вольтовым столбом». Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Даниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниеля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор, поместив скрученную в рулон тонкую свинцовую пластину в серную кислоту. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 в качестве деполяризатора с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Хьюберт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Самый старый, поныне работающий гальванический элемент — серебряно-цинковая батарея, изготовленная в Лондоне в 1840 году. Подключенный к двум таким последовательно соединенным батареям звонок работает и по сей день в Кларендонской лаборатории Оксфорда[1].
Принцип действия
Основу химических источников тока составляют два электрода (отрицательно заряженный анод, содержащий восстановитель, и положительно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
Классификация
По возможности или невозможности повторного использования химические источники тока делятся на:
- гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций невозможно перезарядить;
- электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
- топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор).
Некоторые виды химических источников тока
Гальванические элементы
Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
- Смотрите также Категория: Гальванические элементы.
| Тип | Катод | Электролит | Анод | Напряжение, В |
|---|---|---|---|---|
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1,56 |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1,65 |
| Марганцево-магниевый элемент | MnO2 | MgBr2 | Mg | 2,00 |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2,55 |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2,42 |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1,92 |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1,36 |
| Ртутно-кадмиевый элемент | HgO2 | KOH | Cd | 1,92 |
| Окисно-ртутно-оловянный элемент | HgO2 | KOH | Sn | 1,30 |
| Хром-цинковый элемент | K2Cr2O7 | H2SO4 | Zn | 1,8—1,9 |
Другие типы:
Электрические аккумуляторы
Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
- Смотри также Категория: Аккумуляторы.
Топливные элементы
Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
- Смотри также Категория: Топливные элементы.
Примечания
- ↑ Exhibit 1 — The Clarendon Dry Pile». Oxford Physics Teaching, History Archive. Retrieved 18 January 2008
- ↑ В демонстрационных экспериментах зачастую используют мякоть плодов апельсина, яблоки и пр.
Литература
- Дасоян М. А. Химические источники тока. — 2-е изд. — Л., 1969.
- Романов В. В., Хашев Ю. М. Химические источники тока. — М., 1968.
- Орлов В. А. Малогабаритные источники тока. — 2-е изд. — М., 1970.
- Вайнел Д. В. Аккумуляторные батареи. — пер. с англ., 4-е изд. — М. — Л., 1960.
- The Primary Battery / ed. G. W. Heise, N. C. Cahoon. — N. Y. — L., 1971. — Т. v. 1.
Ссылки
| |||
Химические источники электрического тока
(аккумуляторы), устройства, вырабатывающие электрическую энергию путем прямого преобразования химической энергии окислительно-восстановительных реакций. Первые химические источники были созданы в XIX веке (гальваническая батарея, 1800, ячейка Даниэля, 1836, ячейка Лекланше, 1865). До 1860-х годов химические источники были единственными источниками электроэнергии для электрического оборудования и лабораторных исследований.
Сердце химических источников электрического тока состоит из двух электродов, один из которых содержит окислитель, а другой — восстановитель, находящихся в контакте с электролитом.Между электродами устанавливается разность потенциалов, составляющая электродвижущую силу (ЭДС), соответствующую свободной энергии реакции окисления-восстановления. Функционирование химических источников тока основано на возникновении в замкнутой внешней цепи пространственно разделенных процессов: на отрицательном электроде восстановитель окисляется с образованием свободных электронов, которые перемещаются по внешней цепи (создавая ток разряда) к положительному электроду, где они участвуют в восстановлении окислителя.
В зависимости от рабочих характеристик и электрохимической системы (сочетание реагентов и электролита) химические источники электрического тока делятся на первичные элементы, которые обычно перестают функционировать после израсходования реагентов (после разряда), и вторичные или хранящиеся , ячейки, в которых регенерируются реагенты при зарядке (ввод тока от внешнего источника). Деление произвольное, так как некоторые клетки могут частично заряжаться. К важным и многообещающим химическим источникам электрического тока относятся топливные элементы (электрохимические генераторы), которые подходят для длительных периодов непрерывной работы благодаря тому, что электроды непрерывно снабжаются свежими реагентами, а продукты реакции удаляются. .Конструкция резервных батарей позволяет хранить батареи в неактивном состоянии в течение 10–15 лет.
С начала 20 века производство химических источников электрического тока неуклонно расширялось в связи с развитием автомобильного транспорта и электротехники, а также все более широким использованием электронного и другого оборудования с независимыми источниками питания. В коммерчески доступных химических источниках тока наиболее часто используемыми окислителями являются PbO 2 , NiOOH и MnO 2 ; Восстановителем служат Pb, Cd, Zn и другие металлы.Электролиты представляют собой водные растворы щелочей, кислот или солей.
Основные характеристики нескольких химических источников электрического тока показаны в таблице 1. Разрабатываемые источники, основанные на более активных электрохимических системах, обладают наиболее желательными характеристиками. Таким образом, в неводных электролитах (органических растворителях, конденсированных солях или твердых соединениях с ионной проводимостью) щелочные металлы можно использовать в качестве восстановителя. Топливные элементы позволяют использовать высокоэнергетические жидкие или газовые реагенты.
СПИСОК ЛИТЕРАТУРЫ
Дасоян, М.А. Химические источники тока , 2-е изд. Ленинград, 1969.
| Таблица 1. Характеристики химических источников электрического тока | |||||||
|---|---|---|---|---|---|---|---|
| Тип источника | Состояние разработки 1 | Электрохимическая система | Напряжение разряда ( В) | Удельная энергия ( Вт-час / кг) | Удельная мощность ( Вт / кг) | Прочие характеристики | |
| Номинальная | Максимум | ||||||
| 1 (A) серийное производство; (B) опытное производство; (C) стадия разработки, в скобках указаны прогнозируемые характеристики. | |||||||
| Примечание: Технические характеристики, в частности удельная мощность, являются приблизительными, поскольку данные разных фирм и авторов различаются | |||||||
| Первичные элементы | Срок годности (лет) | ||||||
| Марганцевая соль …………… | A | (+) MnO 2 | NH 4 Cl, ZnCl 2 | Zn (-) | 1.5–1.0 | 20–60 | 2–5 | 20 | 1–3 |
| Марганец щелочной …………… | A | (+) MnO 2 | KOH | Zn (-) | 1,5–1,1 | 60–90 | 5 | 20 | 1–3 |
| Ртуть-цинк …………. .. | A | (+) HgO | KOH | Zn (-) | 1,3–1,1 | 110–120 | 2–5 | 10 | 3–5 |
| Литий (неводный)…………… | B | (+) (C) | SOCl 2 , LiAlCl 4 | Li (-) | 3,2–2,6 | 300–450 | 10–20 | 50 | 1–5 |
| Вторичные элементы | Период работы (циклы) | ||||||
| Свинцово-кислотный …… ……… | A | (+) PbO 2 | H 2 SO 4 | Pb (-) | 2.0–1,8 | 25–40 | 4 | 100 | 300 |
| 25–35 | 4 | 100 | 2,000 | ||||
| Никель-кадмий и железо -никелевый щелочной …………… | A | (+) NiOOH | KOH | Cd, Fe (-) | 1,3–1,0 | 100–120 | 10– 30 | 600 | 100 |
| Серебро-цинк …………… | A | (+) Ag 2 O, AgO | KOH | Zn (-) | 1,7–1,4 | 100–120 | 10–30 | 600 | 100 |
| Никель-цинк …………… | B | (+) NiOOH | KOH | Zn (-) | 1,6–1,4 | 60 | 5–10 | 200 | 100 –300 |
| Никель-водородный …………… | B | (+) NiOOH | KOH | H 2 (Ni) (-) | 1,3– 1,1 | 60 | 10 | 40 | 1,000 |
| Цинк-воздух…………… | C | (+) O 2 (C) | KOH | Zn (-) | 1,2–1,0 | 100 | 5 | 20 | (100) |
| Серно-натриевая …………… | C | (+) S | NaO-9Al 2 O 3 | Na ( -) | 2,0–1,8 | 200 | 50 | 200 | (1000) |
| Топливные элементы | Срок службы (часов) | ||||||
| Водородно-кислородный…………… | B | (+) O 2 (C, Ag) | KOH | H 2 (Ni) (-) | 0,9–0,8 | — | — | 30–60 | 1,000–5,000 |
| Гидразин-кислород …………… | B | (+) O 2 ( C, Ag) | KOH | N 2 H 4 (Ni) (-) | 0,9–0,8 | — | — | 30–60 | 1000–2000 |
Романов В.В., и Ю. М. Хашев. Химические источники тока . М., 1968.
Орлов В.А. Малогабаритные источники тока , 2-е изд. Москва, 1970.
Виналь, Г.В. Аккумуляторные батареи , 4-е изд. Москва-Ленинград, 1960. (Пер. С англ.)
Первичная батарея , т. 1. Под редакцией Г. В. Хайсе и Н. К. Кахуна. Нью-Йорк-Лондон, 1971.
Большая советская энциклопедия, 3-е издание (1970–1979). © 2010 The Gale Group, Inc. Все права защищены.
.
Электролиты для высокотемпературных химических источников тока: системы образования и исследования, состав и свойства
1. Химические источники тока: Справочник. Стручок красный. Коровина Н.В., Скундина А.М., М .: Изд-во МЭИ, 2003.740 с. (на русском).
2. Делимарский Ю. К. Пути практического использования ионных расплавов / К. Пути практического использования ионных расплавов. Ионные расплавы. 1975. №2. 3. С. 3–22.
3. Присяжный В.Д., Кириллов С. А. Химические процессы в расплавленных солевых средах. Ионные расплавы. 1975. №2. 3. С. 82–90.
4. Гаркушин И. К., Дворьянова Е. М., Губанова Т. В., Сухаренко М. А. Функциональные материалы. Самара, СамГТУ, 2015, гл. 1, 387 с. (на русском).
5. Гаркушин И. К., Губанова Т. В., Фролов Е. И., Дворянова Е. М., Истомова М. А., Гаркушин А. И. Функциональные материалы на основе мультинациональных солевых систем.Журнал Неорганическая химия, 2015, т. 60, нет. 3. С. 324–341.
6. Справочник по расплавленным солям. / Под ред. А.Г. Морачевского (в 3-х томах). Москва, Химия, 1971, т. 1, 168 с. (на русском).
7. Гаркушин И.К., Фролов Е.И., Губанова Т.В. Поиск оптимальных солевых составов электролитов для химических источников тока и теплоаккумулирующих материалов по двум параметрам. ].[Электрохимическая энергетика], 2011, т. 11, вып. 2. С. 93–102.
8. Сорокина Е. И., Гаркушин И. К., Губанова Т. В. Поиск солевых составов электролитов для химических источников тока и теплоаккумулирующих материалов на основе пятикомпонентной взаимной системы Ли, К | F, Cl, VO_3, MoO_4 [Поиск солевых составов электролитов для химических источников тока и теплоаккумулирующих материалов на основе взаимной системы компонентов тракта Li, K || F, Cl, VO_3, MoO_4].[Электрохимическая энергетика], 2012, вып. 12, вып. 3. С. 129–138.
9. Гаркушин И. К., Трунин А. С. Экспериментальное выявление низкоплавких областей в многокомпонентных системах. Москва, 1988. Деп. v ВИНИТИ нет. 5655-В88, 57 с. (на русском).
10. Гаркушин И.К., Тюмиков Д.К. Метод определения низкоплавких составов и областей в многокомпонентных системах.VII Всесоюзн. совет. по физ-хим. анализу [VII Всесоюз. итоги конференции. для физико-химического. анализ]. Фрунзе, Илим, 1988. С. 30–31.
11. Гаркушин И.К., Трунин А.С., Мифтахов Т.Т. Выделение низкоплавких концентрационных областей в многокомпонентных системах. Журн. неорган. химий [Журнал неорганической химии], 1989, т. 34, нет. 3. С. 766–770.
12. Егунов В.П. Введение в термический анализ. Самара: СамВен, 1996.270 с. (на русском).
13. Васина Н. А., Грызлова Е. С., Шапошникова С. Г. Теплофизические свойства многокомпонентных солевых систем. Москва, Химия, 1984, 99 с. (на русском).
14. Трунин А.С., Космынин А.С. Проектно-термографический метод исследования гетерогенных равновесий в конденсированных многокомпонентных системах.6 N01M 6 \ slash 20, заявка от 09 декабря 2012 г.
25. Гаркушин И.К., Губанова Т.В., Петров А.С., Анипченко Б.В. Фазовые равновесия в системах с участием метаванадатов некоторых щелочных металлов. Москва, «Машиностроение-1», 2005, 118 с. (на русском).
26. Баталов Н. Н. Высокотемпературная электрохимическая энергетика. Успехи и проблема [Электрохимическая энергия. Успехи и вызовы.XI Международная конференция по физической химии и электрохимии расплавленных и твердых электролитов. Екатеринбург, 1998. Т. 1. С. 3–4.
27. Баталов Н. Н., Архипов Г. Г. Высокотемпературные литии-воздушные аккумуляторы. Проблемы и возможности пути решения. Проблемы и возможные решения. IV Международная конференция «Фундаментальные проблемы преобразования энергии в литиевых электрохимических системах». IV Международная конференция «Фундаментальные проблемы преобразования энергии в литиевых электрохимических системах».Москва, 1996. С. 151–152.
.
Управляющие источники тока — Большая химическая энциклопедия
HII1T Gl — это источник тока, управляемый напряжением. Ток через Gl в 0,5 раза больше напряжения Vx. Обратите внимание, что Vx — это напряжение в узле V2 минус напряжение в узле V3. Нет необходимости добавлять текст Vx в вашу схему. [Pg.174]
В общем, для электролиза с регулируемым током требуется менее дорогое оборудование. Необходим только источник управляемого тока в сочетании с кулоновским интегратором.Поэтому в промышленности электроорганические реакции всегда проводят при фиксированной плотности тока. В лаборатории рекомендуется начинать с электролиза с регулируемым потенциалом, используя потенциостат и трехэлектродную электролизерную ячейку (рис. 22.8). Таким образом, реакцией можно управлять с помощью аналитически определенного окислительно-восстановительного потенциала субстрата, а селективность процесса можно изучить при различных потенциалах. После определения факторов, регулирующих селективность, обычно можно перейти к регулированию тока путем правильного выбора плотности тока и концентрации субстрата.Используя непрерывный процесс, концентрацию можно установить на желаемом уровне. Таким образом, селективность также может быть получена в этих условиях. [Pg.676]
Усилители с обратной связью по току всегда состоят из алмазного транзистора (DT) и буферного каскада, подключенного внутри. OPA660 [42] или его замена OPA860 [43] обеспечивает раздельный доступ к обеим частям схемы, так что доступны источник тока, управляемый напряжением (OTA) с полосой пропускания 90 МГц и буферный каскад с полосой пропускания 700 МГц.В отличие от обычных транзисторов алмазный транзистор, температура стабильной рабочей точки которого определяется изнутри, допускает четырехквадрантную работу. OTA обеспечивает необходимый почти идеальный транзистор для создания генератора с эмиттерной связью. [Pg.36]
В идеале, TFT привода был бы идеальным источником тока с регулируемым напряжением, в котором ток, подаваемый на OLED, является функцией только напряжения данных, и эта функция не является равномерной по всему дисплею. Даже если ток является сложной нелинейной функцией напряжения данных, эту функцию можно определить заранее, а данные можно деформировать, чтобы учесть нелинейность.К сожалению, ток … [Pg.583]
РИСУНОК 23 Условное обозначение электрической схемы для (a) источника напряжения, управляемого напряжением (VCVS), (b) источника напряжения, управляемого током (CCVS), (c) напряжения- управляемый источник тока (VCCS), (d) управляемый током источник тока (CCCS). [Стр.113]
Два типа зависимых источников тока схематически изображены на Рис. 2.3 (c) и Рис. 2.3 (d). На рисунке 2.3 (c) изображен источник тока, управляемый напряжением (VCCS), для которого контролируемый ток io t), протекающий по электрическому пути от клеммы 3 к клемме 4, определяется управляющим напряжением v, (t), установленным на клеммах 1. и 2.Управляемый ток, следовательно, может быть записан как … [Pg.113]
РИСУНОК 7.50 Транзистор усилителя класса A может быть смоделирован как управляемый током источник тока с внутренним выходным сопротивлением R. Когда R = Rl, половина от мощность коллектора рассеивается в R, а другая половина — в Ri, обеспечивая максимальный КПД ijmax 50%. Это согласуется с формулой. (7.31). Не показаны согласующие цепи, преобразующие r e и R1 в стандартный импеданс, такой как 50 2. [Pg.588]
РИСУНОК 7.56 Ненасыщенный усилитель класса C может быть смоделирован как источник тока с регулируемым током с измеримым входным сопротивлением при возбуждении и внутренним выходным сопротивлением, определяемым энергоэффективностью, ij Rmt делит мощность с J sl>, но Rint oo, когда ij … [Pg.597]
Чтобы построить N, заданное N, источники напряжения, контролируемые напряжением в N, заменяются источниками тока, управляемыми током, в N с парами входных клемм источников, замененными парами выходных клемм, как показано на рис. .7.147. Пассивные элементы R, L и C оставлены без изменений. Получающиеся в результате сети называются … [Pg.671]
РИСУНОК 7.147 Источники напряжения, управляемые напряжением, заменяются источниками тока, управляемыми током, при этом пары входных и выходных клемм заменяются для получения N из данной сети N. [ Pg.671]
Измерительная установка построена для проверки расчетного производства газа во время электролиза в соответствии с уравнением 9. Для электролиза используется источник тока, управляемый компьютером (CCCS). Источник тока имеет два диапазона тока: 0–100 пА и 0–2 мА.Отверстия для подключения резервуаров заделаны эпоксидной смолой (Araldit). Затем калибровочную систему погружают в раствор электролита. Электролит состоит из 200 мМ раствора KNO3, к которому добавлено некоторое количество детергента (Tween 20). При использовании вакуумной системы воздух внутри калибровочной системы заменяется раствором электролита. [Pg.73]
| Рис. 12. Измерительная установка, состоящая из управляемого компьютером источника тока (cccs) для вызова пузырьков газа путем электролиза и ccd-камеры для наблюдения за вытеснением жидкости. |  |
Macias R, Seoatte F arxl Bragos R. (2010) Выполнение одиночного операционного усилителя с управляемым напряжением источника тока нагрузки в контуре на основе параметров операционного усилителя. Международная конференция по электрическому биоинпедансу Публикация журнала конференции по физике, серия 224 … [Pg.64]
Продолжив smdies, мы смогли показать, что источник ионов ES, как показано на рисунке 3.1, работает электрохимически аналогично традиционной проточной ячейке электрохимии с контролируемым током (CCE). «Обычная проточная ячейка CCE содержит рабочий электрод, противоэлектрод и источник управляемого тока для установки величины ток через ячейку, то есть ток ячейки, по нашему мнению … [Pg.81]
Капилляр с протекающим раствором действует как источник тока 5, включенный в электрическую цепь с использованием двух электродов Ag / AgCl. Другое напряжение -управляющий источник тока 6 также включен в схему.Это позволяет получить полную электрическую характеристику раствора в капилляре, то есть зависимость разности потенциалов E на концах капилляра от тока I. [Стр.364]
.
Источники тока катодной защиты — Большая химическая энциклопедия
| Рис. 10.9 Диаграмма, иллюстрирующая источник ИК-погрешности измерения потенциала на катодно защищенной конструкции. BA — это абсолютный электродный потенциал структуры, CD — это абсолютный электродный потенциал анода, а CB — это градиент поля в окружающей среде, обусловленный потоком тока катодной защиты. Электрод сравнения, размещенный в точке E, будет давать ИК-ошибку EF при измерении потенциала структуры.Если поместить в G, ошибка будет уменьшена до GH. В точке B ошибки не будет, но точка находится слишком близко к конструкции, чтобы можно было вставить электрод сравнения. Если ток прерывается, поле сразу становится таким, как показано пунктирной линией, и ИК не включается … |  |
Для другого метода катодной защиты источником электронов является приложенный ток от внешнего источника постоянного тока, как показано на рисунке 17.23ч для подземного резервуара. Отрицательный вывод источника питания подключается к защищаемой конструкции. Другой вывод соединен с инертным анодом (часто графитом), который в данном случае закопан в грунт. Материал обратной засыпки с высокой проводимостью обеспечивает хороший электрический контакт между анодом и окружающей почвой. Путь тока существует между … [Pg.708]
Коррозия из-за паразитного тока — металл подвергается атаке в точке выхода тока. Как правило, такого рода повреждения могут наблюдаться в заглубленных сооружениях вблизи систем катодной защиты или постоянный ток утечки может происходить от источников железнодорожной тяги.[Pg.2733]
Мало что известно о том, что Томас Альва Эдисон пытался обеспечить катодную защиту судов с наложенным током в 1890 году, однако доступные ему источники тока и анодные материалы были неадекватными. В 1902 г. К. Коэн добился практической катодной защиты с помощью приложенного постоянного тока. Заведующий городскими работами на … [Стр.12]
Ток, необходимый для катодной защиты наложенным током, подается от выпрямительных блоков. В Германии сеть общего электроснабжения настолько обширна, что в большинстве случаев к ней можно подключить трансформатор-выпрямитель (T-R).Солнечные элементы, термогенераторы или, для низких защитных токов, батареи используются в качестве источника тока только в исключительных случаях (например, в малонаселенных районах), где отсутствует общественное электроснабжение. На рис. 8-1 показана конструкция станции катодной защиты от импульсного тока для трубопровода. Корпус, конструкция и электрическая схема выпрямителя описаны в этой главе. В главе 7 представлена информация об анодах с подаваемым током. [Pg.225]
Электрические источники статического электричества, электрического тока, молнии, паразитных токов (радиочастотное электромагнитное излучение, воздушные линии передачи высокого напряжения, паразитные токи гальванической и катодной защиты)… [Стр.59]
Современная процедура минимизации потерь от коррозии на подземных сооружениях заключается в использовании защитных покрытий между металлом и почвой и катодной защите металлических конструкций (см. Главу 11). В этой ситуации загрязнения влияют на работу несколько иначе, чем в случае незащищенного чистого металла. Для размещения анодов желателен грунт с умеренно высоким содержанием солей (низким удельным сопротивлением). Если приложенный потенциал исходит от жертвенного металла, эффективный потенциал и доступный ток будут зависеть от свойств почвы, таких как pH, наличие растворимых солей и влажности.Когда выпрямители используются в качестве источника катодного потенциала, желательны почвы с низким электрическим сопротивлением для расположения анодных слоев. Защитное покрытие, не имеющее утечек и обладающее неизменно высоким значением изоляции, снижает значимость электропроводных свойств почвы по отношению к скорости коррозии (раздел 15.8). [Стр.385]
Влияние паразитных токов, возникающих из-за постоянного тока. источника или от катодной защиты прилегающей конструкции рассматриваются в разделах 11.5 и 11.6. [Стр.503]
| Рис. 10.4 Полярная диаграмма, отображающая коррозию и катодную защиту. Корродирующий металл самопроизвольно принимает на себя потенциальную коррозию и корродирует со скоростью, заданной как / con. Если потенциал должен быть понижен до тока, равного (/ c — li), должен подаваться от внешнего источника, металл будет растворяться со скоростью, равной li … |  |
Рисунок 10.7 иллюстрирует использование внешнего источника питания для обеспечения катодной поляризации структуры. Схема включает источник питания, вспомогательный электрод или электрод наложения тока, коррозионный раствор и защищаемую конструкцию. Источник питания пропускает положительный ток от наложенного токового электрода через коррозионный раствор на конструкцию. Таким образом, структура катодно поляризуется (ее потенциал понижается), и положительный ток возвращается через цепь к источнику питания.Таким образом, для достижения катодной защиты электрод наложенного тока и конструкция должны находиться как в электролитическом, так и в электронном контакте. [Pg.116]
В системе катодной защиты с наложенным током источник питания обладает значительной способностью передавать ток, и можно изменить состояние поляризации структуры, изменив этот ток. Таким образом, эффективное управление системой зависит от достоверных потенциальных измерений. Поскольку выходной ток любого данного анода является значительным, высока вероятность ошибки ИК-излучения, которая может достигать многих сотен милливольт при любых возможных измерениях.Таким образом, метод мгновенного отключения (или некоторые другие средства предотвращения ИК-ошибки) важен для эффективного управления системой. [Стр.125]
В отличие от этого система катодной защиты, основанная на расходуемых анодах, изначально разрабатывалась для достижения необходимого потенциала защиты. Если этого не добиться на практике, то не будет никакой функции контроля, которая могла бы улучшить ситуацию. Потребуется некоторая модернизация системы. Кроме того, токи от каждого источника тока (расходуемые аноды) невелики, так что градиенты поля в окружающей среде не являются значительными.Сразу ясно, что измерения потенциала в этом случае менее значимы, а измерения мгновенного отключения не нужны и невозможны. [Pg.125]
Цепь системы катодной защиты с наложенным током включает анод, источник питания, структуру и среду, в которой он … [Pg.129]
Самый последний разработанный анод для катодной защиты из стали в бетоне смешанная титановая сетка с оксидным металлическим покрытием Анодная сетка изготовлена из технически чистого титанового листа толщиной примерно 0-5-2 мм в зависимости от производителя, расширенного для получения сетки в форме ромба размером от 35 x 75 до 100 x 200 мм.Выбранный размер ячейки определяется требуемой плотностью катодного тока и производителем сетки. Анодная сетка поставляется в виде полос, которые могут быть соединены на месте с помощью точечной сварки соединений с титановой полосой или ниобиевыми зажимами, в то время как электрические соединения с постоянным током. источники питания изготавливаются в выбранных местах в подходящем герметизированном или гофрированном соединении. Затем сетка прикрепляется к бетону с помощью неметаллических креплений. [Стр.191]
Сравнение типичных свойств материалов катодной защиты приведено в таблице 10.23, но ни в коем случае не является исчерпывающим. Очевидно, что изменение сплава, окружающей среды или других важных факторов отразится на сроке службы и выходных характеристиках. В некоторых случаях рекомендуемые максимальные значения напряжения и плотности тока могут быть значительно превышены. В других случаях, особенно там, где встречаются аномальные уровни растворенных твердых веществ в окружающей среде, следует применять факторы безопасности для изменения предложенных значений. Принятие значительно сокращенного или неопределенного срока службы в сравнении с возможной экономией также может повлиять на выбранные рабочие пределы.Например, срок службы анодов из черных сплавов на практике может составлять лишь две трети от ожидаемого из-за преимущественной атаки, в конечном итоге приводящей к отключению всего или части анода от источника ЭДС. [Pg.193]
Преимущества Внешний источник питания не требуется. Установка относительно проста. Опасность взаимодействия катодной защиты сведена к минимуму. Более экономичен для небольших схем. Для небольших схем снижается опасность чрезмерной защиты. кроме обычных проверок и замены анодов по окончании срока службы, никаких текущих затрат.[Pg.203]
Определение удельного сопротивления электролита Чтобы разработать удовлетворительную схему катодной защиты, необходимо определить удельное сопротивление электролита (почвы или воды). Эта информация необходима для определения выходного тока анодов вместе с их положением и напряжением источника питания, а также обеспечивает индикацию агрессивности окружающей среды в целом, чем ниже удельное сопротивление, тем агрессивнее окружающая среда. [Стр.207]
Импульсный ток Катодный ток, подаваемый от постоянного тока. источник к конструкции, чтобы снизить потенциал до защитного потенциала для катодной защиты. [Pg.1376]
Катодная защита. Сталь может быть защищена катодным током, подаваемым либо от протекторных анодов, либо от внешнего источника постоянного тока. Метод эффективен для полностью погруженной стали, то есть для поверхностей на конструкциях ниже уровня отлива. Потребление тока можно значительно снизить, нанеся на сталь подходящую систему окраски перед погружением в морскую воду.Такая система окраски должна быть стойкой к щелочам. [Стр.38]
Катодная защита. Еще один способ удержания металла в катодном состоянии — подключить его к внешнему источнику постоянного тока. Для небольших конструкций, таких как лодки и водонагреватели для бытовых нужд, ток подается с помощью анода, изготовленного из алюминия или цинка. Для больших протяженных сооружений, таких как опоры и подземные трубопроводы, обычно используется внешний источник питания от сети или фотоэлектрический источник питания. (Все межгосударственные нефтепроводы в U.S. по закону обязаны использовать катодную защиту.) … [Pg.35]
| Рис. 12.38. Катодная защита также может быть выполнена с помощью инертного вспомогательного электрода и подачи тока в цепь от внешнего источника тока. |  |
В точках, где ток входит в структуру, участок станет катодным по своей природе из-за изменений потенциала, а область, где ток выходит из металла, станет анодной.Электрические железные дороги, катодная защита, электросварочные аппараты и заземленные источники постоянного тока подвержены коррозии от блуждающих токов. (Крейг) 5 … [Pg.354]
Катодная защита наложенным током предполагает использование внешнего источника питания в сочетании со стабильным анодом. Потенциал защищаемого образца вынужден принимать отрицательные значения по отношению к его потенциалу коррозии в разомкнутой цепи, и, следовательно, скорость его анодного растворения снижается. Результат наложения катодного тока на структуру показан на рис.21M для параметров, используемых для построения этого рисунка, мы получаем i = 48,8 пА / см и E = — 0,554 В, NHE. Применяя катодную плотность тока 72 … [Pg.280]
.
