| Номер НТД (ТР ТС, ГОСТ, ТУ, ОСТ) | Наименование | Буквенное обозначение защитных свойств | Пиктограмма | Расшифровка |
| ТР ТС 019/2011 | Технический регламент Таможенного союза «О безопасности средств индивидуальной защиты» 019/2011 | |||
| ТР ТС 017/2011 | Технический регламент Таможенного союза «О безопасности продукции легкой промышленности» 017/2011 | |||
| ГОСТ 12.4.280-2014 | ССБТ. Одежда специальная для защиты от общих производственных загрязнений и механических воздействий. Общие технические требования | Мп | Защита от проколов и порезов | |
| Ми | Защита от истирания | |||
| З | Защита от общих производственных загрязнений | |||
| Зо | Защита от общих производственных загрязнений (облегченная одежда) | |||
ГОСТ 12. 4.100-80 4.100-80 | Комбинезоны мужские для защиты от нетоксичной пыли, механических воздействий и общих производственных загрязнений. Технические условия | Пн | Защита от нетоксичной пыли | |
| Ми | Защита от истирания | |||
| З | Защита от общих производственных загрязнений | |||
| ГОСТ 12.4.099-80 | Комбинезоны женские для защиты от нетоксичной пыли, механических воздействий и общих производственных загрязнений. Технические условия | Пн | Защита от нетоксичной пыли | |
| Ми | Защита от истирания | |||
| З | Защита от общих производственных загрязнений | |||
| ГОСТ 12.4.131-83 | Халаты женские. Технические условия | Ми | Защита от истирания | |
| З | Защита от общих производственных загрязнений | |||
ГОСТ 12. 4.132-83 4.132-83 | Халаты мужские. Технические условия | Ми | Защита от истирания | |
| З | Защита от общих производственных загрязнений | |||
| ТУ 8572-002-70107142-2013 | Костюмы от вредных биологических факторов, механических воздействий и общих производственных загрязнений | Бн | Защита от насекомых | |
| Ми | Защита от истирания | |||
| З | Защита от общих производственных загрязнений | |||
| ГОСТ Р 12.4.236-2011 | ССБТ. Одежда специальная для защиты от пониженных температур. Технические требования | Тн | Защита от пониженных температур воздуха (1-4 класс защиты, для эксплуатации в I-II, III, IV и «Особом» климатических поясах) | |
| Тнв | Защита от пониженных температур воздуха и ветра (1-4 класс защиты, для эксплуатации в I-II, III, IV и «Особом» климатических поясах) | |||
ГОСТ 12.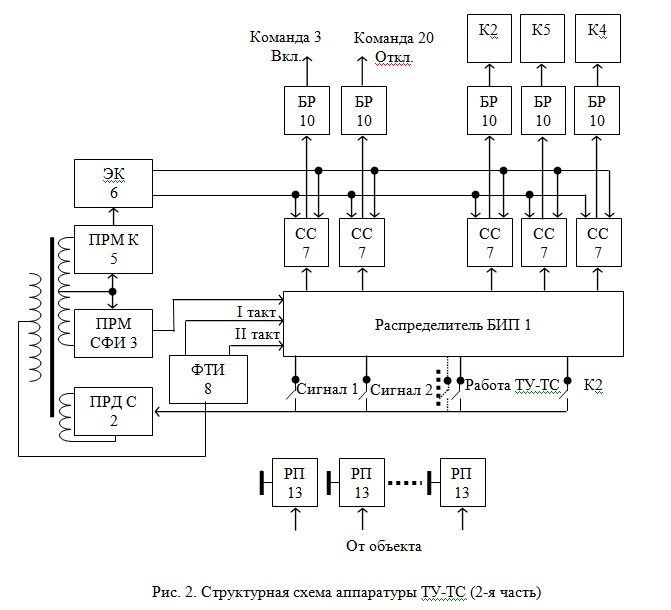 4.250-2013 4.250-2013 | ССБТ. Одежда специальная для защиты от искр и брызг расплавленного металла. Технические требования | Тр | Для защиты от искр, брызг расплавленного металла (1-3 класс защиты) | |
| ГОСТ 12.4.045-87 | ССБТ. Костюмы мужские для защиты от повышенных температур. Технические условия | Ти | Защита от теплового излучения | |
| Тт | Защита от конвективной теплоты | |||
| Тп100 | Защита от контакта с нагретыми до 100ºС поверхностями | |||
| ГОСТ Р 12.4.297-2013 | ССБТ. Одежда специальная для защиты от повышенных температур теплового излучения, конвективной теплоты, выплесков расплавленного металла, контакта с нагретыми поверхностями, кратковременного воздействия пламени. Технические требования и методы испытаний | То | Защита от открытого пламени | |
| Ти | Защита от теплового излучения | |||
| Тт | Защита от конвективной теплоты | |||
| Тп | Защита от контакта с нагретыми поверхностями | |||
ГОСТ 12. 4.251-2013 4.251-2013 | ССБТ. Одежда специальная для защиты от растворов кислот. Технические требования | Кк | Защита от растворов кислот концентрацией свыше 80% (4 класс защиты) | |
| К80 | Защита от растворов кислот концентрацией до 80% (3 класс защиты) | |||
| К50 | Защита от растворов кислот концентрацией до 50% (2 класс защиты) | |||
| К20 | Защита от растворов кислот концентрацией до 20% (1 класс защиты) | |||
| ГОСТ Р 12.4.290-2013 | ССБТ. Одежда специальная для защиты работающих от воздействия нефти, нефтепродуктов. Технические требования | Нс | Защита от сырой нефти (3 класс защиты) | |
| Нм | Защита от нефтепродуктов тяжелых фракций, нефтяных масел (2 класс защиты) | |||
| Нл | Защита от нефтепродуктов легких фракций (1 класс защиты) | |||
ГОСТ 12..jpg) 4.281-2014 4.281-2014 | ССБТ. Одежда специальная повышенной видимости. Технические требования | Со | Одежда сигнальная повышенной видимости (1-3 класс защиты) | |
| ГОСТ Р 12.4.288-2013 | ССБТ. Одежда специальная для защиты от воды. Технические требования | Во | Одежда водоотталкивающая (1 класс защиты) | |
| Ву | Одежда водоупорная (2 класс защиты) | |||
| Вн | Одежда водонепроницаемая (3 класс защиты) | |||
| ГОСТ 12.4.134-83 | Плащи мужские для защиты от воды. Технические условия | Ву | Одежда водоупорная | |
| Вн | Одежда водонепроницаемая | |||
| ГОСТ 27643-88 | Костюмы мужские для защиты от воды. Технические условия | Ву | Одежда водоупорная | |
| Вн | Одежда водонепроницаемая | |||
ГОСТ Р 12. 4.234-2007 4.234-2007 | ССБТ. Одежда специальная для защиты от термических рисков электрической дуги. Общие технические требования и методы испытаний | |||
| ГОСТ Р ИСО 11612-2007 | ССБТ. Одежда для защиты от тепла и пламени. Методы испытаний и эксплуатационные характеристики теплозащитной одежды | |||
| ГОСТ 12.4.029-76 | Фартуки специальные. Технические условия | К20, К50, К80 | Защита от растворов кислот концентрацией до 20%, до 50%, до 80% | |
| Щ20, Щ50 | Защита от растворов щелочей концентрацией до 20%, до 50% | |||
| Тр | Защита от искр, брызг расплавленного металла | |||
| Вн | Водонепроницаемые | |||
| Ву | Водоупорные | |||
| Нж | Защита от растительных и животных масел и жиров | |||
| Ми | Защита от истирания | |||
| З | Защита от общих производственных загрязнений | |||
| ГОСТ 25295-2003 | Одежда верхняя пальтово- костюмного ассортимента.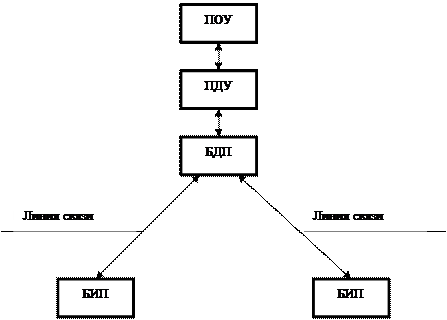 Общие технические условия Общие технические условия | |||
| ГОСТ 30327-2013 | Сорочки верхние. Общие технические условия | |||
| ГОСТ 31408-2009 | Изделия трикотажные бельевые для мужчин и мальчиков. Общие технические условия | |||
| ГОСТ 314010-2009 | Изделия трикотажные верхние для мужчин и мальчиков. Общие технические условия | |||
| ГОСТ 31405-2009 | Изделия трикотажные бельевые для женщин и девочек. Общие технические условия | |||
| ГОСТ 31409-2009 | Изделия трикотажные верхние для женщин и девочек. Общие технические условия | |||
| ГОСТ 33378-2015 | Головные уборы трикотажные. Общие технические условия | |||
| ГОСТ 32118-2013 | Головные уборы. Общие технические условия | |||
| ГОСТ 8541-2014 | Изделия чулочно-носочные, вырабатываемые на круглочулочных автоматах.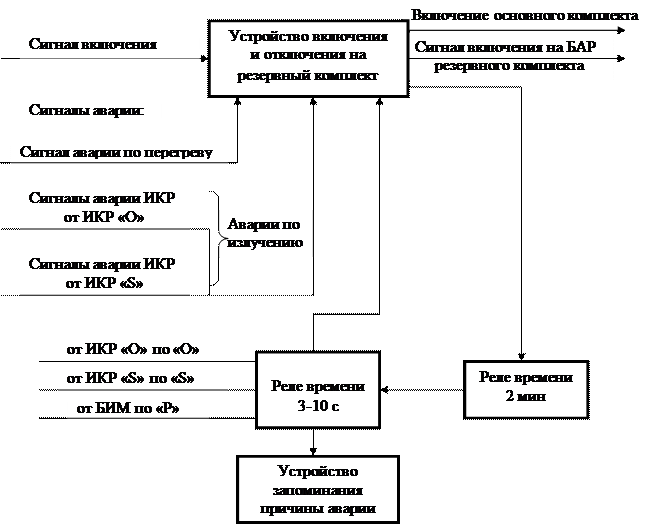 Общие технические условия Общие технические условия | |||
Средства индивидуальной защиты рук | ||||
| ГОСТ 12.4.252-2013 ГОСТ Р 12.4.246-2008 | ССБТ. Средства индивидуальной защиты рук. Перчатки. Общие технические требования. Методы испытаний | К20, К50, К80 | Защита от растворов кислот концентрацией до 20%, до 50%, до 80% | |
| Щ20, Щ50 | Защита от растворов щелочей концентрацией до 20%, до 50% | |||
| Нс Нм | Защита от нефти и нефтепродуктов | |||
| Тп100, Тп250 | Защита от контакта с нагретыми до 100ºС и 250ºС поверхностями | |||
| Тр | Защита от искр, брызг расплавленного металла | |||
| То | Защита от открытого пламени | |||
| Тн | Защита от пониженных температур | |||
| Мп | Защита от проколов и порезов | |||
| Ми | Защита от истирания | |||
| ГОСТ 20010-93 | Перчатки резиновые технические. Технические условия Технические условия | К20, К50, К80 | Защита от растворов кислот концентрацией до 20%, до 50%, до 80% | |
| Щ20, Щ50 | Защита от растворов щелочей концентрацией до 20%, до 50% | |||
| ГОСТ 12.4.002-97 | ССБТ. Средства защиты рук от вибрации. Технические требования и методы испытаний | Мв | Защита от вибраций | |
| ГОСТ 12.4.010-75 | ССБТ. Средства индивидуальной защиты. Рукавицы специальные. Технические условия | К20, К50, К80 | Защита от растворов кислот концентрацией до 20%, до 50%, до 80% | |
| Щ20, Щ50 | Защита от растворов щелочей концентрацией до 20%, до 50% | |||
| Тр | Защита от искр, брызг расплавленного металла | |||
| Тп100 | Защита от контакта с нагретыми до 100ºС поверхностями | |||
| Тн | Защита от пониженных температур | |||
| Мп | Защита от проколов и порезов | |||
| Ми | Защита от истирания | |||
| ОСТ 17-528-75 | Кожгалантерейные изделия. Рукавицы рабочие. Общие технические условия Рукавицы рабочие. Общие технические условия | Тп100 | Защита от контакта с нагретыми до 100ºС поверхностями | |
| Тр | Защита от искр, брызг расплавленного металла | |||
| Ми | Защита от истирания | |||
| ГОСТ 5007-87 | Изделия трикотажные перчаточные. Общие технические условия | |||
| ГОСТ Р 52238-2004 | Перчатки хирургические из каучукового латекса стерильные одноразовые. Спецификация | |||
Средства индивидуальной защиты ног | ||||
| ГОСТ 12.4.137-2001 | Обувь специальная с верхом из кожи для защиты от нефти, нефтепродуктов, кислот, щелочей, нетоксичной и взрывоопасной пыли. Технические условия | Нс Нм | Защита от нефти и нефтепродуктов | |
| К20 | Защита от растворов кислот концентрацией до 20% | |||
| Щ20 | Защита от растворов щелочей концентрацией до 20% | |||
| ГОСТ 28507-99 | Обувь специальная с верхом из кожи для защиты от механических воздействий. Технические условия Технические условия | Мун 200, Мун 100, Мун 50, Мун 25, | Защита от ударов в носочной части энергией 200 (100, 50, 25) Дж | |
| Мп | От проколов энергией 1200Н | |||
| ГОСТ Р 12.4.187-97 | ССБТ. Обувь специальная кожаная для защиты от общих производственных загрязнений. Общие технические условия | З | Защита от общих производственных загрязнений | |
| ГОСТ 12.4.032-95 | Обувь специальная с кожаным верхом для защиты от действия повышенных температур. Технические условия | Ти | Защита от теплового излучения | |
| Тр | Защита от искр, брызг расплавленного металла | |||
| Тп 150, Тп 300 | Защита от контакта с нагретыми до 150ºС (300ºС) поверхностями | |||
| ГОСТ 12.4.033-77 | Обувь специальная кожаная для защиты от скольжения по зажиренным поверхностям. Технические условия Технические условия | Сж | Защита от скольжения по зажиренным поверхностям | |
| ГОСТ 12.4.072-79 | СССБТ. Сапоги специальные резиновые формовые, защищающие от воды, нефтяных масел и механических воздействий. Технические условия | |||
| ГОСТ 26167-2005 | Обувь повседневная. Общие технические условия | |||
| ГОСТ 1135-2005 | Обувь домашняя и дорожная. Общие технические условия | |||
| ГОСТ 18724-88 | Обувь валяная грубошерстная. Технические условия | |||
| ГОСТ 5394-89 | Обувь из юфти. Общие технические условия | |||
| Наименование | Марки | Сертификаты соответствия |
Провода неизолированные | ||
| Провода неизолированные для воздушных линий электропередачи на напряжение свыше 1 кВ Серийный выпуск по ГОСТ 839-80 | А, АС | |
| Провода неизолированные для воздушных линий электропередачи марки М на напряжение свыше 1 кВ по ГОСТ 839-80 | М | |
| Провода неизолированные для воздушных линий электропередачи на номинальное напряжение свыше 1 кВ ГОСТ 839-2019 | А, АС, M | |
Провода марки «СЕНИЛЕК» неизолированные для воздушных линий электропередачи с рабочей температурой до 210°С. Серийный выпуск ТУ 3511-005-41183126-2013 Серийный выпуск ТУ 3511-005-41183126-2013 | АТ1/С, АТ1П/С, АТ3/С, АТ3П/С | |
| Провода неизолированные термостойкие для воздушных линий электропередачи на напряжение свыше 1 кВ. Серийный выпуск ТУ 3511-002-41183126-2013 * | АССR | Сертификат Соответствия (по 15.10.2023 г.) |
Провода самонесущие изолированные | ||
| Провода самонесущие изолированные для воздушных линий электропередачи на напряжение до 0,6/1 кВ включительно. Серийный выпуск по ТУ 3500-05-46600751-2006. базовый НД: ГОСТ 31946-2012 | СИП-1, СИП-2, СИП-4 | |
Провода защищенные для воздушных линий электропередачи на номинальные напряжения 20 кВ, 35 кВ. Серийный выпуск по ТУ 3500-005-46600751-2006.базовый НД: ГОСТ 31946-2012 Серийный выпуск по ТУ 3500-005-46600751-2006.базовый НД: ГОСТ 31946-2012 | СИП-3 | |
| Провода самонесущие изолированные информационно-силовые для воздушных линий электропередачи на напряжение до 0,6/1 кВ включительно. Серийный выпуск по ТУ 3500-007-41183126-2015. | ТЕЛСИЛ СИП-2ок, ТЕЛСИЛ СИП-4ок | |
Кабели силовые | ||
| Кабели силовые с изоляцией и оболочкой или защитным шлангом из поливинилхлоридного пластиката на напряжения 0,66 и 1 кВ. Серийный выпуск по ТУ 16-705.499-2010 базовые НД: ГОСТ 31996-2012, ГОСТ 31565-2012 | АВВГ, ВВГ, АВБШв, ВБШв | Сертификат ТС (по 19.08.2025 г.) |
Кабели силовые с изоляцией из силанольносшитого полиэтилена, бронированные, с защитным шлангом из полиэтилена на напряжение 1 кВ. Серийное производство ТУ 16.К71-277-98 базовый НД: ГОСТ 31996-2012 Серийное производство ТУ 16.К71-277-98 базовый НД: ГОСТ 31996-2012 | АПвБШп(г), ПвБШп(г) | Сертификат ТС (по 20.08.2024 г.) |
| Кабели силовые с изоляцией из поливинилхлоридного пластиката, в оболочке или защитном шланге из поливинилхлоридного пластиката пониженной горючести на напряжения 0,66 и 1 кВ. Серийный выпуск по ТУ 16-705.499-2010 базовые НД: ГОСТ 31996-2012, ГОСТ 31565-2012 | АВВГнг(А), ВВГнг(А), АВБШвнг(А), ВБШвнг(А) | Сертификат ТС (по 10.08.2025 г.) |
| Кабели силовые, не распространяющие горение, с изоляцией из холодостойкого ПВХ пластиката, с оболочкой или защитным шлангом из холодостойкого поливинилхлоридного пластиката пониженной горючести на номинальное напряжения 0,66 кВ и 1 кВ. Серийный выпуск ТУ 3500-008-46600751-2012 базовые НД: ГОСТ 31996-2012, ГОСТ 31565-2012 | АВВГнг(А)-ХЛ, ВВГнг(А)-ХЛ, АВБШвнг(А)-ХЛ, ВБШвнг(А)-ХЛ | |
Кабели силовые, не распространяющие горение с низким дымо- и газовыделением, с изоляцией и оболочкой или защитным шлангом из поливинилхлоридного пластиката пониженной пожарной опасности на напряжения 0,66 и 1 кВ. Серийный выпуск ТУ16.К71-310-2001 базовые НД: ГОСТ 31996-2012, ГОСТ 31565-2012 Серийный выпуск ТУ16.К71-310-2001 базовые НД: ГОСТ 31996-2012, ГОСТ 31565-2012 | АВВГнг(А)-LS, ВВГнг(А)-LS, ВВГЭнг(А)-LS, АВБШвнг(А)-LS, ВБШвнг(А)-LS, ВБШвнг(А)-FRLS | |
| Кабели силовые огнестойкие, не распространяющие горение, с низким дымо- и газовыделением, с числом медных жил от 1 до 5, сечением жил от 1,5 до 400 мм2, с изоляцией и в оболочке из поливинилхлоридного пластиката пониженной пожарной опасности на ном. напряжение 1 кВ. Серийный выпуск по ТУ 16. К71-337-2004 базовые НД: ГОСТ 31996-2012, ГОСТ 31565-2012 | ВВГнг(А)-FRLS, ВВГЭнг(А)-FRLS | |
Кабели силовые, не распространяющие горение, с изоляцией и оболочкой или защитным шлангом из полимерных композиций, не содержащих галогенов, на напряжение 0,66 и 1 кВ. Серийный выпуск по ТУ 16. К71-304-2001 базовые НД: ГОСТ 31996-2012, ГОСТ 31565-2012 Серийный выпуск по ТУ 16. К71-304-2001 базовые НД: ГОСТ 31996-2012, ГОСТ 31565-2012 | ППГнг(А)-HF, ППГЭнг(А)-HF, ПБПнг(А)-HF | |
| Кабели силовые огнестойкие, не распространяющие горение, с изоляцией и оболочкой из полимерных композиций, не содержащих галогенов, на напряжение 0,66 и 1 кВ. Серийный выпуск по ТУ 16. К71-339-2004базовые НД: ГОСТ 31996-2012, ГОСТ 31565-2012 | ППГнг(А)-FRHF | |
| Кабели силовые, бронированные, не распространяющие горение, с низким дымо- и газовыделением, с изоляцией и защитным шлангом из поливинилхлоридного пластиката пониженной пожарной опасности на напряжение 1 кВ. Серийный выпуск по ТУ 16. К71-090-2002 базовые НД: ГОСТ 31996-2012, ГОСТ 31565-2012 | АВБВнг(А)-LS, ВБВнг(А)-LS | |
Кабели контрольные | ||
Кабели контрольные с изоляцией и оболочкой или защитным шлангом из поливинилхлоридного пластиката. Серийный выпуск ГОСТ 1508-78 базовые НД: ГОСТ 1508-78, ГОСТ 31565-2012 Серийный выпуск ГОСТ 1508-78 базовые НД: ГОСТ 1508-78, ГОСТ 31565-2012 | АКВВГ, КВВГ, АКВВГЭ, КВВГЭ, АКВБбШв, КВБбШв | |
| Кабели контрольные, не распространяющие горение, с изоляцией из поливинилхлоридного пластиката, в оболочке или защитном шланге из поливинилхлоридного пластиката пониженной горючести. Серийный выпуск по ТУ 3563-007-46600751-2012 базовые НД: ГОСТ 1508-78, ГОСТ 31565-2012 | АКВВГнг(А), КВВГнг(А), АКВВГзнг(А), КВВГзнг(А), АКВВГЭнг (А), КВВГЭнг (А), АКВБбШвнг(А), КВБбШвнг(А) | Сертификат ТС (по 04.06.2024 г.) |
Кабели контрольные, не распространяющие горение, с изоляцией из холодостойкого ПВХ пластиката, с оболочкой или защитным шлангом из холодостойкого ПВХ пластиката пониженной горючести. Серийный выпуск ТУ 3500-008-46600751-2012 базовые НД: ГОСТ 1508-78, ГОСТ 31565-2012 Серийный выпуск ТУ 3500-008-46600751-2012 базовые НД: ГОСТ 1508-78, ГОСТ 31565-2012 | КВВГнг(А)-ХЛ, КВВГЭнг(А)-ХЛ, КВБШв нг(А)-ХЛ, АКВВГнг(А)-ХЛ, АКВВГЭнг(А)-ХЛ, АКВБШвнг(А)-ХЛ | |
| Кабели контрольные, не распространяющие горение, с низким дымо- и газовыделением, с изоляцией и оболочкой их поливинилхлоридного пластиката пониженной пожарной опасности. Серийный выпуск по ТУ 16. К71-310-2001 базовые НД: ГОСТ 1508-78, ГОСТ 31565-2012 | КВВГнг(А)-LS, КВВГЭнг(А)-LS | |
Кабели контрольные огнестойкие, не распространяющие горение, с низким дымо- и газовыделением, с числом медных жил от 4 до 61, сечением жил от 1,0 до 6,0 мм2, с изоляцией и в оболочке из поливинилхлоридного пластиката пониженной пожарной опасности на номинальное напряжение до 1 кВ включительно. Серийный выпуск по ТУ 16. К71-337-2004 Серийный выпуск по ТУ 16. К71-337-2004 | КВВГнг(А)-FRLS, КВВГЭнг(А)-FRLS | |
| Кабели контрольные, бронированные, не распространяющие горение, с низким дымо- и газовыделением, с медными жилами, с изоляцией и защитным шлангом из поливинилхлоридного пластиката пониженной пожарной опасности на номинальное переменное напряжение до 0,66 кВ или постоянное напряжение 1 кВ включительно. Серийный выпуск по ТУ 16. К71-090-2002 | КВБВнг(А)-LS | |
Провода изолированные | ||
| Провода для электрических установок, с медными жилами, с изоляцией из поливинилхлоридного пластиката на напряжение до 450/750В включительно. Серийный выпуск по ТУ 16-705.501-2010, базовые НД: ГОСТ 31996-2012, ГОСТ 31565-2012 | ПуВ, ПуВВ | |
Огнестойкие кабельные линии | ||
Огнестойкие кабельные линии для систем противопожарной защиты типа «Людиновокабель-ДКС» в составе согласно приложению № 1 на 2 листах (бланки № 003308-003309), выпускаемые по ТУ 27. 33.13-008-41183126-2018. Серийный выпуск. 33.13-008-41183126-2018. Серийный выпуск. | КВВГнг(А)-FRLS, КВВГЭнг(А)-FRLS, ВВГнг(А)-FRLS, ВВГЭнг(А)-FRLS, ППГнг(А)-FRHF, ППГЭнг(А)-FRHF, ПБПнг(А)-FRHF | |
Аппаратно-программный комплекс обмена данными ТУ-ТС ЦРСС
Please use this identifier to cite or link to this item:
http://earchive.tpu.ru/handle/11683/53832
| Title: | Аппаратно-программный комплекс обмена данными ТУ-ТС ЦРСС |
| Authors: | Устьянцева, Людмила Сергеевна |
| metadata.dc.contributor.advisor: | Цыганков, Юрий Владимирович |
| Keywords: | радиорелейная линия связи; ПЛИС — Программируемая Логическая Интегральная Схема; телеуправление и телесигнализация; телекоммуникационное оборудование; цифровая радиорелейная станция; radio-relay line; FPGA — Field-Programmable Gate Array; telecommand and teleindication; telecommunication equipment; digital radio-relay station |
| Issue Date: | 2019 |
| Citation: | Устьянцева Л. С. Аппаратно-программный комплекс обмена данными ТУ-ТС ЦРСС : бакалаврская работа / Л. С. Устьянцева ; Национальный исследовательский Томский политехнический университет (ТПУ), Инженерная школа информационных технологий и робототехники (ИШИТР), Отделение информационных технологий (ОИТ) ; науч. рук. Ю. В. Цыганков. — Томск, 2019. С. Аппаратно-программный комплекс обмена данными ТУ-ТС ЦРСС : бакалаврская работа / Л. С. Устьянцева ; Национальный исследовательский Томский политехнический университет (ТПУ), Инженерная школа информационных технологий и робототехники (ИШИТР), Отделение информационных технологий (ОИТ) ; науч. рук. Ю. В. Цыганков. — Томск, 2019. |
| Abstract: | Комплекс обеспечивает передачу данных Телеуправления и Телесигнализации между МК блока управления и ПЛИС блока мультиплексирования посредством интерфейса SPI в направлениях: Радиоканал, Транзит 1, Транзит 2. Реализация выполнена на языке описания аппаратуры SystemVerilog. The complex provides data transmission of Telecommand and Teleindication between MC of control box and FPGA of multiplexing block by means of the SPI in the directions: Radio channel, Transit 1, Tranzit 2. Implementation is executed in hardware description language SystemVerilog. |
| URI: | http://earchive.tpu.ru/handle/11683/53832 |
| Appears in Collections: | Выпускные квалификационные работы (ВКР) |
Files in This Item:
There are no files associated with this item.
Items in DSpace are protected by copyright, with all rights reserved, unless otherwise indicated.
Чувствительность
к кирромицину и активность в Q-бета-репликазе.
J Бактериол. 1980 июль; 143(1): 389–395.
Эта статья была процитирована другими статьями в PMC.
Abstract
Факторы элонгации синтеза белка Tu и Ts ответственны за связывание рибонуклеиновой кислоты (РНК) с переносом аминоацила с рибосомой. Кроме того, они выполняют неопределенную функцию, как и комплекс EF-Tu.Ts, в РНК-репликазах фагов. Пытаясь получить представление об этих двух явно не связанных ролях, мы выделили факторы элонгации из Caulobacter crescentus и сравнили их с аналогичными полипептидами Escherichia coli.Хотя большинство физических и функциональных характеристик оказались сходными, были обнаружены значительные различия в молекулярной массе EF-T и относительном сродстве гуаниновых нуклеотидов, чувствительности к расщеплению трипсином и скорости тепловой денатурации EF-Tu. Антибиотик кирромицин был активен с EF-Tu обоих видов бактерий. Когда C. crescentus EF-Tu.Ts заменяли факторы элонгации E. coli в РНК-репликазе фага Q beta, образовывался фермент, способный к очевидно нормальной активности синтеза РНК.
Антибиотик кирромицин был активен с EF-Tu обоих видов бактерий. Когда C. crescentus EF-Tu.Ts заменяли факторы элонгации E. coli в РНК-репликазе фага Q beta, образовывался фермент, способный к очевидно нормальной активности синтеза РНК.
Полный текст
Полный текст доступен в виде отсканированной копии оригинальной печатной версии. Получите копию для печати (файл PDF) полной статьи (1.1M) или щелкните изображение страницы ниже, чтобы просмотреть страницу за страницей. Ссылки на PubMed также доступны для Selected References .
Изображения в этой статье
Нажмите на изображение, чтобы увеличить его.
Избранные ссылки
Эти ссылки находятся в PubMed. Возможно, это не полный список литературы из этой статьи.
- Араи К.И., Кавакита М., Казиро Ю. Исследования факторов удлинения полипептидов из Escherichia coli. II. Очистка факторов Tu-гуанозиндифосфата, Ts и Tu-Ts и кристаллизация Tu-гуанозиндифосфата и Tu-Ts.
 Дж. Биол. Хим. 1972 г., 10 ноября; 247 (21): 7029–7037. [PubMed] [Google Scholar]
Дж. Биол. Хим. 1972 г., 10 ноября; 247 (21): 7029–7037. [PubMed] [Google Scholar] - Бек Б.Д. Полимеризация бактериального фактора элонгации для синтеза белка, EF-Tu. Евр Дж Биохим. 1979 г., июль; 97 (2): 495–502. [PubMed] [Google Scholar]
- Блюменталь Т.Репликаза Qbeta РНК и факторы элонгации синтеза белка EF-Tu и EF-Ts. Методы Энзимол. 1979; 60: 628–638. [PubMed] [Google Scholar]
- Блюменталь Т., Ландерс Т.А. Ренатурация мультисубъединичного мультиактивного ферментного комплекса: восстановление активности РНК-реплиазы фага Qbeta, EF-Tu и EF-Ts после денатурации в мочевине. Биохимия. 1976 г., 27 января; 15 (2): 422–425. [PubMed] [Google Scholar]
- Блюменталь Т., Ландерс Т.А., Вебер К. Репликаза бактериофага Q содержит факторы удлинения биосинтеза белка EF Tu и EF Ts.Proc Natl Acad Sci U S A. 1972 May; 69 (5): 1313–1317. [Статья бесплатно PMC] [PubMed] [Google Scholar]
- Браун С., Блюменталь Т. Восстановление репликазы РНК Qbeta из ковалентно связанного комплекса фактора элонгации Tu-Ts.
 Proc Natl Acad Sci U S A. 1976 Apr; 73(4):1131–1135. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci U S A. 1976 Apr; 73(4):1131–1135. [Статья бесплатно PMC] [PubMed] [Google Scholar] - Браун С., Блюменталь Т. Функция и структура репликазы рибонуклеиновой кислоты фага рибонуклеиновой кислоты Qbeta. Влияние ингибиторов EF-Tu на синтез рибонуклеиновой кислоты и ренатурацию активного фермента.Дж. Биол. Хим. 1976 г., 10 мая; 251 (9): 2749–2753. [PubMed] [Google Scholar]
- Chinali G, Wolf H, Parmeggiani A. Влияние кирромицина на фактор удлинения Tu. Расположение каталитического центра активности ГТФазы рибосомы-фактора элонгации Tu на факторе элонгации. Евр Дж Биохим. 1977 г., 2 мая; 75 (1): 55–65. [PubMed] [Google Scholar]
- Дуглас Дж., Блюменталь Т. Конформационный переход фактора удлинения синтеза белка Tu, индуцированный гуаниновыми нуклеотидами. Модуляция кирромицином и фактором элонгации Ts.Дж. Биол. Хим. 1979 г., 25 июня; 254 (12): 5383–5387. [PubMed] [Google Scholar]
- Filer D, Furano AV. Части гена, кодирующего фактор элонгации Tu, высококонсервативны у прокариот.
 Дж. Биол. Хим. 1980 г., 25 января; 255 (2): 728–734. [PubMed] [Google Scholar]
Дж. Биол. Хим. 1980 г., 25 января; 255 (2): 728–734. [PubMed] [Google Scholar] - Furano AV. Содержание фактора элонгации Tu в Escherichia coli. Proc Natl Acad Sci U S A. 1975 Dec; 72 (12): 4780–4784. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Furano AV. Субклеточное распределение и состояние фактора элонгации Tu в экстрактах Escherichia coli B.Евр Дж Биохим. 1976 г., 1 мая; 64 (2): 597–606. [PubMed] [Google Scholar]
- Jacobson GR, Rosenbusch JP. Численность и мембранная ассоциация фактора элонгации Tu в E. coli. Природа. 1976 г., 6 мая; 261 (5555): 23–26. [PubMed] [Google Scholar]
- Казиро Ю. Роль гуанозин-5′-трифосфата в удлинении полипептидной цепи. Биохим Биофиз Акта. 1978 г., 21 сентября; 505 (1): 95–127. [PubMed] [Google Scholar]
- Laemmli UK. Расщепление структурных белков при сборке головки бактериофага Т4.Природа. 1970 г., 15 августа; 227 (5259): 680–685. [PubMed] [Google Scholar]
- Нисен П., Медфорд Р., Мансур Дж., Пурукер М.
 , Скалка А., Шапиро Л. Реаранжировка последовательностей инвертированных повторов ДНК, связанная с клеточным циклом. Proc Natl Acad Sci U S A. 1979 Dec; 76 (12): 6240–6244. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Скалка А., Шапиро Л. Реаранжировка последовательностей инвертированных повторов ДНК, связанная с клеточным циклом. Proc Natl Acad Sci U S A. 1979 Dec; 76 (12): 6240–6244. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Travers A. Специфичность РНК-полимеразы и контроль роста. Природа. 1976 г., 21 октября; 263 (5579): 641–646. [PubMed] [Google Scholar]
- Вебер К., Осборн М. Надежность определения молекулярной массы с помощью электрофореза в додецилсульфат-полиакриламидном геле.Дж. Биол. Хим. 1969 г., 25 августа; 244 (16): 4406–4412. [PubMed] [Google Scholar]
- Weissbach H, Miller DL, Hachmann J. Исследования роли фактора Ts в синтезе полипептидов. Арх Биохим Биофиз. 1970 март; 137 (1): 262–269. [PubMed] [Google Scholar]
- Wittinghofer A, Leberman R. Фактор элонгации T из Bacillus stearothermophilus и Escherichia coli. Очистка и некоторые свойства ЭФ-Ту и ЭФ-Т из Bacillus stearothermophilus. Евр Дж Биохим. 1976 г., 16 февраля; 62 (2): 373–382. [PubMed] [Google Scholar]
- Wolf H, Chinali G, Parmeggiani A.
 Кирромицин, ингибитор биосинтеза белка, который действует на фактор элонгации Tu. Proc Natl Acad Sci U S A. 1974 Dec; 71 (12): 4910–4914. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кирромицин, ингибитор биосинтеза белка, который действует на фактор элонгации Tu. Proc Natl Acad Sci U S A. 1974 Dec; 71 (12): 4910–4914. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Wolf H, Chinali G, Parmeggiani A. Механизм ингибирования синтеза белка кирромицином. Роль фактора элонгации Tu и рибосом. Евр Дж Биохим. 1977 г., 2 мая; 75 (1): 67–75. [PubMed] [Google Scholar]
- Wurtz M, Jacobson RJ, Steven AC, Rosenbusch JP. Паракристаллические массивы фактора удлинения синтеза белка Tu.Сравнение с полимеризованным актином. Евр Дж Биохим. 1978 г., 1 августа; 88 (2): 593–597. [PubMed] [Google Scholar]
Статьи из Journal of Bacteriology предоставлены здесь с разрешения Американского общества микробиологии (ASM)
Прослушивания | ТУТС
ЮЖНО-ТИХООКЕАНСКИЙ
ЮЖНО-ТИХООКЕАНСКИЙ даты: 20 января — 20 февраля
Дата прослушивания: воскресенье, 12 декабря 2021 г.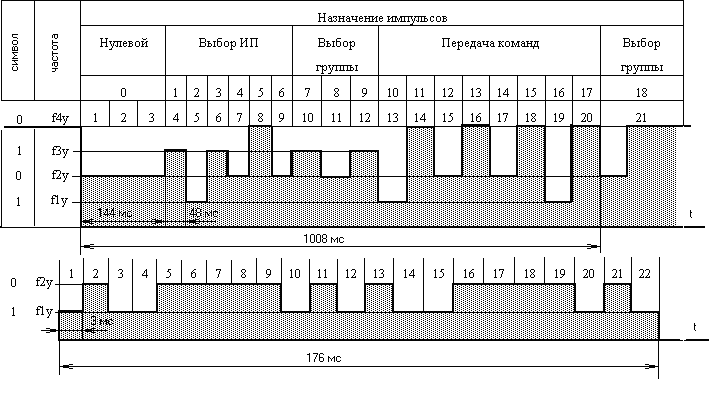 , 12:30 ЛИЧНО в репетиционном зале HSMT (материалы для прослушивания будут предоставлены)
, 12:30 ЛИЧНО в репетиционном зале HSMT (материалы для прослушивания будут предоставлены)
В поисках : Двое детей из AAPI, которые будут играть Нгана (6-9 лет) и Джером (5-8 лет), дети Эмиля ДеБека, французского владельца плантации.Дети будут петь и исполнять короткую песенку на французском языке (Dites moi).
SOUTH PACIFIC рассказывает о жизни американских военных, медсестер и жителей полинезийского острова во время Второй мировой войны, по мотивам романа Джеймса Миченера «Рассказы о южной части Тихого океана» и с использованием музыки Роджерса и Хаммерштейна.
ПЕРСОНАЛ
Художественный руководитель-постановщик: Дэн Кнехтгес
Ассоциированный художественный руководитель: Моник Миджетт
Директор: Тайби Магар
Хореограф: Кортни Джонс
Музыкальный руководитель: Стивен В.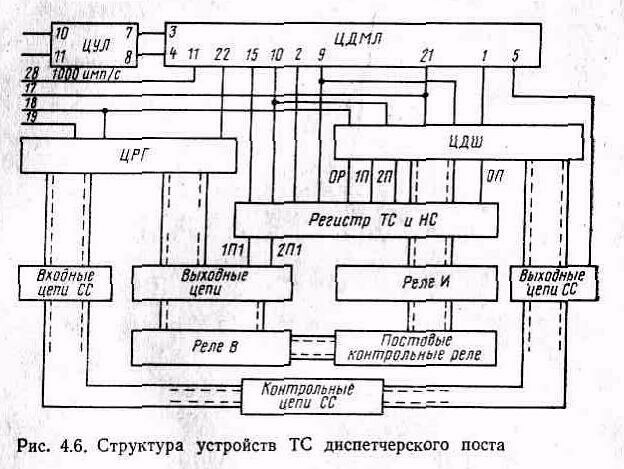 Джонс
Джонс
Даты южной части Тихого океана :
Начало репетиций 20 января 2022 г.
Открытие 8 февраля 2022 г.
Закрывается 20 февраля 2022 г.
Должен быть доступен: с 25 января по 20 февраля 2022 года, включая ВСЕ ВЫСТУПЛЕНИЯ (более конкретные даты и время будут сообщены на прослушивании) Должен быть расположен в районе Хьюстона . Был бы заинтересован в найме братьев и сестер, если это возможно, но открыт для всех заинтересованных.
Чтобы получить время для прослушивания, отправьте электронное письмо Моник[email protected] с номером
с фотографией вашего ребенка, его возрастом и ростом. В теме письма укажите «Южно-тихоокеанское прослушивание».
ПРИМЕЧАНИЕ . В соответствии с рекомендациями The Hobby Center все актеры и съемочная группа, а также музыканты должны быть вакцинированы, чтобы принимать участие в основных постановках.
TUTS стремится быть лидером в поддержке обширного сообщества местных художников из Хьюстона и его окрестностей. Для достижения разнообразных и высококлассных постановок TUTS приглашает и поощряет заинтересованных исполнителей из всех слоев общества на прослушивание.
Всем исполнителям должно быть 18 лет к первому дню репетиций. Исполнители в возрасте до 18 лет отбираются из Школы музыкального театра Хамфриса и Школы исполнительского и изобразительного искусства Ривер.
Посетите нашу страницу часто задаваемых вопросов по литью , если у вас возникнут вопросы о процессе литья.
По вопросам о кастинге TUTS пишите нам по адресу [email protected] .
| Чтобы получать информацию о прослушиваниях, отправьте ниже свой адрес электронной почты. |
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie. - Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
EF-T — обзор | ScienceDirect Topics
1.3 Митохондриальная трансляция
Митохондриальная трансляция состоит из трех этапов: инициации, элонгации и терминации. Инициация трансляции начинается с IF3 мт (митохондриальный фактор инициации трансляции 3), эффективно координируя образование прединициационного комплекса (включая IF2 мт и fmet-тРНК) и помещая кодоны инициации AUG или AUA (мРНК) в пептидил -сайт связывания тРНК (P-сайт) внутри малой субъединицы (SSU) миторибосомы (Rudler et al., 2019). Этот шаг важен для предотвращения преждевременной ассоциации между SSU и LSU (большая субъединица) в отсутствие мРНК или инициаторной тРНК (Koripella et al.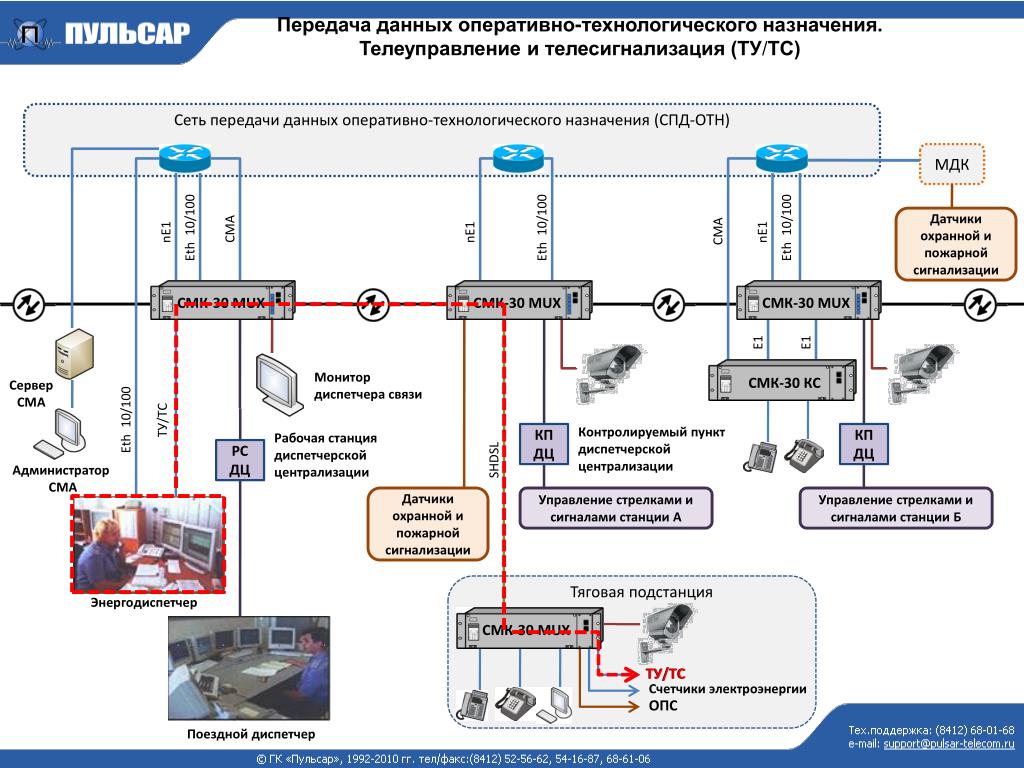 , 2019). На следующем этапе IF2 mt способствует связыванию fMet-тРНК, что способствует сборке с LSU (а IF3 mt замещается) (Bhargava and Spremulli, 2005; Rudler et al., 2019), создавая основу для следующего шага, удлинение.
, 2019). На следующем этапе IF2 mt способствует связыванию fMet-тРНК, что способствует сборке с LSU (а IF3 mt замещается) (Bhargava and Spremulli, 2005; Rudler et al., 2019), создавая основу для следующего шага, удлинение.
Стадия удлинения (рис. 1Б) зависит от трех факторов: EF-Tu (TUFM), EF-Ts (TSFM) и EF-GM (GFM1).EF-Tu образует комплекс с GTP и заряженной тРНК и входит в сайт связывания аминоацил-тРНК (А-сайт). Далее гидролиз GTP катализирует образование пептидных связей в пептидилтрансферазном центре (сайт катализа), расположенном в LSU (Mai et al., 2017). Затем комплекс GDP:EF-Tu высвобождается и восстанавливается за счет взаимодействия с фактором обмена нуклеотидов EF-Ts (Cai et al., 2000).
После гидролиза GTP α-аминогруппа аминоацил-тРНК в А-сайте реагирует с карбонильным углеродом пептидил-тРНК в Р-сайте с образованием пептидил-тРНК длиннее на одну аминокислоту в А-сайте , оставляя деацилированную тРНК в P-сайте (rev. Beringer and Rodnina, 2007). Фактор EF-G1 действует на миторибосому, изменяя ее конформацию и таким образом перемещая пептидил-тРНК из А-сайта (теперь пустого) в Р-сайт (транслокация). Это структурное изменение в миторибосоме позволяет новому кодону войти в A-сайт для взаимодействия со следующей аминоацил-тРНК (rev. Mai et al., 2017 и D’Souza and Minczuk, 2018). Существует также Е-сайт, где стыкуются деацилированные тРНК перед выходом из миторибосомы (Kaushal et al., 2015). Затем элонгация продолжается до тех пор, пока стоп-кодон не будет помещен в А-сайт.
Фактор EF-G1 действует на миторибосому, изменяя ее конформацию и таким образом перемещая пептидил-тРНК из А-сайта (теперь пустого) в Р-сайт (транслокация). Это структурное изменение в миторибосоме позволяет новому кодону войти в A-сайт для взаимодействия со следующей аминоацил-тРНК (rev. Mai et al., 2017 и D’Souza and Minczuk, 2018). Существует также Е-сайт, где стыкуются деацилированные тРНК перед выходом из миторибосомы (Kaushal et al., 2015). Затем элонгация продолжается до тех пор, пока стоп-кодон не будет помещен в А-сайт.
Стадия терминации начинается, когда стоп-кодон входит в А-сайт. Стоп-кодоны (UAA, UAG) распознаются RF1A mt (митохондриальный фактор высвобождения 1A), который отвечает за гидролиз сложноэфирной связи между пептидил-тРНК и конечной аминокислотой посредством мотива GGQ (рассмотрено в Mai et al., 2017; D’Souza and Minczuk, 2018, и ссылки в нем). Интересно, что мРНК для MT-CO1 и MT-ND6 содержат AGA и AGG в качестве последних кодонов. Точное картирование терминирующих кодонов показало, что эти две мРНК оканчиваются в UAG (вероятно) за счет сдвига рамки считывания на - 1 миторибосомы (Temperley et al. , 2010а,б). ICT1 является другим членом семейства митохондриальных факторов высвобождения трансляции и индуцирует гидролиз пептидил-тРНК в остановленных миторибосомах (Akabane et al., 2014; Feaga et al., 2016). Затем полипептид высвобождается из миторибосомы.
, 2010а,б). ICT1 является другим членом семейства митохондриальных факторов высвобождения трансляции и индуцирует гидролиз пептидил-тРНК в остановленных миторибосомах (Akabane et al., 2014; Feaga et al., 2016). Затем полипептид высвобождается из миторибосомы.
Два митохондриальных фактора рециркуляции рибосом (RRF и EFG2) способствуют диссоциации субъединиц миторибосом, а также высвобождению мРНК и деацилированных тРНК (Rorbach et al., 2008; Tsuboi et al., 2009). После этого цикл митохондриальной трансляции завершается и готов к повторному запуску.
Активация контактно-зависимых антибактериальных тРНКазных токсинов факторами элонгации трансляции
Значение
Системы контактно-зависимого ингибирования роста (CDI) позволяют клеткам связывать конкурирующие бактерии и доставлять токсины, которые расщепляют нуклеиновые кислоты или образуют мембранные поры. Здесь мы характеризуем токсин CDI, который специфически расщепляет транспортную РНК (тРНК), тем самым блокируя синтез белка и ингибируя рост бактерий. Примечательно, что два высококонсервативных и важных фактора трансляции, EF-Ts и EF-Tu, имеют решающее значение для этой токсической нуклеазной активности.Токсин связывает EF-Tu с высокой аффинностью и расщепляет тРНК только в комплексе с фактором трансляции. EF-T, по-видимому, увеличивает скорость оборота тРНК. Активность двух других различных токсинов CDI также регулируется EF-T. Мы предполагаем, что регуляция активности токсина аппаратом синтеза белка может играть роль в межклеточной коммуникации.
Примечательно, что два высококонсервативных и важных фактора трансляции, EF-Ts и EF-Tu, имеют решающее значение для этой токсической нуклеазной активности.Токсин связывает EF-Tu с высокой аффинностью и расщепляет тРНК только в комплексе с фактором трансляции. EF-T, по-видимому, увеличивает скорость оборота тРНК. Активность двух других различных токсинов CDI также регулируется EF-T. Мы предполагаем, что регуляция активности токсина аппаратом синтеза белка может играть роль в межклеточной коммуникации.
Abstract
Контактно-зависимое ингибирование роста (CDI) представляет собой механизм, с помощью которого бактерии обмениваются токсинами посредством прямого межклеточного контакта.Системы CDI широко распространены среди грамотрицательных патогенов и, как считается, опосредуют межштаммовую конкуренцию. Здесь мы описываем мутации tsf , которые изменяют спиральный домен фактора элонгации Ts (EF-Ts) и придают устойчивость к токсину тРНКазы CdiA-CT EC869 из энтерогеморрагической Escherichia coli EC869. Хотя EF-T необходим для токсичности in vivo, наши результаты показывают, что он необязателен для активности тРНКазы in vitro. Мы обнаружили, что CdiA-CT EC869 связывается с фактором элонгации Tu (EF-Tu) с высокой аффинностью, и это взаимодействие имеет решающее значение для активности нуклеазы.Более того, тРНКазная активность in vitro является GTP-зависимой, что свидетельствует о том, что CdiA-CT EC869 расщепляет тРНК только в контексте трансляционно активных тройных комплексов GTP·EF-Tu·tRNA. Мы предполагаем, что EF-T способствует образованию тройных комплексов GTP·EF-Tu·тРНК, тем самым ускоряя оборот субстрата для быстрого истощения тРНК клетки-мишени.
Хотя EF-T необходим для токсичности in vivo, наши результаты показывают, что он необязателен для активности тРНКазы in vitro. Мы обнаружили, что CdiA-CT EC869 связывается с фактором элонгации Tu (EF-Tu) с высокой аффинностью, и это взаимодействие имеет решающее значение для активности нуклеазы.Более того, тРНКазная активность in vitro является GTP-зависимой, что свидетельствует о том, что CdiA-CT EC869 расщепляет тРНК только в контексте трансляционно активных тройных комплексов GTP·EF-Tu·tRNA. Мы предполагаем, что EF-T способствует образованию тройных комплексов GTP·EF-Tu·тРНК, тем самым ускоряя оборот субстрата для быстрого истощения тРНК клетки-мишени.
Бактерии используют несколько стратегий для конкуренции и сотрудничества с соседними микроорганизмами в окружающей среде. Контактно-зависимое ингибирование роста (CDI) представляет собой одну из важных форм межбактериальной конкуренции, распространенную среди грамотрицательных патогенов (1⇓–3).CDI опосредуется семейством двухпартнерских секреторных белков CdiB/CdiA, которые собираются в виде комплекса на поверхности бактерий CDI + . CdiB представляет собой белок β-ствола Omp85, встроенный во внешнюю мембрану, где он функционирует для экспорта эффекторных белков длинных филаментов CdiA. Эффекторы CdiA выступают из поверхности клеток-ингибиторов и связываются с рецепторами восприимчивых соседних бактерий. После связывания с рецептором CdiA переносит свой С-концевой домен токсина (CdiA-CT) в бактерию-мишень посредством не до конца изученного механизма транслокации (4, 5).Обзоры баз данных геномов и белков показывают, что эффекторы CdiA несут широкий спектр различных токсинов (1, 6⇓-8). Клетки CDI + защищают себя от самоинтоксикации, продуцируя белки иммунитета CdiI, которые специфически связываются с родственными доменами CdiA-CT и нейтрализуют их токсическую активность. Поскольку локусов cdi кодируют сложную сеть пар белков токсин/иммунитет, предполагается, что эти системы опосредуют конкуренцию между штаммами и само-/не-само-узнавание.
CdiB представляет собой белок β-ствола Omp85, встроенный во внешнюю мембрану, где он функционирует для экспорта эффекторных белков длинных филаментов CdiA. Эффекторы CdiA выступают из поверхности клеток-ингибиторов и связываются с рецепторами восприимчивых соседних бактерий. После связывания с рецептором CdiA переносит свой С-концевой домен токсина (CdiA-CT) в бактерию-мишень посредством не до конца изученного механизма транслокации (4, 5).Обзоры баз данных геномов и белков показывают, что эффекторы CdiA несут широкий спектр различных токсинов (1, 6⇓-8). Клетки CDI + защищают себя от самоинтоксикации, продуцируя белки иммунитета CdiI, которые специфически связываются с родственными доменами CdiA-CT и нейтрализуют их токсическую активность. Поскольку локусов cdi кодируют сложную сеть пар белков токсин/иммунитет, предполагается, что эти системы опосредуют конкуренцию между штаммами и само-/не-само-узнавание.
Наши предыдущие исследования показали, что токсины CDI ингибируют рост клеток, используя различные механизмы. Домен CdiA-CT EC93 , развернутый изолятом Escherichia coli EC93, увеличивает проницаемость клетки-мишени для протонов (9, 10), что позволяет предположить, что этот токсин образует поры во внутренней мембране. Многие другие токсины CdiA-CT представляют собой нуклеазы, которые должны быть доставлены в цитоплазму клетки-мишени для ингибирования роста. CdiA-CT 3937 из Dickeya dadanii 3937 обладает мощной ДНКазной активностью, которая разрушает хромосому клетки-мишени (1, 11), тогда как токсин CdiA-CT ECL из Enterobacter cloacae ATCC 13047 расщепляет хромосому клетки-мишени (1, 11) синтез белка (12).Молекулы тРНК являются особенно распространенными субстратами для нуклеазных токсинов CDI. Изоляты Burkholderia pseudomallei K96243, 1026b и E479 используют токсины тРНКазы с различными специфичностями. CDIA-CT K96243 K96243 K96243 K96243 имеет антикодоновую нуклеазную активность на TRNA его , TRNA ASP , TRNA ASN и TRNA TYR IsoAcceptors, и CDIA-CT E479 CT E479 T-петли молекул TRNA между сохранением остатки Ψ54 и Т55 (13, 14).
Домен CdiA-CT EC93 , развернутый изолятом Escherichia coli EC93, увеличивает проницаемость клетки-мишени для протонов (9, 10), что позволяет предположить, что этот токсин образует поры во внутренней мембране. Многие другие токсины CdiA-CT представляют собой нуклеазы, которые должны быть доставлены в цитоплазму клетки-мишени для ингибирования роста. CdiA-CT 3937 из Dickeya dadanii 3937 обладает мощной ДНКазной активностью, которая разрушает хромосому клетки-мишени (1, 11), тогда как токсин CdiA-CT ECL из Enterobacter cloacae ATCC 13047 расщепляет хромосому клетки-мишени (1, 11) синтез белка (12).Молекулы тРНК являются особенно распространенными субстратами для нуклеазных токсинов CDI. Изоляты Burkholderia pseudomallei K96243, 1026b и E479 используют токсины тРНКазы с различными специфичностями. CDIA-CT K96243 K96243 K96243 K96243 имеет антикодоновую нуклеазную активность на TRNA его , TRNA ASP , TRNA ASN и TRNA TYR IsoAcceptors, и CDIA-CT E479 CT E479 T-петли молекул TRNA между сохранением остатки Ψ54 и Т55 (13, 14). CdiA-CT II Bp1026b предпочтительно расщепляет аминоацил-акцепторный ствол тРНК Ala , чтобы блокировать трансляцию (15).Другие неродственные токсины CdiA-CT из изолятов E. coli EC869 и 3006 также расщепляют стебли акцептора тРНК, но специфичны для тРНК Gln и тРНК Ile соответственно (5, 16). Т.о., межбактериальная конкуренция оказала селективное давление для эволюции различных тРНКазных токсинов с отличной специфичностью.
CdiA-CT II Bp1026b предпочтительно расщепляет аминоацил-акцепторный ствол тРНК Ala , чтобы блокировать трансляцию (15).Другие неродственные токсины CdiA-CT из изолятов E. coli EC869 и 3006 также расщепляют стебли акцептора тРНК, но специфичны для тРНК Gln и тРНК Ile соответственно (5, 16). Т.о., межбактериальная конкуренция оказала селективное давление для эволюции различных тРНКазных токсинов с отличной специфичностью.
Большинство нуклеазных доменов CDI эффективно расщепляют свои субстраты in vitro, но токсин CdiA-CT EC536 , выделяемый уропатогенной E. coli 536, требует дополнительного фактора для повышения активности антикодон-нуклеазы тРНК (17).Используя биохимические подходы, мы обнаружили, что биосинтетический фермент O -ацетилсеринсульфгидрилаза А (CysK) с высоким сродством связывает токсин и стимулирует его нуклеазную активность. Это взаимодействие имеет решающее значение для активности токсина, и бактерии-мишени, делетированные по cysK , полностью устойчивы к токсину CdiA-CT EC536 (17). Поскольку мутации cysK придают бактериям-мишеням устойчивость к CDI (CDI R ), преимущество дополнительной стадии активации токсина неясно.Недавняя работа показывает, что CysK стабилизирует кратность CdiA-CT EC536 и способствует взаимодействию токсина с тРНК (18). Также возможно, что CdiA-CT EC536 модулирует активность CysK в родственных иммунных клетках, возможно, играя роль в межклеточной передаче сигналов. Чтобы выяснить, подвержены ли другие токсины CDI внешней активации, мы использовали генетический подход для идентификации факторов клеток-мишеней, необходимых для ингибирования роста тРНКазы CdiA-CT EC869 из энтерогеморрагического штамма E.палочка EC869. Мы выделили два CDI-резистентных (CDI R ) мутанта с миссенс-заменами Ala202Glu и Arg219Pro в tsf , который кодирует важный фактор трансляции EF-Ts. Обе мутации изменяют спиральный домен EF-Ts и значительно снижают активность тРНКазы CdiA-CT EC869 в бактериях-мишенях.
Поскольку мутации cysK придают бактериям-мишеням устойчивость к CDI (CDI R ), преимущество дополнительной стадии активации токсина неясно.Недавняя работа показывает, что CysK стабилизирует кратность CdiA-CT EC536 и способствует взаимодействию токсина с тРНК (18). Также возможно, что CdiA-CT EC536 модулирует активность CysK в родственных иммунных клетках, возможно, играя роль в межклеточной передаче сигналов. Чтобы выяснить, подвержены ли другие токсины CDI внешней активации, мы использовали генетический подход для идентификации факторов клеток-мишеней, необходимых для ингибирования роста тРНКазы CdiA-CT EC869 из энтерогеморрагического штамма E.палочка EC869. Мы выделили два CDI-резистентных (CDI R ) мутанта с миссенс-заменами Ala202Glu и Arg219Pro в tsf , который кодирует важный фактор трансляции EF-Ts. Обе мутации изменяют спиральный домен EF-Ts и значительно снижают активность тРНКазы CdiA-CT EC869 в бактериях-мишенях. Мы обнаружили, что токсин CdiA-CT EC869 связывается с EF-Tu с высокой аффинностью и расщепляет тРНК только в контексте тройных комплексов GTP·EF-Tu·тРНК.Хотя EF-T дикого типа необходимы для токсичности CdiA-CT EC869 у бактерий-мишеней, они, по-видимому, не нужны для активности тРНКазы in vitro. Мы предполагаем, что EF-T способствует активности тРНКазы, ускоряя доставку тРНК к комплексам EF-Tu·токсин, тем самым увеличивая скорость расщепления субстрата.
Мы обнаружили, что токсин CdiA-CT EC869 связывается с EF-Tu с высокой аффинностью и расщепляет тРНК только в контексте тройных комплексов GTP·EF-Tu·тРНК.Хотя EF-T дикого типа необходимы для токсичности CdiA-CT EC869 у бактерий-мишеней, они, по-видимому, не нужны для активности тРНКазы in vitro. Мы предполагаем, что EF-T способствует активности тРНКазы, ускоряя доставку тРНК к комплексам EF-Tu·токсин, тем самым увеличивая скорость расщепления субстрата.
Результаты
Мы использовали генетический подход для идентификации фактора(ов) клетки-мишени, необходимого для CdiA-CT EC869 –опосредованного ингибирования роста. Клетки, в которых развернуты CdiA-CT EC869 , значительно ингибируют рост дикого типа E.coli , но целевые бактерии полностью защищены, когда они экспрессируют иммунный белок CdiI EC869 (рис. 1 A , сравните EC869 с макетом). Затем мы отобрали устойчивые к CDI EC869 (CDI R ) мутанты клеток-мишеней, полагая, что защитные мутации нарушат гены, необходимые для импорта и/или активации токсина..jpg) Независимые пулы CDI-чувствительных (CDI S ) клеток-мишеней E. coli подвергали мутагенезу с помощью УФ-света.Чтобы избежать выделения мутаций, которые разрушают рецептор CdiA BamA, мутагенизированные клетки-мишени также были снабжены геном bamA на мультикопийной плазмиде. Затем пулы клеток-мишеней совместно культивировали с экспрессирующими ингибиторами CdiA-CT EC869 для обогащения устойчивыми мутантами (рис. S1 A ). Большинство УФ-облученных пулов (22/24) не дали мутантов CDI R , но устойчивые популяции были получены из пулов 3 и 17 после трех раундов селекции (рис.S1 В ). Затем мы использовали комплементарный анализ для картирования мутаций CDI R . Мутант CDI R , выделенный из пула 3, сначала метили GFP, а затем трансдуцировали космидной библиотекой хромосомной ДНК E. coli . Полученные клоны культивировали по отдельности с ингибиторами CDI EC869 в микротитрационном планшете, и рост клеток-мишеней контролировали с помощью флуоресценции GFP (фиг.
Независимые пулы CDI-чувствительных (CDI S ) клеток-мишеней E. coli подвергали мутагенезу с помощью УФ-света.Чтобы избежать выделения мутаций, которые разрушают рецептор CdiA BamA, мутагенизированные клетки-мишени также были снабжены геном bamA на мультикопийной плазмиде. Затем пулы клеток-мишеней совместно культивировали с экспрессирующими ингибиторами CdiA-CT EC869 для обогащения устойчивыми мутантами (рис. S1 A ). Большинство УФ-облученных пулов (22/24) не дали мутантов CDI R , но устойчивые популяции были получены из пулов 3 и 17 после трех раундов селекции (рис.S1 В ). Затем мы использовали комплементарный анализ для картирования мутаций CDI R . Мутант CDI R , выделенный из пула 3, сначала метили GFP, а затем трансдуцировали космидной библиотекой хромосомной ДНК E. coli . Полученные клоны культивировали по отдельности с ингибиторами CDI EC869 в микротитрационном планшете, и рост клеток-мишеней контролировали с помощью флуоресценции GFP (фиг. S1 A ). Мы идентифицировали одну космиду, которая сделала мутант чувствительным к CDI.Учитывая очень низкую частоту мутаций CDI R , вызванных УФ-облучением, мы пришли к выводу, что пораженный ген, вероятно, был важным, и поэтому секвенировали гены-кандидаты в пределах 40 т.п.н. от одного конца космидной вставки, расположенной на уровне 193 800 п.н. coli хромосома (19). Мы идентифицировали миссенс-мутацию Ala202Glu в гене tsf , который кодирует важный фактор элонгации трансляции EF-Ts. Анализ второго мутанта CDI R из пула 17 выявил замену Arg219Pro в tsf .Введение аллелей tsf(A202E) и tsf(R219P) в дикий тип E. coli MG1655 придает CDI R фенотипы, демонстрируя, что мутаций достаточно для устойчивости к CDI EC8529 90in 1 А ). Эта устойчивость является специфической, поскольку клетки tsf(A202E) и tsf(R219P) чувствительны к токсину ДНКазы CdiA-CT o11 EC869 из Токсин 16S рРНКазы из E.
S1 A ). Мы идентифицировали одну космиду, которая сделала мутант чувствительным к CDI.Учитывая очень низкую частоту мутаций CDI R , вызванных УФ-облучением, мы пришли к выводу, что пораженный ген, вероятно, был важным, и поэтому секвенировали гены-кандидаты в пределах 40 т.п.н. от одного конца космидной вставки, расположенной на уровне 193 800 п.н. coli хромосома (19). Мы идентифицировали миссенс-мутацию Ala202Glu в гене tsf , который кодирует важный фактор элонгации трансляции EF-Ts. Анализ второго мутанта CDI R из пула 17 выявил замену Arg219Pro в tsf .Введение аллелей tsf(A202E) и tsf(R219P) в дикий тип E. coli MG1655 придает CDI R фенотипы, демонстрируя, что мутаций достаточно для устойчивости к CDI EC8529 90in 1 А ). Эта устойчивость является специфической, поскольку клетки tsf(A202E) и tsf(R219P) чувствительны к токсину ДНКазы CdiA-CT o11 EC869 из Токсин 16S рРНКазы из E. cloacae , антикодоновую нуклеазу CdiA-CT EC536 из E. coli 536 и порообразующий токсин CdiA-CT EC93 из E. coli EC93 (рис. 1 2). Обе мутации tsf изменяют остатки в спирально-скрученном домене EF-T (Fig. 1 C ), указывая на то, что эта область фактора трансляции важна для активности токсина. Спиралевидный домен отсутствует у эукариотических или митохондриальных ортологов и может быть удален из E.coli без потери жизнеспособности клеток (20). Поэтому мы создали целевой штамм tsf(∆coil) и обнаружили, что эти клетки также устойчивы к активности CdiA-CT EC869 (рис. 1 A ). Вместе эти результаты показывают, что спиральный домен EF-T играет критическую и специфическую роль в пути ингибирования роста CDI EC869 .
cloacae , антикодоновую нуклеазу CdiA-CT EC536 из E. coli 536 и порообразующий токсин CdiA-CT EC93 из E. coli EC93 (рис. 1 2). Обе мутации tsf изменяют остатки в спирально-скрученном домене EF-T (Fig. 1 C ), указывая на то, что эта область фактора трансляции важна для активности токсина. Спиралевидный домен отсутствует у эукариотических или митохондриальных ортологов и может быть удален из E.coli без потери жизнеспособности клеток (20). Поэтому мы создали целевой штамм tsf(∆coil) и обнаружили, что эти клетки также устойчивы к активности CdiA-CT EC869 (рис. 1 A ). Вместе эти результаты показывают, что спиральный домен EF-T играет критическую и специфическую роль в пути ингибирования роста CDI EC869 .
Рис. 1.
Мутанты E. coli tsf устойчивы к CdiA-CT EC869 . ( А ) Э.coli MG1655, несущие указанные аллели tsf , совместно культивировали с клетками-ингибиторами E. coli EPI100, которые используют CdiA-CT EC869 (EC869), CdiA-CT o11 EC8669 Токсины CT ECL (ECL), CdiA-CT EC536 (536) или CdiA-CT EC93 (EC93). Через 3 часа определяли количество жизнеспособных клеток для каждой популяции и использовали для расчета индекса конкурентоспособности, как описано в «Материалы и методы» .Мок-ингибиторы не экспрессируют систему CDI. Данные представлены как средние ± SEM для трех независимых экспериментов. ( B ) Клетки-ингибиторы E. coli EPI100, экспрессирующие CdiA-CT EC869 , культивировали в соотношении 1:1 с целевыми штаммами E. coli MG1655, несущими указанные аллели tsf . Тотальную РНК выделяли через 10 и 20 мин и подвергали Нозерн-блот-гибридизации для тРНК CUG Gln . Поскольку клетки-ингибиторы CDI EC869 невосприимчивы к активности токсина, 50% превращение субстрата свидетельствует о полном расщеплении в клетках-мишенях.
coli EPI100, которые используют CdiA-CT EC869 (EC869), CdiA-CT o11 EC8669 Токсины CT ECL (ECL), CdiA-CT EC536 (536) или CdiA-CT EC93 (EC93). Через 3 часа определяли количество жизнеспособных клеток для каждой популяции и использовали для расчета индекса конкурентоспособности, как описано в «Материалы и методы» .Мок-ингибиторы не экспрессируют систему CDI. Данные представлены как средние ± SEM для трех независимых экспериментов. ( B ) Клетки-ингибиторы E. coli EPI100, экспрессирующие CdiA-CT EC869 , культивировали в соотношении 1:1 с целевыми штаммами E. coli MG1655, несущими указанные аллели tsf . Тотальную РНК выделяли через 10 и 20 мин и подвергали Нозерн-блот-гибридизации для тРНК CUG Gln . Поскольку клетки-ингибиторы CDI EC869 невосприимчивы к активности токсина, 50% превращение субстрата свидетельствует о полном расщеплении в клетках-мишенях. ( C ) Структура комплекса E. coli EF-Tu·EF-Ts [Банк данных белков (PDB) Идентификационный код 1EFU]. Указано расположение EF-Ts Ala202, Arg219 и домена суперспирали.
( C ) Структура комплекса E. coli EF-Tu·EF-Ts [Банк данных белков (PDB) Идентификационный код 1EFU]. Указано расположение EF-Ts Ala202, Arg219 и домена суперспирали.
Рис. S1.
Селекция CdiA-CT EC869 – устойчивых мутантов. ( A ) Культуры клеток E. coli в логарифмической фазе роста подвергали УФ-облучению и совместно культивировали в соотношении 1:1 с клетками-ингибиторами CDI EC869 в течение 3 часов. После трех циклов селекции клоны клеток-мишеней из независимых экспериментов выделяли и тестировали на устойчивость к CDI.Анализ комплементации использовали для идентификации гена(ов), ответственного за фенотип CDI R . Мутант CDI R из пула 3 метили GFP и трансдуцировали космидной библиотекой геномной ДНК E. coli . Отдельные трансдуктанты подвергали скринингу на CDI S в конкурентных сокультурах с клетками-ингибиторами CDI EC869 в микротитрационных планшетах. Дополнение к фенотипу CDI S приводит к низкой флуоресценции GFP в конкурентной лунке. ( B ) Пулы клеток-мишеней, облученных УФ-излучением, смешивали 1:1 с клетками-ингибиторами CDI EC869 и совместно культивировали в течение 3 часов. Мутанты CDI R отбирали с помощью повторяющихся циклов конкурентного совместного культивирования. Мутантные пулы, содержащие клетки-мишени CDI R , идентифицировали путем определения конкурентного индекса для раунда обогащения.
( B ) Пулы клеток-мишеней, облученных УФ-излучением, смешивали 1:1 с клетками-ингибиторами CDI EC869 и совместно культивировали в течение 3 часов. Мутанты CDI R отбирали с помощью повторяющихся циклов конкурентного совместного культивирования. Мутантные пулы, содержащие клетки-мишени CDI R , идентифицировали путем определения конкурентного индекса для раунда обогащения.
CdiA-CT EC869 представляет собой РНКазу, которая преимущественно расщепляет тРНК Gln и тРНК Asn , и эта активность тРНКазы может быть обнаружена в конкурентных культурах CDI (рис.С2) (16). Поэтому мы спросили, можно ли обнаружить активность тРНКазы CdiA-CT EC869 у мутантов tsf . Анализ северного блока расщепленной расщепленной TRNA CUG GLN GLN в полной РНК, изолированные от кокультеров с TSF + 60215 + активность целевых клеток, но никакой активности Trnase не обнаружено, когда TSF + целевые элементы Экспресс CDII EC869 из плазмиды (фиг. 1 B ). Не было доказательств активности тРНКазы в клетках-мишенях tsf(A202E) , tsf(R219P) или tsf(∆coil) (фиг.1 B ), предполагая, что EF-T дикого типа необходимы для активности токсина. В качестве альтернативы возможно, что EF-T необходимы для проникновения токсина в бактерии-мишени. Мы рассмотрели эту последнюю возможность, используя биохимический подход. Мы сверхэкспрессировали His 6 -меченый CdiA-CT EC869 в комплексе с CdiI EC869 , затем очистили токсин Ni 2+ -аффинной хроматографией в денатурирующих условиях для удаления белка иммунитета. Выделенный токсин подвергали повторной укладке и анализировали его нуклеазную активность в экстрактах S30, приготовленных из клеток tsf + , tsf(A202E) и tsf(∆coil) .Расщепление тРНК CUG Gln наблюдали при добавлении токсина к клеточному экстракту дикого типа, но активность не была обнаружена в экстрактах tsf(A202E) и tsf(∆coil) (рис.
1 B ). Не было доказательств активности тРНКазы в клетках-мишенях tsf(A202E) , tsf(R219P) или tsf(∆coil) (фиг.1 B ), предполагая, что EF-T дикого типа необходимы для активности токсина. В качестве альтернативы возможно, что EF-T необходимы для проникновения токсина в бактерии-мишени. Мы рассмотрели эту последнюю возможность, используя биохимический подход. Мы сверхэкспрессировали His 6 -меченый CdiA-CT EC869 в комплексе с CdiI EC869 , затем очистили токсин Ni 2+ -аффинной хроматографией в денатурирующих условиях для удаления белка иммунитета. Выделенный токсин подвергали повторной укладке и анализировали его нуклеазную активность в экстрактах S30, приготовленных из клеток tsf + , tsf(A202E) и tsf(∆coil) .Расщепление тРНК CUG Gln наблюдали при добавлении токсина к клеточному экстракту дикого типа, но активность не была обнаружена в экстрактах tsf(A202E) и tsf(∆coil) (рис. 2 A ). Опять же, нуклеазная активность была специфичной для токсина CdiA-CT EC869 , поскольку расщепление тРНК CUG Gln блокировалось в реакциях с добавлением очищенного CdiI EC869 . В совокупности эти результаты показывают, что EF-T способствует активности тРНКазы CdiA-CT EC869 .
2 A ). Опять же, нуклеазная активность была специфичной для токсина CdiA-CT EC869 , поскольку расщепление тРНК CUG Gln блокировалось в реакциях с добавлением очищенного CdiI EC869 . В совокупности эти результаты показывают, что EF-T способствует активности тРНКазы CdiA-CT EC869 .
Рис. 2.
Эффективный CdiA-CT EC869 Для активности тРНКазы требуются EF-Tu, EF-Ts и GTP. ( A ) Лизаты клеток E. coli S30 добавляли очищенный CdiA-CT EC869 (0,1 мкМ) и инкубировали при температуре окружающей среды в течение 1 часа. Тотальную РНК выделяли и анализировали Нозерн-блот-гибридизацией для E.coli тРНК CUG Gln . ( B ) Всего РНК E. coli (0,1 мг/мл) обрабатывали очищенным CdiA-CT EC869 (0,1 мг/мл).1 мкМ), EF-Tu (0,25 мкМ) и EF-Ts (0,25 мкМ) и инкубировали при температуре окружающей среды в течение 1 часа. Там, где указано, CdiA-CT EC869 предварительно инкубировали с CdiI EC869 -His 6 (0,3 мкМ) в течение 30 минут перед добавлением в реакцию. Красная звездочка на дорожке 8 указывает на добавление EF-T (Ala202Glu). Реакции дополняли 1 мМ GTP, где указано, и анализировали с помощью Нозерн-блот-гибридизации для E. coli тРНК CUG Gln . ( C ) Очищенный CdiA-CT EC869 (0.1 мкМ), EF-Tu (0,25 мкМ) и EF-Ts (0,25 мкМ) инкубировали с общей РНК E. coli (0,1 мг/мл) в течение 1 ч при комнатной температуре. Там, где указано, CdiA-CT EC869 предварительно инкубировали с CdiI-His 6 (0,3 мкМ) в течение 30 минут перед добавлением РНК. Реакции были дополнены АТФ, GDP или GTP (1 мкМ), где указано. Реакции анализировали с помощью электрофореза в полиакриламидном геле с денатурирующей мочевиной и Нозерн-блот-гибридизации для тРНК E. coli CUG Gln .
Красная звездочка на дорожке 8 указывает на добавление EF-T (Ala202Glu). Реакции дополняли 1 мМ GTP, где указано, и анализировали с помощью Нозерн-блот-гибридизации для E. coli тРНК CUG Gln . ( C ) Очищенный CdiA-CT EC869 (0.1 мкМ), EF-Tu (0,25 мкМ) и EF-Ts (0,25 мкМ) инкубировали с общей РНК E. coli (0,1 мг/мл) в течение 1 ч при комнатной температуре. Там, где указано, CdiA-CT EC869 предварительно инкубировали с CdiI-His 6 (0,3 мкМ) в течение 30 минут перед добавлением РНК. Реакции были дополнены АТФ, GDP или GTP (1 мкМ), где указано. Реакции анализировали с помощью электрофореза в полиакриламидном геле с денатурирующей мочевиной и Нозерн-блот-гибридизации для тРНК E. coli CUG Gln .
Рис. S2.
CdiA-CT EC869 Активность тРНКазы. Клетки-ингибиторы CDI EC869 инкубировали с неиммунными ( cdiI – ) или иммунными ( cdiI + ) клетками-мишенями в соотношении 1:1 Тотальную РНК выделяли из сокультур и анализировали методом нозерн-блоттинга с использованием зондов к указанным тРНК. Поскольку клетки-ингибиторы CDI EC869 невосприимчивы к активности токсина, 50% превращение субстрата свидетельствует о полном расщеплении в клетках-мишенях.
Поскольку клетки-ингибиторы CDI EC869 невосприимчивы к активности токсина, 50% превращение субстрата свидетельствует о полном расщеплении в клетках-мишенях.
Критическая роль EF-T в токсичности CdiA-CT EC869 , по-видимому, сходна с CdiA-CT EC536 , который проявляет антикодон-нуклеазную активность тРНК только при связывании с CysK (17, 18). Чтобы определить, активирует ли EF-T CdiA-CT EC869 таким же образом, мы протестировали активность CdiA-CT EC869 в определенных реакциях in vitro. Активность тРНКазы не наблюдалась, когда тРНК E. coli обрабатывали очищенным CdiA-CT EC869 (фиг. 2 B , дорожка 5), что свидетельствует о том, что токсину требуется дополнительный фактор для активности.Однако включение очищенных EF-T приводило только к умеренному увеличению активности нуклеазы (фиг. 2-В, дорожка 6). Этот последний результат заставил нас задуматься о том, может ли потребоваться еще один фактор в сочетании с EF-T. Примечательно, что мы обнаружили, что фактор элонгации EF-Tu совместно очищается с комплексом CdiA-CT·CdiI EC869 в неденатурирующих условиях (рис. S3), что позволяет предположить, что этот фактор трансляции может способствовать активности токсина. Примечательно, что комбинации очищенных CdiA-CT EC869 , EF-Tu и EF-T дикого типа было достаточно для расщепления большей части молекул тРНК CUG Gln in vitro при условии, что в реакцию добавляли GTP ( Инжир.2 B , сравните дорожки 2 и 3). Однако очищенные EF-T, несущие замену Ala202Glu, не поддерживали устойчивую активность тРНКазы в тех же условиях (фиг. 2 B , сравните дорожки 3 и 8). Кроме того, мы обнаружили, что потребность в нуклеотидах является специфической, поскольку ни АТФ, ни GDP не поддерживают полную нуклеазную активность in vitro (рис. 2 C , сравните дорожки 3 и 4–5). Поскольку GTP необходим для высокоаффинного связывания тРНК с EF-Tu, этот последний результат убедительно свидетельствует о том, что токсин расщепляет субстрат в контексте комплексов GTP·EF-Tu·tRNA.
Примечательно, что мы обнаружили, что фактор элонгации EF-Tu совместно очищается с комплексом CdiA-CT·CdiI EC869 в неденатурирующих условиях (рис. S3), что позволяет предположить, что этот фактор трансляции может способствовать активности токсина. Примечательно, что комбинации очищенных CdiA-CT EC869 , EF-Tu и EF-T дикого типа было достаточно для расщепления большей части молекул тРНК CUG Gln in vitro при условии, что в реакцию добавляли GTP ( Инжир.2 B , сравните дорожки 2 и 3). Однако очищенные EF-T, несущие замену Ala202Glu, не поддерживали устойчивую активность тРНКазы в тех же условиях (фиг. 2 B , сравните дорожки 3 и 8). Кроме того, мы обнаружили, что потребность в нуклеотидах является специфической, поскольку ни АТФ, ни GDP не поддерживают полную нуклеазную активность in vitro (рис. 2 C , сравните дорожки 3 и 4–5). Поскольку GTP необходим для высокоаффинного связывания тРНК с EF-Tu, этот последний результат убедительно свидетельствует о том, что токсин расщепляет субстрат в контексте комплексов GTP·EF-Tu·tRNA. Чтобы рассмотреть структурную осуществимость этой модели, мы использовали защиту нуклеазы S1 для картирования сайта расщепления на тРНК CUG Gln (рис. 3 A ) и обнаружили, что CdiA-CT EC869 расщепляет между C70 и A71, вблизи 3′-конца стержня акцептора (рис. 3 B и C ). Кристаллические структуры тройных комплексов GTP·EF-Tu·tRNA показывают, что расщепленный фосфодиэфир близок к EF-Tu, но подвергается воздействию растворителя, что обеспечивает доступ нуклеаз (21, 22). В совокупности эти данные показывают, что для эффективной активности токсина необходимы EF-T, EF-Tu и GTP.
Чтобы рассмотреть структурную осуществимость этой модели, мы использовали защиту нуклеазы S1 для картирования сайта расщепления на тРНК CUG Gln (рис. 3 A ) и обнаружили, что CdiA-CT EC869 расщепляет между C70 и A71, вблизи 3′-конца стержня акцептора (рис. 3 B и C ). Кристаллические структуры тройных комплексов GTP·EF-Tu·tRNA показывают, что расщепленный фосфодиэфир близок к EF-Tu, но подвергается воздействию растворителя, что обеспечивает доступ нуклеаз (21, 22). В совокупности эти данные показывают, что для эффективной активности токсина необходимы EF-T, EF-Tu и GTP.
Рис. 3.
CdiA-CT EC869 расщепляется на акцепторном стебле тРНК Gln . ( A ) тРНК CUG Последовательность Gln , показывающая гибридизированный зонд S1 и стандарты олигонуклеотидов, используемые для картирования сайта расщепления токсина. ( B ) Анализы защиты от нуклеазы S1. РНК выделяли из конкурирующих сокультур CDI EC869 и клеток, отравленных внутриклеточной экспрессией CdiA-CT EC869 . Также были проанализированы образцы из нуклеазных реакций in vitro.Там, где указано, исследовали нейтрализующий эффект белка иммунитета CdiI EC869 . Образцы РНК инкубировали с 3′-меченым радиоактивным изотопом зондом S1 и обрабатывали нуклеазой S1, как описано в «Материалы и методы» . Часть гетеродуплексной последовательности зонд S1-тРНК Gln показана справа от авторадиограммы. ( C ) Схема вторичной структуры тРНК CUG Gln . Оранжевая стрелка указывает на место расщепления внутри акцепторного стебля.
Также были проанализированы образцы из нуклеазных реакций in vitro.Там, где указано, исследовали нейтрализующий эффект белка иммунитета CdiI EC869 . Образцы РНК инкубировали с 3′-меченым радиоактивным изотопом зондом S1 и обрабатывали нуклеазой S1, как описано в «Материалы и методы» . Часть гетеродуплексной последовательности зонд S1-тРНК Gln показана справа от авторадиограммы. ( C ) Схема вторичной структуры тРНК CUG Gln . Оранжевая стрелка указывает на место расщепления внутри акцепторного стебля.
Рис. S3.
EF-Tu совместно очищается с комплексом CdiA-CT·CdiI EC869 . Комплекс His 6 -DUF-CdiA-CT·CdiI EC869 очищали из лизатов E. coli с помощью аффинной хроматографии Ni 2+ в неденатурирующих условиях. Анализ SDS/PAGE показывает, что эндогенный EF-Tu совместно очищается с комплексом в этих условиях. Позиции электрофоретической миграции указаны для каждого белка.
Сотрудничество между CdiA-CT EC869 , EF-Tu и EF-Ts напоминает репликазный комплекс бактериофага Qβ (23, 24).Qβ является членом семейства Leviviridae малых РНК-фагов, которые используют РНК-зависимые РНК-полимеразы для репликации своих геномов. Кодируемая фагом β-субъединица требует факторов клетки-хозяина EF-Ts, EF-Tu и рибосомного белка S1 для образования функционального комплекса репликазы. Интересно, что спиральный домен EF-Ts взаимодействует с фаговой β-субъединицей (Fig. S4 A ) и имеет решающее значение для активности репликазы (25⇓-27). Эти наблюдения повышают вероятность того, что мутации tsf нарушают образование комплекса более высокого порядка с EF-Tu и CdiA-CT EC869 .Мы исследовали эту гипотезу, сначала изучив эффективность посева фага R17, другого левивируса, которому для репликации требуются EF-Ts и EF-Tu, на мутантах tsf . Мы обнаружили, что мутанты tsf(R219P) и tsf(∆coil) полностью устойчивы к фагу R17, тогда как клетки tsf(A202E) частично устойчивы (рис. S4 B ). Чтобы определить, образует ли токсин стабильный тройной комплекс с факторами удлинения, мы проверили, очищаются ли EF-Tu и EF-T совместно с His 6 -меченым CdiA-CT EC869 во время аффинной хроматографии Ni 2+ .EF-Tu связывался с токсином, но значительно меньше EF-T подвергалось совместной очистке, даже когда реакции связывания включали EF-Tu и GTP (рис. S5, дорожки 2 и 6). Таким образом, CdiA-CT EC869 связывается с EF-Tu с высокой аффинностью, но EF-Ts, по-видимому, не связывается стабильно с комплексом.
S4 B ). Чтобы определить, образует ли токсин стабильный тройной комплекс с факторами удлинения, мы проверили, очищаются ли EF-Tu и EF-T совместно с His 6 -меченым CdiA-CT EC869 во время аффинной хроматографии Ni 2+ .EF-Tu связывался с токсином, но значительно меньше EF-T подвергалось совместной очистке, даже когда реакции связывания включали EF-Tu и GTP (рис. S5, дорожки 2 и 6). Таким образом, CdiA-CT EC869 связывается с EF-Tu с высокой аффинностью, но EF-Ts, по-видимому, не связывается стабильно с комплексом.
Рис. S4. Репликация фага
R17 нарушена у мутантов tsf . ( A ) Расположение EF-Ts Ala202 и Arg219 показано в контексте комплекса репликазы Qβ (идентификационный код PDB 3MMP).( B ) M13 и R17 Phage Lysates были серийными разбавленными и замечены на газоны клетки E.coli MG1655 F’, которые несут TSF + , TSF (A202E) , TSF (R219P) и tsf(∆coil) аллелей. Указаны количества фагов, доставленных на пятно.
Указаны количества фагов, доставленных на пятно.
Рис. S5.
Связывание токсина CdiA-CT EC869 с EF-Tu. Очищенный His 6 –DUF–CdiA-CT EC869 смешивали с вариантами EF-Tu и EF-Ts, как указано, и затем подвергали аффинной хроматографии Ni 2+ в неденатурирующих условиях.Верхние панели (ВХОД) показывают смеси белков перед хроматографией, а нижние панели (СВЯЗАННЫЕ) показывают белки, элюированные имидазолом.
Затем мы рассмотрели возможность того, что функция обмена гуаниновых нуклеотидов (GEF) EF-T способствует активности токсина. Если активность ГТФазы EF-Tu стимулируется CdiA-CT EC869 , то могут потребоваться EF-T для вытеснения GDP из EF-Tu, тем самым ускоряя образование новых субстратных комплексов GTP·EF-Tu·тРНК.Чтобы выяснить, сопровождает ли гидролиз GTP активность токсина, мы сначала протестировали нуклеазную активность в реакциях с добавлением негидролизуемого GDPNP, который поддерживает тот же уровень расщепления тРНК, что и GTP (рис. 4 A , дорожки 5 и 10). . Затем мы использовали ТСХ для мониторинга гидролиза радиоактивно меченого GTP в реакциях тРНКазы. В этих экспериментах использовали транскрибированную in vitro тРНК CUG Gln (а не общую тРНК E. coli ), чтобы обеспечить доступность достаточного количества субстрата для обеспечения обнаруживаемой активности ГТФазы.Примечательно, что мы не наблюдали продукцию GDP даже в присутствии 0,5 мкМ EF-T дикого типа, которые поддерживали эффективное расщепление 10 мкМ субстрата тРНК CUG Gln (рис. 4 B , дорожка 5). Поскольку активность GTPase не была обнаружена, мы провели реакцию положительного контроля с использованием полинуклеотидкиназы и радиоактивно меченного GTP для фосфорилирования 5 мкМ олигонуклеотидного субстрата. Мы наблюдали продукцию GDP в последней реакции (фиг. 4 B , дорожка 1), что указывает на то, что активность ГТФазы можно обнаружить в этих условиях анализа.В совокупности эти данные показывают, что гидролиз GTP не сопровождается расщеплением тРНК, указывая на то, что функция GEF сама по себе не способствует активности токсина.
4 A , дорожки 5 и 10). . Затем мы использовали ТСХ для мониторинга гидролиза радиоактивно меченого GTP в реакциях тРНКазы. В этих экспериментах использовали транскрибированную in vitro тРНК CUG Gln (а не общую тРНК E. coli ), чтобы обеспечить доступность достаточного количества субстрата для обеспечения обнаруживаемой активности ГТФазы.Примечательно, что мы не наблюдали продукцию GDP даже в присутствии 0,5 мкМ EF-T дикого типа, которые поддерживали эффективное расщепление 10 мкМ субстрата тРНК CUG Gln (рис. 4 B , дорожка 5). Поскольку активность GTPase не была обнаружена, мы провели реакцию положительного контроля с использованием полинуклеотидкиназы и радиоактивно меченного GTP для фосфорилирования 5 мкМ олигонуклеотидного субстрата. Мы наблюдали продукцию GDP в последней реакции (фиг. 4 B , дорожка 1), что указывает на то, что активность ГТФазы можно обнаружить в этих условиях анализа.В совокупности эти данные показывают, что гидролиз GTP не сопровождается расщеплением тРНК, указывая на то, что функция GEF сама по себе не способствует активности токсина.
Рис. 4.
ГТФазная активность не стимулируется CdiA-CT EC869 . ( A ) Очищенный CdiA-CT EC869 (0,1 мкМ), EF-Tu (0,25 мкМ) и EF-Ts (0,25 мкМ) добавляли к общей РНК E. coli (0,1 мг/мл) в виде указано. В реакционные смеси добавляли GTP или негидролизуемый GDPNP (1 мМ) и анализировали методом нозерн-блоттинга на E.coli тРНК CUG Gln . ( B ) Анализы ГТФазы. тРНК CUG Транскрипт Gln (10 мкМ), радиоактивно меченый GTP (15 мкМ), CdiA-CT EC869 (0,5 мкМ), EF-Tu и/или EF-T (0,5 мкМ) инкубировали при температуре окружающей среды. в течение 10 мин. Дорожка 1 соответствует реакции полинуклеотидкиназы с использованием радиоактивно меченного GTP в качестве донора фосфорила. Реакции анализировали с помощью ТСХ ( Upper ) и анализа в денатурирующем полиакриламидном геле ( Lower ), как описано в Materials and Methods .Указаны миграционные позиции ВВП и ВТП.
Мы отметили, что EF-Tu сам по себе поддерживал значительную нуклеазную активность при высоких концентрациях тРНК CUG Gln (10 мкМ), используемых в анализах ГТФазы (рис. 4 B , дорожка 4). Поскольку CdiA-CT EC869 и EF-Tu были очищены из клеток tsf(Δcoil) для этого эксперимента, и дополнительное количество EF-Ts(Δcoil) не повышало активность (фиг. 4 B , дорожка 6), мы пришли к выводу, что одного EF-Tu может быть достаточно для активности токсина.Действительно, мы получили эффективную GTP-зависимую нуклеазную активность в реакциях, содержащих 1 мкМ тРНК CUG транскрипта Gln и 0,5 мкМ EF-Tu (рис. 5 A , дорожки 4 и 7). Однако аналогичная активность наблюдалась в реакциях, содержащих токсин и EF-T (рис. 5 A , дорожки 3 и 6). Поскольку EF-T не связывает GTP, это последнее наблюдение предполагает, что следы загрязнения EF-Tu в препаратах токсина (рис. S5, дорожка 1) могут поддерживать активность тРНКазы в сочетании с EF-T. Чтобы проверить эту возможность, мы исследовали влияние антибиотика ауродокса на нуклеазные реакции in vitro. Aurodox специфически связывается с EF-Tu и значительно снижает его сродство к тРНК (28). Мы обнаружили, что aurodox блокирует EF-Tu-зависимую активность тРНКазы (рис. 5 B , дорожки 2 и 3), что согласуется с гипотезой о том, что токсин действует на комплексы GTP⋅EF-Tu⋅тРНК. Aurodox также аннулировал нуклеазную активность в реакциях EF-Ts (рис. 5 B , дорожки 4 и 5), указывая на то, что загрязнение EF-Tu способствует этой активности.Вместе эти результаты показывают, что EF-Tu необходим для активности нуклеазы CdiA-CT EC869 , тогда как EF-Ts способствует активности при низких концентрациях субстрата.
Чтобы проверить эту возможность, мы исследовали влияние антибиотика ауродокса на нуклеазные реакции in vitro. Aurodox специфически связывается с EF-Tu и значительно снижает его сродство к тРНК (28). Мы обнаружили, что aurodox блокирует EF-Tu-зависимую активность тРНКазы (рис. 5 B , дорожки 2 и 3), что согласуется с гипотезой о том, что токсин действует на комплексы GTP⋅EF-Tu⋅тРНК. Aurodox также аннулировал нуклеазную активность в реакциях EF-Ts (рис. 5 B , дорожки 4 и 5), указывая на то, что загрязнение EF-Tu способствует этой активности.Вместе эти результаты показывают, что EF-Tu необходим для активности нуклеазы CdiA-CT EC869 , тогда как EF-Ts способствует активности при низких концентрациях субстрата.
Рис. 5.
Роль EF-Ts и EF-Tu в расщеплении токсинзависимой тРНК CUG Gln . ( A ) тРНК CUG Транскрипт Gln (1 мкМ) инкубировали с CdiA-CT EC869 (0,5 мкМ), EF-Tu и/или EF-Ts (0,5 мкМ) и GDP или GTP ( 1 мМ) в течение 10 мин при температуре окружающей среды. Реакции разрешали на мочевино-полиакриламидных гелях и визуализировали окрашиванием бромистым этидием. ( B ) тРНК CUG Транскрипты Gln (1 мкМ) обрабатывали очищенным CdiA-CT EC869 (0,5 мкМ), EF-Tu и/или EF-T (0,5 мкМ) и GTP (1 мкМ). мМ) в течение 10 мин при температуре окружающей среды. Ауродокс (4 мкМ) добавляли в указанные реакции. Реакции анализировали, как в A .
Реакции разрешали на мочевино-полиакриламидных гелях и визуализировали окрашиванием бромистым этидием. ( B ) тРНК CUG Транскрипты Gln (1 мкМ) обрабатывали очищенным CdiA-CT EC869 (0,5 мкМ), EF-Tu и/или EF-T (0,5 мкМ) и GTP (1 мкМ). мМ) в течение 10 мин при температуре окружающей среды. Ауродокс (4 мкМ) добавляли в указанные реакции. Реакции анализировали, как в A .
Наконец, мы идентифицировали два дополнительных токсина ИКД, для повышения токсичности которых требуются EF-T дикого типа.Конкурентные сокультуры показали, что клетки-мишени E. coli tsf(∆coil) устойчивы к ингибированию роста токсинами CDI из изолятов E. coli NC101 и 96.154 (рис. S6 A ). Кроме того, мутанты E. coli tsf(A202E) и tsf(R219P) проявляли частичную устойчивость к этим токсинам (рис. S6 A ). Примечательно, что CdiA-CT NC101 и CdiA-CT 96.154 не имеют значительной идентичности последовательностей ни друг с другом, ни с токсином CdiA-CT EC869 (рис. S6 Б ). Таким образом, EF-Ts имеет решающее значение для активности in vivo по крайней мере трех негомологичных токсинов CDI.
S6 Б ). Таким образом, EF-Ts имеет решающее значение для активности in vivo по крайней мере трех негомологичных токсинов CDI.
Рис. S6.
Мутации в домене спиральной спирали EF-T придают CDI устойчивость к другим токсинам тРНКазы. ( A ) Целевые штаммы E. coli MG1655, несущие указанные аллели tsf , совместно культивировали в соотношении 1:1 с ингибиторами E. coli EPI100, которые используют CdiA-CT EC869 (EC869), CT NC101 (NC101), CdiA-CT 96.154 (96.154) или CdiA-CT O32:h47 (O32:h47). Через 3 ч количество жизнеспособных клеток определяли для каждой популяции и использовали для расчета индекса конкурентоспособности, как описано в «Материалы и методы» . Данные представлены как средние ± SEM для трех независимых экспериментов. ( B ) Выравнивание последовательностей CdiA-CT из штаммов E. coli EC869 (ссылка NCBI WP_001075571.1), NC101 (WP_000554167.1), 96,154 (EIH97650. 1) и O32:h47 (EIF16908.1) . Последовательности (начиная с консервативного мотива VENN) выравнивали с помощью Clustal Omega на сервере Uniprot (www.uniprot.org/align/), а результаты были обработаны с помощью Jalview (www.jalview.org).
1) и O32:h47 (EIF16908.1) . Последовательности (начиная с консервативного мотива VENN) выравнивали с помощью Clustal Omega на сервере Uniprot (www.uniprot.org/align/), а результаты были обработаны с помощью Jalview (www.jalview.org).
Обсуждение
Эти результаты показывают, что опосредованное CDI EC869 ингибирование роста требует двух основных и основных компонентов аппарата трансляции. Существует по крайней мере две модели, объясняющие, как EF-Tu и EF-T способствуют активности нуклеазы CdiA-CT EC869 . Первый механизм предполагает образование тройного комплекса EF-Ts·EF-Tu·CdiA-CT EC869 , в котором два фактора трансляции образуют каркас, активирующий токсин.В этой модели спиральный домен EF-Ts будет взаимодействовать непосредственно с CdiA-CT EC869 , аналогично его структурной роли в комплексе репликазы РНК фага Qβ (20, 25). Однако, в отличие от репликазы Qβ, EF-Ts не образует стабильного стехиометрического комплекса с EF-Tu и CdiA-CT EC869 . Вместе с данными, показывающими, что активность тРНКазы in vitro зависит от ГТФ и блокируется ауродоксом, оказывается, что CdiA-CT EC869 расщепляет тРНК только в контексте трансляционно активных комплексов GTP⋅EF-Tu⋅тРНК.Мы отмечаем, что хотя деацилированная тРНК может быть расщеплена in vitro, аминоацилированная тРНК имеет большее сродство к EF-Tu и почти наверняка является физиологически значимым субстратом токсина. Мы предполагаем, что EF-T действует как критический дополнительный фактор для загрузки тРНК на EF-Tu, ускоряя производство субстрата GTP⋅EF-Tu⋅тРНК для расщепления. Эта модель подтверждается недавней работой Blanchard и коллег, которые показали, что EF-Ts способствует как ассоциации, так и диссоциации тРНК от EF-Tu (29).Эта активность сопутствует, но отличается от хорошо описанной функции GEF EF-T (30). Knudsen и др. недавно предположили, что спиральный домен EF-Ts и, в частности, его консервативный основной участок (включая Arg219) может способствовать загрузке тРНК на EF-Tu (31).
Вместе с данными, показывающими, что активность тРНКазы in vitro зависит от ГТФ и блокируется ауродоксом, оказывается, что CdiA-CT EC869 расщепляет тРНК только в контексте трансляционно активных комплексов GTP⋅EF-Tu⋅тРНК.Мы отмечаем, что хотя деацилированная тРНК может быть расщеплена in vitro, аминоацилированная тРНК имеет большее сродство к EF-Tu и почти наверняка является физиологически значимым субстратом токсина. Мы предполагаем, что EF-T действует как критический дополнительный фактор для загрузки тРНК на EF-Tu, ускоряя производство субстрата GTP⋅EF-Tu⋅тРНК для расщепления. Эта модель подтверждается недавней работой Blanchard и коллег, которые показали, что EF-Ts способствует как ассоциации, так и диссоциации тРНК от EF-Tu (29).Эта активность сопутствует, но отличается от хорошо описанной функции GEF EF-T (30). Knudsen и др. недавно предположили, что спиральный домен EF-Ts и, в частности, его консервативный основной участок (включая Arg219) может способствовать загрузке тРНК на EF-Tu (31). Эта модель также подтверждается наблюдением, что спиральная спираль EF-Ts напоминает область связывания тРНК некоторых аминоацил-тРНК-синтетаз (32).
Эта модель также подтверждается наблюдением, что спиральная спираль EF-Ts напоминает область связывания тРНК некоторых аминоацил-тРНК-синтетаз (32).
Учитывая, что большинство охарактеризованных нуклеазных токсинов CDI являются автономными, неясно, почему некоторые системы эволюционировали, чтобы использовать факторы клетки-мишени для активации токсина.Поскольку CdiA-CT EC869 расщепляется вблизи 3′-конца тРНК CUG Gln , мы предполагаем, что EF-Tu позиционирует активный сайт токсина рядом с разрывной связью. Однако EF-Tu не является необходимым для такой активности, потому что другие токсины CDI расщепляют акцепторные стебли тРНК независимо от фактора трансляции (5, 15). Одним интригующим объяснением является то, что взаимодействия токсин · EF-Tu играют дополнительные роли в межклеточной передаче сигналов. В этой модели токсины, доставленные в иммунные родственные клетки, будут образовывать тройные комплексы EF-Tu·CdiA-CT·CdiI, которые модулируют физиологию в ответ на плотность клеток. Функция EF-Tu может быть модулирована непосредственно с помощью CdiA-CT·CdiI EC869 , аналогично посттрансляционным модификациям, которые регулируют фактор трансляции в ответ на сигналы окружающей среды (33, 34). Альтернативно, возможно, что фрагменты тРНК, продуцируемые сублетальной активностью нуклеазы, могут регулировать экспрессию генов способом, сходным с описанным для эукариот (35). Эта общая модель подтверждается работой Коттера и его коллег, показывающей, что межродственный обмен токсинами CDI влияет на экспрессию генов биопленки у Burkholderia thailandensis (36).
Функция EF-Tu может быть модулирована непосредственно с помощью CdiA-CT·CdiI EC869 , аналогично посттрансляционным модификациям, которые регулируют фактор трансляции в ответ на сигналы окружающей среды (33, 34). Альтернативно, возможно, что фрагменты тРНК, продуцируемые сублетальной активностью нуклеазы, могут регулировать экспрессию генов способом, сходным с описанным для эукариот (35). Эта общая модель подтверждается работой Коттера и его коллег, показывающей, что межродственный обмен токсинами CDI влияет на экспрессию генов биопленки у Burkholderia thailandensis (36).
Недавно Mougous и его коллеги сообщили о взаимодействии между EF-Tu и токсином Tse6 Pseudomonas aeruginosa PAO1 (37). Tse6 представляет собой эффектор системы секреции типа VI (T6SS) с новой активностью NADase. Кристаллическая структура комплекса EF-Tu·Tse6 показывает, что токсин вступает в контакт с нуклеотидсвязывающим доменом 1 EF-Tu, используя поверхность, которая напрямую связывается с EF-T. В отличие от токсина CdiA-CT EC869 , EF-Tu не требуется для ферментативной активности Tse6.Однако мутации Tse6, которые блокируют связывание EF-Tu, также лишают возможности интоксикации бактерий-мишеней, предполагая, что взаимодействие с EF-Tu может быть необходимо для опосредованной T6SS секреции Tse6 или проникновения эффектора в цитоплазму клетки-мишени (37). ). Эти наблюдения вместе с представленными здесь данными показывают, что различные домены бактериального токсина используют EF-Tu для стимулирования межбактериальной конкуренции.
В отличие от токсина CdiA-CT EC869 , EF-Tu не требуется для ферментативной активности Tse6.Однако мутации Tse6, которые блокируют связывание EF-Tu, также лишают возможности интоксикации бактерий-мишеней, предполагая, что взаимодействие с EF-Tu может быть необходимо для опосредованной T6SS секреции Tse6 или проникновения эффектора в цитоплазму клетки-мишени (37). ). Эти наблюдения вместе с представленными здесь данными показывают, что различные домены бактериального токсина используют EF-Tu для стимулирования межбактериальной конкуренции.
Материалы и методы
Бактерии и CDI Competition Cocultures.
Бактериальные штаммы перечислены в таблице S1. Бактерии выращивали при 37°C в среде LB или на агаре LB, если не указано иное. В среды добавляли антибиотики в следующих концентрациях: ампициллин (Amp) 150 мкг⋅мл –1 , канамицин (Kan) 40 мкг⋅мл –1 , хлорамфеникол (Cm) 12,5 или 34 мкг⋅мл –1 . и спектиномицин (Spc) 50 мкг⋅мл -1 . Для конкурентных сокультур ингибитор и клетки-мишени сначала выращивали до средней логарифмической фазы, а затем смешивали в соотношении 10:1 в среде без антибиотиков.Сокультуры инкубировали при встряхивании при 225 об/мин в колбах с перегородками. Через 3 ч жизнеспособные ингибиторы и клетки-мишени подсчитывали как колониеобразующие единицы на селективном LB-агаре. Конкурентный индекс рассчитывали как отношение клеток-мишеней к клеткам-ингибиторам через 3 ч, деленное на исходное соотношение.
Для конкурентных сокультур ингибитор и клетки-мишени сначала выращивали до средней логарифмической фазы, а затем смешивали в соотношении 10:1 в среде без антибиотиков.Сокультуры инкубировали при встряхивании при 225 об/мин в колбах с перегородками. Через 3 ч жизнеспособные ингибиторы и клетки-мишени подсчитывали как колониеобразующие единицы на селективном LB-агаре. Конкурентный индекс рассчитывали как отношение клеток-мишеней к клеткам-ингибиторам через 3 ч, деленное на исходное соотношение.
Таблица S1.
Бактериальные штаммы
Плазмидные конструкции.
Плазмиды и олигонуклеотиды перечислены в таблицах S2 и S3 соответственно. Гены tufA , tsf и cdiA-CT/cdiI EC869 амплифицировали с парами праймеров Ch4671/Ch467, Ch4673/Ch3188 и 3875/3834 (соответственно) и сайты ограничений.Ген cdiI EC869 амплифицировали с праймерами 3890/3781 и Ch320/Ch321 и лигировали с pET21b (NdeI/XhoI) и pTrc99KX (KpnI/XhoI) соответственно. Фрагмент duf-cdiA-CT/cdiI EC869 амплифицировали из pCh20525 с Ch3324/Ch4834 и лигировали с плазмидой pCH6243 с использованием сайтов SpeI/XhoI. Модули cdiA-CT/cdiI из E. coli 96.154 и O32:h47 были амплифицированы с праймерами Ch4170/Ch4171 и Ch4567/Ch4568 (соответственно) и объединены с cdiA EC93 фрагментами ampl. 1663/2368 с помощью ПЦР с перекрывающимися концами (15).Конечные продукты электропорировали вместе с плазмидой pCh20163 в штамм E. coli DY378 и рекомбинантные плазмиды, отобранные, как описано (15).
Фрагмент duf-cdiA-CT/cdiI EC869 амплифицировали из pCh20525 с Ch3324/Ch4834 и лигировали с плазмидой pCH6243 с использованием сайтов SpeI/XhoI. Модули cdiA-CT/cdiI из E. coli 96.154 и O32:h47 были амплифицированы с праймерами Ch4170/Ch4171 и Ch4567/Ch4568 (соответственно) и объединены с cdiA EC93 фрагментами ampl. 1663/2368 с помощью ПЦР с перекрывающимися концами (15).Конечные продукты электропорировали вместе с плазмидой pCh20163 в штамм E. coli DY378 и рекомбинантные плазмиды, отобранные, как описано (15).
Таблица S3.
Олигонуклеотиды
УФ-мутагенез и анализ комплементации.
Клетки E. coli MG1655, несущие pZS21- bamA + , выращивали до средней логарифмической фазы, собирали центрифугированием и ресуспендировали в 0,1 М MgSO 4 at 6 ) из 0.4. Суспензию облучали при 32 Дж/м 2 в Stratalinker 1800. Облученные клетки собирали центрифугированием, ресуспендировали в среде LB и выдерживали в темноте для всех последующих стадий. Облученные клетки культивировали в соотношении 1:1 с ингибиторами E. coli EPI100, несущими pCh20525, для отбора мутантов CDI R . Выжившие клетки-мишени выделяли на агаре LB с добавлением Kan, объединяли и подвергали двум дополнительным циклам селекции CDI EC869 .Отдельные колонии были выделены из окончательной селекции, и фенотипы CDI R были подтверждены в конкурентных сокультурах. Мутации CDI R картировали с помощью комплементарного анализа. Мутанты трансформировали плазмидой pRK6, затем трансдуцировали малокопийной космидной библиотекой pREG153 геномной ДНК E. coli (38). Трансдуктанты индивидуально культивировали совместно с ингибиторами CDI EC869 в микротитровальных планшетах и рост клеток-мишеней контролировали с помощью флуориметрии. Лунки, демонстрирующие низкую флуоресценцию GFP, указывают на ингибирование роста, что предполагает комплементарность фенотипу CDI S .Результаты сравнивали с контрольными кокультурами, содержащими ложные (CDI —) клетки-ингибиторы.
Облученные клетки культивировали в соотношении 1:1 с ингибиторами E. coli EPI100, несущими pCh20525, для отбора мутантов CDI R . Выжившие клетки-мишени выделяли на агаре LB с добавлением Kan, объединяли и подвергали двум дополнительным циклам селекции CDI EC869 .Отдельные колонии были выделены из окончательной селекции, и фенотипы CDI R были подтверждены в конкурентных сокультурах. Мутации CDI R картировали с помощью комплементарного анализа. Мутанты трансформировали плазмидой pRK6, затем трансдуцировали малокопийной космидной библиотекой pREG153 геномной ДНК E. coli (38). Трансдуктанты индивидуально культивировали совместно с ингибиторами CDI EC869 в микротитровальных планшетах и рост клеток-мишеней контролировали с помощью флуориметрии. Лунки, демонстрирующие низкую флуоресценцию GFP, указывают на ингибирование роста, что предполагает комплементарность фенотипу CDI S .Результаты сравнивали с контрольными кокультурами, содержащими ложные (CDI —) клетки-ингибиторы.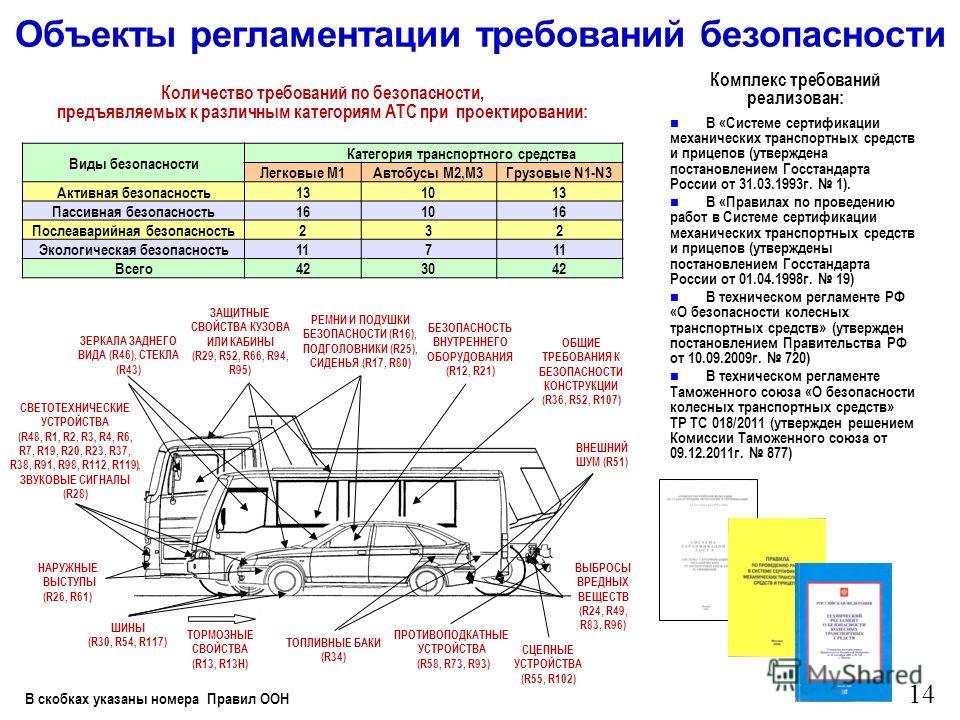 Комплементарную космиду секвенировали с использованием праймера 3513.
Комплементарную космиду секвенировали с использованием праймера 3513.
Конструирование и генетическое манипулирование клетками-мишенями MG1655.
Мутация ∆ wzb была введена в штамм E. coli MG1655 путем аллельного обмена. Последовательности, фланкирующие wzb , амплифицировали с праймерами 3900/3901 и 3902/3903. Верхний фрагмент расщепляли SacI/BamHI, а нижний фрагмент расщепляли BamHI/XbaI.Два фрагмента затем лигировали с pRE112, используя сайты рестрикции SacI/XbaI. Полученную плазмиду вводили в E. coli DL8705 путем конъюгации и отбирали эксконъюганты на агаре LB с добавлением Cm. Контрселекцию проводили на агаре LB с добавлением 5% (вес/объем) сахарозы (39). Делеция wzb в DL8698 была подтверждена ПЦР с использованием 3918/3919. Аллель ∆ araBAD::spec из DL5850 был введен в DL8698 путем трансдукции фагом P1. Мутации tsf(A202E) и tsf(R219P) были введены в E.coli MG1655 с использованием аллельного обмена. Аллели амплифицировали с 3677/3678 и лигировали с pRE112, используя сайты рестрикции SacI/XbaI. Аллель tsf(∆coil ) (в котором Val186–Gly225 заменен пептидом EPGGEA) (20) был сконструирован из фрагментов, амплифицированных с 3818/3819 и 3820/3821. Продукты объединяли с помощью OE-PCR с 3818/3821, затем лигировали с плазмидой pRE112, используя сайты рестрикции SacI/XbaI. Рекомбинанты подвергали скринингу с помощью ПЦР с использованием 3836/3837, и все аллели подтверждали секвенированием ДНК.Эпизому F´::Tn 10 из E.coli XL-1 скрещивали с производными E.coli MG1655 для получения штаммов для анализа фагового посева.
Аллели амплифицировали с 3677/3678 и лигировали с pRE112, используя сайты рестрикции SacI/XbaI. Аллель tsf(∆coil ) (в котором Val186–Gly225 заменен пептидом EPGGEA) (20) был сконструирован из фрагментов, амплифицированных с 3818/3819 и 3820/3821. Продукты объединяли с помощью OE-PCR с 3818/3821, затем лигировали с плазмидой pRE112, используя сайты рестрикции SacI/XbaI. Рекомбинанты подвергали скринингу с помощью ПЦР с использованием 3836/3837, и все аллели подтверждали секвенированием ДНК.Эпизому F´::Tn 10 из E.coli XL-1 скрещивали с производными E.coli MG1655 для получения штаммов для анализа фагового посева.
Очистка и анализ белков.
Все белки были сверхпродуцированы в E. coli Ch3016 при добавлении изопропил-β-d-1-тиогалактопиранозида (IPTG) до 1 мМ. После инкубации в течение 2 ч клетки собирали и замораживали при –80 °С. Осадок клеток ресуспендировали в буфере А [50 мМ Трис·HCl (pH 7,5), 150 мМ NaCl, 10 мМ β-меркаптоэтанол (β-МЕ), 0. 05% Triton X-100, 20 мМ имидазола] и разрушают двумя проходами через Френч-пресс при 20000 фунтов на квадратный дюйм. Клеточный дебрис удаляли двумя циклами центрифугирования при 16 000 × g при 4 °C. Его 6 -меченые белки очищали с помощью аффинной хроматографии Ni 2+ в буфере А. Для очистки слияний CdiA-CT EC869 аффинные смолы промывали 20 мМ трис-HCl (рН 7,5) и 6 М гуанидин-HCl для высвобождения CdiI EC869 перед элюированием. Его белки с меткой 6 элюировали 20 мМ Tris⋅HCl (pH 7.5) и 250 мМ имидазола и подвергали диализу против буфера В [20 мМ фосфата натрия (pH 7,8), 150 мМ NaCl, 10 мМ β-ME]. После диализа His 6 -TrxA расщепляли с помощью протеазы TEV и удаляли с помощью аффинной хроматографии Ni 2+ . Очищенные белки хранили при –20 °С в буфере Б с добавлением 50% глицерина. Межбелковые взаимодействия оценивали в буфере C [10 мМ фосфата натрия (pH 7,5), 150 мМ NaCl, 20 мМ MgCl 2 , 1 мМ DTT] с использованием 5 мкМ каждого белка в 500 мкл реакции при 4 °C, как и ранее.
05% Triton X-100, 20 мМ имидазола] и разрушают двумя проходами через Френч-пресс при 20000 фунтов на квадратный дюйм. Клеточный дебрис удаляли двумя циклами центрифугирования при 16 000 × g при 4 °C. Его 6 -меченые белки очищали с помощью аффинной хроматографии Ni 2+ в буфере А. Для очистки слияний CdiA-CT EC869 аффинные смолы промывали 20 мМ трис-HCl (рН 7,5) и 6 М гуанидин-HCl для высвобождения CdiI EC869 перед элюированием. Его белки с меткой 6 элюировали 20 мМ Tris⋅HCl (pH 7.5) и 250 мМ имидазола и подвергали диализу против буфера В [20 мМ фосфата натрия (pH 7,8), 150 мМ NaCl, 10 мМ β-ME]. После диализа His 6 -TrxA расщепляли с помощью протеазы TEV и удаляли с помощью аффинной хроматографии Ni 2+ . Очищенные белки хранили при –20 °С в буфере Б с добавлением 50% глицерина. Межбелковые взаимодействия оценивали в буфере C [10 мМ фосфата натрия (pH 7,5), 150 мМ NaCl, 20 мМ MgCl 2 , 1 мМ DTT] с использованием 5 мкМ каждого белка в 500 мкл реакции при 4 °C, как и ранее.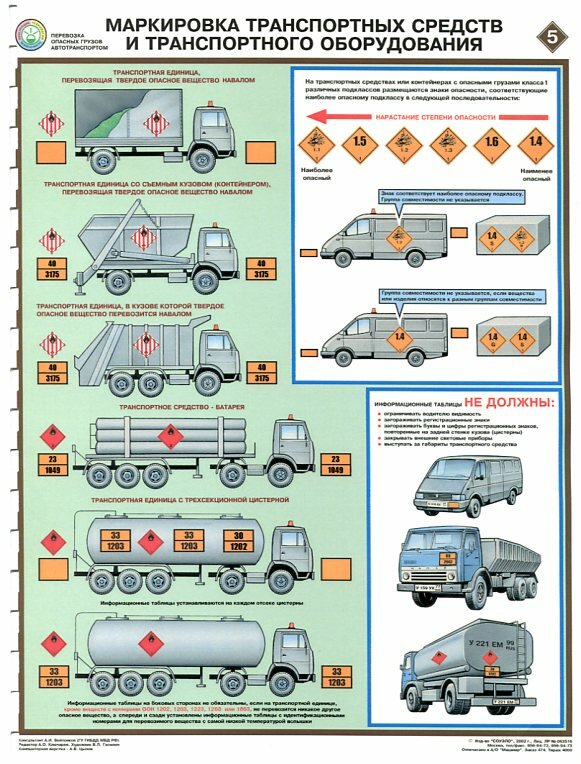 описан (1).
описан (1).
Выделение и анализ РНК.
Сокультуры для соревнований собирали в равном объеме ледяного метанола, клетки собирали центрифугированием и замораживали при –80 °C. Тотальную РНК экстрагировали изотиоцианатом гуанидиния (GITC)-фенолом, как описано (40, 41), и ресуспендировали в 10 мМ ацетате натрия (pH 5,2), который стабилизирует аминоацильную связь (42). Тотальную РНК (5 мкг) анализировали методом нозерн-блоттинга с использованием [ 32 P]-меченых олигонуклеотидов 3894, Ch552, CH800, CH801 и Ch2417 в качестве зондов (16).Экстракты S30 готовили из клеток E. coli Ch3016, DL8530 и DL8546, выращенных до ОП 600 ~0,5. Клетки ресуспендировали в буфере В и разрушали путем прохождения через пресс Френча при 20000 фунтов на квадратный дюйм. Лизаты осветляли двумя циклами центрифугирования при 14000× g в течение 10 мин. Очищенный CdiA-CT EC869 (0,1 мкМ) добавляли к клеточным супернатантам и инкубировали при температуре окружающей среды в течение 1 часа. Затем РНК выделяли экстракцией GITC-фенолом и анализировали с помощью Нозерн-блоттинга.Для анализа активности токсина с использованием очищенных компонентов суммарную РНК E. coli инкубировали с очищенными CdiA-CT EC869 , EF-Tu, EF-Ts и/или CdiI EC869 в буфере C или буфере D [20]. мМ Tris⋅HCl (рН 7,5), 150 мМ NaCl, 5 мМ MgCl 2 , 1 мМ ДТТ]. тРНК CUG Gln получали путем транскрипции in vitro, как описано ранее (43). Анализ защиты от нуклеазы S1 выполняли, как описано (41), с использованием олигонуклеотида Ch4850 для картирования 3′-конца тРНК CUG Gln .Миграционные стандартные олигонуклеотиды (Ch4851, Ch4852 и Ch4853) были помечены по 3′-концу [α- 32 P]-кордицепинтрифосфатом и терминальной трансферазой и обессолены с использованием спин-колонки G-25, а также по 5′-фосфорилированы полинуклеотидкиназой и немечеными. АТФ.
Затем РНК выделяли экстракцией GITC-фенолом и анализировали с помощью Нозерн-блоттинга.Для анализа активности токсина с использованием очищенных компонентов суммарную РНК E. coli инкубировали с очищенными CdiA-CT EC869 , EF-Tu, EF-Ts и/или CdiI EC869 в буфере C или буфере D [20]. мМ Tris⋅HCl (рН 7,5), 150 мМ NaCl, 5 мМ MgCl 2 , 1 мМ ДТТ]. тРНК CUG Gln получали путем транскрипции in vitro, как описано ранее (43). Анализ защиты от нуклеазы S1 выполняли, как описано (41), с использованием олигонуклеотида Ch4850 для картирования 3′-конца тРНК CUG Gln .Миграционные стандартные олигонуклеотиды (Ch4851, Ch4852 и Ch4853) были помечены по 3′-концу [α- 32 P]-кордицепинтрифосфатом и терминальной трансферазой и обессолены с использованием спин-колонки G-25, а также по 5′-фосфорилированы полинуклеотидкиназой и немечеными. АТФ.
Анализы ГТФазы.
In vitro-транскрибируемая тРНК CUG Gln (10 мкМ) инкубировали с вариантами CdiA-CT EC869 , EF-Tu и EF-Ts (0,5 мкМ каждый) в буфере D. Реакции дополняли 15 мкМ ГТФ (0.033 мкМ [α- 32 P]-GTP) и инкубировали при температуре окружающей среды в течение 10 мин. Реакции положительного контроля проводили в тех же условиях с олигонуклеотидом 3894 (5 мкМ) и полинуклеотидкиназой. Реакции разрешали с помощью ТСХ на полиэтилениминовой целлюлозе (Polygram cel 300 PEI/UV254) с использованием 0,3 М фосфата натрия (pH 3,5) в качестве подвижной фазы. Листы целлюлозы экспонировали на экранах люминофора и хроматограммы визуализировали на люминофоре Bio-Rad с использованием программного обеспечения Quantity One.
Реакции дополняли 15 мкМ ГТФ (0.033 мкМ [α- 32 P]-GTP) и инкубировали при температуре окружающей среды в течение 10 мин. Реакции положительного контроля проводили в тех же условиях с олигонуклеотидом 3894 (5 мкМ) и полинуклеотидкиназой. Реакции разрешали с помощью ТСХ на полиэтилениминовой целлюлозе (Polygram cel 300 PEI/UV254) с использованием 0,3 М фосфата натрия (pH 3,5) в качестве подвижной фазы. Листы целлюлозы экспонировали на экранах люминофора и хроматограммы визуализировали на люминофоре Bio-Rad с использованием программного обеспечения Quantity One.
Благодарности
Мы благодарим Kurt Fredrick, John Perona и Zachary Ruhe за технические идеи и полезные обсуждения, а также Julia Willett за создание плазмид. Эта работа была поддержана грантом NIH R01 GM117373 (для CSH и DAL) и грантом Национального научного фонда MCB1545720 (для DAL и CSH). А.М.Дж. получил поддержку от Товарищества Ральфа М. Парсонса.
Сноски
Вклад авторов: A.
 M.J., F.G.-S., C.S.H. и D.A.L. разработанное исследование; А.М.Дж., Ф.Г.-С. и Дж.С. проведенное исследование; A.M.J., F.G.-S., C.S.H. и D.A.L. проанализированные данные; и A.M.J., F.G.-S., C.S.H. и D.A.L. написал бумагу.
M.J., F.G.-S., C.S.H. и D.A.L. разработанное исследование; А.М.Дж., Ф.Г.-С. и Дж.С. проведенное исследование; A.M.J., F.G.-S., C.S.H. и D.A.L. проанализированные данные; и A.M.J., F.G.-S., C.S.H. и D.A.L. написал бумагу.Авторы заявляют об отсутствии конфликта интересов.
Эта статья является прямой отправкой PNAS.
Эта статья содержит вспомогательную информацию в Интернете по адресу www.pnas.org/lookup/suppl/doi:10.1073/pnas.1619273114/-/DCSupplemental.
Кристина Уэллс в роли Урсулы, наконец, в «Русалочке» TUTS
Кристина Уэллс в роли Урсулы, Логан Кеслар в роли Флотзама и Блэр Медина в роли Джетсама в новой постановке TUTS по диснеевскому мультфильму «Русалочка».Фото: Мелисса Тейлор
Кристина Уэллс известна своим голосом, потрясающим инструментом, который привел ее в полуфинал конкурса America’s Got Talent и сделал ее популярной в Хьюстоне. Ранее в этом году она возглавила сольное шоу в Miller Outdoor Theater и выступит в Sylvan Beach Pavilion в La Porte в канун Нового года.
Несмотря на ее потрясающий вокал или благодаря ему — она не кричит. Всегда.
«Я ужасно оберегаю свой голос, поэтому, если я волнуюсь, я кричу «ооооооооооооооооооооооооооооооооооооооооо».Я знаю, это звучит так безумно. Сейчас я Селин Дион», — говорит Уэллс, ссылаясь на печально известную тщательность вокала канадской певицы.
TEE OFF: Pixar Putt приносит «Вверх», «Историю игрушек», «Коко» и многое другое на поле для мини-гольфа в Discovery Green
Она остановилась около трех лет назад и говорит Даже во время фильма ужасов или после, потому что обрубка пальца ноги: «Вы не услышите шума». Это изменилось этим летом, когда TUTS пригласили Уэллса сыграть Урсулу, скользкую морскую ведьму, в мюзикле «Русалочка».Он продлится до 24 декабря в Hobby Center.
«Я лежал в постели и получил это электронное письмо, — говорит Уэллс. «Я кричала и кричала, бежала — и когда я говорю бежать, я имею в виду буквально бегать, согнув ноги — взад и вперед. И я просто плакала, потому что очень этого хотела».
И я просто плакала, потому что очень этого хотела».
Мюзикл основан на диснеевском фильме 1989 года и басне Ганса Христиана Андерсена о русалке, которая отказывается от своего хвоста и голоса ради настоящей любви. Он дебютировал на Бродвее в 2008 году и был представлен 685 раз.Перезагрузка мюзикла в 2012 году дала Урсуле новую предысторию, сделав ее тетей Ариэль. Персонаж был частично вдохновлен значком перетаскивания Divine и стал одним из самых популярных злодеев Диснея.
Уэллс, работающая дипломированной медсестрой, гонялась за этой ролью восемь лет. Она даже безуспешно пробовалась на постановку в Арканзасе. В прошлом году, когда COVID-19 остановил театр, она представила видео для TUTS Musical Mornings, серии виртуальных перформансов на Facebook. Она спела «I Want the Good Times Back», песню в исполнении Урсулы в «Русалочке».
«Это было частью моей уловки: «Привет, я Урсула — привет!» — говорит Уэллс.
Ее сердце было разбито, когда она поняла, что график репетиций не соответствует ее расписанию с 9 до 5. К счастью, TUTS был готов заставить это работать. Уэллс наняла педагога по вокалу и даже сняла манерное видео, чтобы объявить, что она получила роль. Она видит в этом шанс показать публике, что она больше, чем просто белтер.
К счастью, TUTS был готов заставить это работать. Уэллс наняла педагога по вокалу и даже сняла манерное видео, чтобы объявить, что она получила роль. Она видит в этом шанс показать публике, что она больше, чем просто белтер.
Постановка TUTS «Русалочка» важна по нескольким причинам как для Уэллса, так и для местного живого театра.Она говорит, что шоу «опирается на мою коричневую кожу» и является частью мультикультурного состава, в который входят Дельфи Борич, американка японского происхождения, в роли Ариэль; и Ной Рикеттс и Деррик Дэвис, черные, в роли принца Эрика и короля Тритона соответственно. Карла Вудс, чернокожая женщина, играет Себастьяна, друга-краба, которого обычно изображает мужчина.
«Русалочка» в TUTS
Когда: Сейчас до 24 декабря
Где: TUTS в Центре хобби, 800 Bagby
Билеты: 40 долларов и выше; тутшустон. ком
ком
Канун Нового года с Кристиной Уэллс
Когда: 19:00 31 декабря
Где: Sylvan Beach Pavilion, 1 Sylvan Beach, La Porte
Билеты: $75 и выше; christinawells.com
Уэллс говорит, что в конечном счете она отождествляет себя с Урсулой глубоко личным образом, который лучше всего выражен в ее песне первого акта «Daddy’s Little Angel»:
» Я был номером семь, рожденным от семи маленьких девочек/Семи маленьких жемчужин
Красиво, как может быть/Идеально для Т/Все, кроме меня
Уродливый как слизняк/Отвратительно обниматься … »
«Просто чувствую себя непривлекательным и обособленным из-за этого и не вписываюсь. Будучи большим и громким, вот кто я. Я не был самым популярным шестилетним ребенком. Я пел так в десять часов в церкви, а они такие: «Не делай этого», — говорит Уэллс.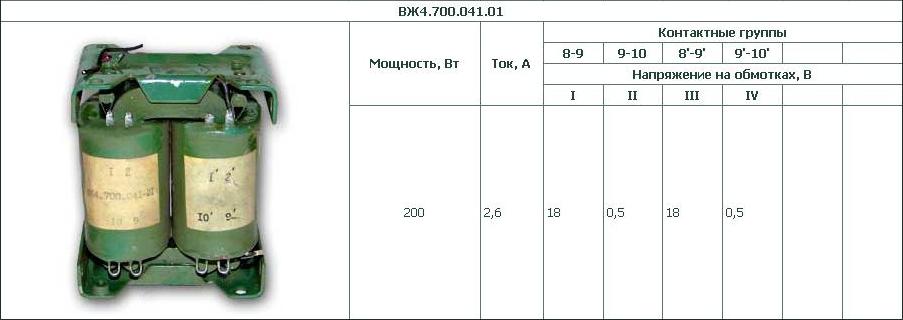 «Я провел так много времени в своей жизни, пытаясь стать меньше. Меньший голос, меньшее тело, меньше энергии — и это Урсула. Она чувствовала себя такой нелюбимой.
«Я провел так много времени в своей жизни, пытаясь стать меньше. Меньший голос, меньшее тело, меньше энергии — и это Урсула. Она чувствовала себя такой нелюбимой.
«Я девушка из Пасадены. В старшей школе я не играл в мюзиклах. Я едва был в хоре в старшем классе.Я официально не обучен. Я мама и медсестра. А я могу быть Урсулой.
Джои Герра
Джоуи Герра — музыкальный критик Houston Chronicle. Он также освещает различные аспекты поп-культуры. Он просмотрел сотни концертов и взял интервью у сотен знаменитостей, от Джастина Бибера до Долли Партон и Бейонсе. Он появился в качестве постоянного корреспондента на Fox26 и был главным судьей и директором вокального конкурса Pride Superstar в течение десяти лет.Журнал OutSmart Magazine и FACE Awards неоднократно называли его журналистом года. Он также освещает различные аспекты поп-культуры, в том числе местную дрэг-сцену и «Дрэг-рейс РуПола».
AGO-связанные зрелые микроРНК олигоуридилируются с помощью TUT и впоследствии расщепляются с помощью DIS3L2
Разрушение домена PAZ AGO способствует 3′-модификации микроРНК
Мы стремились проверить, достаточно ли смещения 3′-конца микроРНК от AGO для стимулирования 3′-модификаций. С этой целью мы создали мутант AGO2 (AGO2-F2L3), содержащий две точечные мутации в ядре кармана связывания домена PAZ: F294A и L339A 28 . Мы совместно экспрессировали FLAG-меченый AGO2-F2L3 в клетках HEK293T с miR-27a, miRNA, которая, как известно, регулируется TDMD во время вирусной инфекции 16 . Зрелая миР-27a, связанная с мутантом AGO2, была удалена с помощью иммунопреципитации и обнаружена с помощью нозерн-блоттинга. Результаты были специфичны для AGO, поскольку мы не обнаружили сигнала в нисходящем элементе управления GFP.Мы наблюдали сниженные уровни miR-27a, а также обширные isomiR с различной электрофоретической подвижностью в пулдаунах мутанта PAZ (AGO2-F2L3), но не в AGO2 дикого типа (AGO2-WT) или версии мутированного AGO2. в каталитическом центре (AGO2-D597A) (рис. 1а). Анализ глубокого секвенирования подтвердил, что РНК аберрантного размера состояли из миР-27a различной длины (дополнительная рис. 1a). Сопоставление прочтений с последовательностью генома показало, что эти изомиР miR-27a были результатом 3′-модификаций, состоящих из 3′-обрезки, образования хвоста или того и другого (рис.
С этой целью мы создали мутант AGO2 (AGO2-F2L3), содержащий две точечные мутации в ядре кармана связывания домена PAZ: F294A и L339A 28 . Мы совместно экспрессировали FLAG-меченый AGO2-F2L3 в клетках HEK293T с miR-27a, miRNA, которая, как известно, регулируется TDMD во время вирусной инфекции 16 . Зрелая миР-27a, связанная с мутантом AGO2, была удалена с помощью иммунопреципитации и обнаружена с помощью нозерн-блоттинга. Результаты были специфичны для AGO, поскольку мы не обнаружили сигнала в нисходящем элементе управления GFP.Мы наблюдали сниженные уровни miR-27a, а также обширные isomiR с различной электрофоретической подвижностью в пулдаунах мутанта PAZ (AGO2-F2L3), но не в AGO2 дикого типа (AGO2-WT) или версии мутированного AGO2. в каталитическом центре (AGO2-D597A) (рис. 1а). Анализ глубокого секвенирования подтвердил, что РНК аберрантного размера состояли из миР-27a различной длины (дополнительная рис. 1a). Сопоставление прочтений с последовательностью генома показало, что эти изомиР miR-27a были результатом 3′-модификаций, состоящих из 3′-обрезки, образования хвоста или того и другого (рис. 1б, дополнительный рис. 1б). В соответствии с предыдущими исследованиями 3′-модификаций миРНК 19,29,30 , нематричные нуклеотиды, добавленные к 3′-концу миР-27a, были в основном U или A (рис. 1b, дополнительная рис. 1b).
1б, дополнительный рис. 1б). В соответствии с предыдущими исследованиями 3′-модификаций миРНК 19,29,30 , нематричные нуклеотиды, добавленные к 3′-концу миР-27a, были в основном U или A (рис. 1b, дополнительная рис. 1b).
Рис. 1: Разрушение домена AGO PAZ способствует модификации 3′ микроРНК.
a Коэкспрессия конструкций pri-miR-27a и FLAG-AGO2: дикого типа (WT), PAZ-мутантного (F2L3) и срез-мертвого (D597A). Обнаружение miR-27a-3p во входном и FLAG-иммунопреципитате (ИП) методом нозерн-блоттинга. b Состав последовательности считываний миР-27a-3p, связанных с AGO2-WT и AGO2-F2L3, на IGV (программа просмотра интегративной геномики). c Совместная экспрессия конструкций FLAG-AGO2 и микроРНК с преимущественной загрузкой плеч 3p и 5p (миР-23a-3p, миР-1-3p, миР-122-5p и миР-15-5p). Обнаружение зрелой микроРНК во входном и FLAG-иммунопреципитате (ИП) методом нозерн-блоттинга. Исходные данные предоставляются в виде файла исходных данных.
Чтобы исключить возможность того, что эти 3′-модификации произошли на пре-миРНК и были унаследованы зрелыми микроРНК, мы повторили тот же эксперимент с синтетическим дуплексом микроРНК-27a, который загружается непосредственно в AGO2 (дополнительная рис.1с). Мы наблюдали обширный 3′-хвост и обрезку с направляющей нитью miR-27a, но не с пассажирской нитью (дополнительный рисунок 1d). Поскольку первое, но не второе, сохраняется в зрелом RISC (дополнительный рисунок 1c), этот результат указывает на то, что 3′-модификации произошли на зрелой миР-27a. Совместная экспрессия AGO2-F2L3 с двумя дополнительными миРНК 3p (миР-23a и миР-1) и двумя дополнительными миРНК 5p (миР-122 и миР-15) дала аналогичные результаты (рис. 1c). Поскольку 3′-конец микроРНК 5p недоступен в пре-миРНК (дополнительная рис.1c), эти результаты подтвердили, что мутация AGO PAZ способствует модификациям зрелых микроРНК, связанных с AGO. В соответствии с недавним отчетом 19 эти результаты показывают, что высвобождения 3′-конца из домена PAZ достаточно для индукции 3′-модификаций. Таким образом, мутанты AGO PAZ обеспечивают уникальную платформу для изучения 3′-модификаций miRNAs.
Таким образом, мутанты AGO PAZ обеспечивают уникальную платформу для изучения 3′-модификаций miRNAs.
Эндогенные миРНК с открытыми 3′-концами подвергаются модификации
Затем мы глубоко секвенировали эндогенные миРНК в выпадающих списках AGO2-WT или AGO2-F2L3.Мы наблюдали повышенную 3′-модификацию микроРНК, связанных с AGO2-F2L3, по сравнению с таковыми, связанными с AGO2-WT (рис. 2a), что позволяет предположить, что домен PAZ защищает 3′-конец связанных с AGO микроРНК от модификации. Учитывая, что это явление происходит почти для всех miRNAs, маловероятно, что лежащий в основе механизм специфичен для последовательности. МикроРНК 5p и микроРНК 3p имели одинаковую степень 3′-модификации (рис. 2b), что указывает на то, что большинство этих модификаций происходит на уровне зрелой микроРНК.Эти 3′-модификации в основном состояли из обрезки (рис. 2с, дополнительная рис. 2а). В результате более короткие isomiR были обогащены пулдаунами мутанта AGO2 PAZ (рис. 2d). Мы подтвердили эти наблюдения с помощью Нозерн-блоттинга трех распространенных эндогенных миРНК (миР-10b, миР-7 и миР-148a) (рис. 2e). По сравнению с результатами, полученными с сверхэкспрессированными миРНК (рис. 1), очевидное отсутствие 3′-хвоста свидетельствует о том, что хвостатые изомиР эндогенных миРНК эффективно удаляются в клетках.
2e). По сравнению с результатами, полученными с сверхэкспрессированными миРНК (рис. 1), очевидное отсутствие 3′-хвоста свидетельствует о том, что хвостатые изомиР эндогенных миРНК эффективно удаляются в клетках.
Рис. 2: Эндогенные микроРНК с открытыми 3′-концами подвергаются модификации.
a График процента изомиР ( y -ось) для эндогенной миРНК с наивысшей экспрессией ( x — ось, N = 116 миРНК), связанных с AGO2-WT и AGO2-F2L3. Критерий Уилкоксона для парных значений был использован для расчета значения p . b График процента isomiRs. Непарный критерий Стьюдента t использовали для сравнения эндогенных микроРНК, связанных с AGO2-WT, и микроРНК, связанных с AGO2-F2L3 (среднее ± SEM, N 5p-плечо = 76 miRNAs, N 90) 40 микроРНК). c График процента усеченных прочтений в эндогенной миРНК (среднее ± SEM, N = 100 миРНК). d Гистограмма распределения длины эндогенной микроРНК, связанной с AGO2-WT и AGO2-F2L3.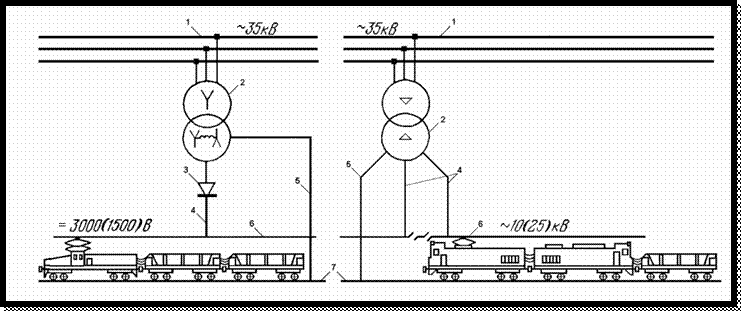 e Обнаружение эндогенной зрелой миРНК во входном и FLAG-иммунопреципитате (IP) с помощью нозерн-блоттинга. f График процента изомиР для эндогенной миРНК с наивысшей экспрессией ( N = 85) в образцах TCGA с синонимичной (51 пациент), миссенс-мутацией (81 пациент) и мутацией P295L на AGO2.Критерий Уилкоксона для парных значений (двусторонний) был использован для расчета p значений. Исходные данные предоставляются в виде файла исходных данных.
e Обнаружение эндогенной зрелой миРНК во входном и FLAG-иммунопреципитате (IP) с помощью нозерн-блоттинга. f График процента изомиР для эндогенной миРНК с наивысшей экспрессией ( N = 85) в образцах TCGA с синонимичной (51 пациент), миссенс-мутацией (81 пациент) и мутацией P295L на AGO2.Критерий Уилкоксона для парных значений (двусторонний) был использован для расчета p значений. Исходные данные предоставляются в виде файла исходных данных.
Чтобы расширить наш вывод за пределы культивируемых клеток и искусственно введенных мутаций AGO2 PAZ, мы воспользовались наборами данных, депонированными в Атласе генома рака (TCGA), где задокументированы различные мутации в AGO и доступны соответствующие данные секвенирования микроРНК. 3′-модификации миРНК были более распространены у пациентов с мутацией AGO2 в кармане связывания PAZ 3′ (P295L), чем у пациентов с синонимичными или миссенс-мутациями AGO2 в других областях AGO2 (рис.2f, дополнительный рис. 2b). Аналогичный результат был получен у пациента с другой мутацией AGO2 в 3′-связывающем кармане PAZ (R315M) (дополнительная рис. 2b, c), но не у пациента с мутацией снаружи (E299K) (дополнительная рис. 2b, d). ), что указывает на то, что увеличение 3′-модификаций специфично для дислокации 3′-конца микроРНК. Мутация в 3′-связывающем кармане AGO1 (F310L) привела к аналогичному результату (дополнительная рис. 2e, f), демонстрируя, что 3′-модификации не ограничиваются AGO2-связанными микроРНК.Взятые вместе, наши результаты предполагают наличие клеточного механизма, наблюдающего за 3′-концом AGO-связанных микроРНК. После экспонирования 3′-концы микроРНК подвергаются обширным модификациям последовательности.
Аналогичный результат был получен у пациента с другой мутацией AGO2 в 3′-связывающем кармане PAZ (R315M) (дополнительная рис. 2b, c), но не у пациента с мутацией снаружи (E299K) (дополнительная рис. 2b, d). ), что указывает на то, что увеличение 3′-модификаций специфично для дислокации 3′-конца микроРНК. Мутация в 3′-связывающем кармане AGO1 (F310L) привела к аналогичному результату (дополнительная рис. 2e, f), демонстрируя, что 3′-модификации не ограничиваются AGO2-связанными микроРНК.Взятые вместе, наши результаты предполагают наличие клеточного механизма, наблюдающего за 3′-концом AGO-связанных микроРНК. После экспонирования 3′-концы микроРНК подвергаются обширным модификациям последовательности.
TUT4 и TUT7 олигоуридилируют 3′-конец зрелых микроРНК
Используя преимущество мутанта AGO PAZ, мы стремились идентифицировать ферменты, ответственные за формирование хвостов зрелых микроРНК. Чтобы облегчить обнаружение хвостовых продуктов, мы создали укороченную форму AGO2 с полной делецией домена PAZ (AGO2-ΔPAZ). Мы пришли к выводу, что AGO2-ΔPAZ сделает 3′-конец микроРНК полностью открытым и, следовательно, повысит устойчивость хвоста. Действительно, мы наблюдали обширный хвост с помощью нозерн-блоттинга, когда miR-27a коэкспрессировалась с AGO2-ΔPAZ. Мы обнаружили лестницу полос размером около 25–40 нт, используя зонд против зрелой последовательности miR-27a (рис. 3a), но не зонды против пассажирской нити miR-27a или последовательности петли (дополнительный рис. 3a), подтверждая, что эти полосы были зрелыми miR-27a с длинными хвостами.
Мы пришли к выводу, что AGO2-ΔPAZ сделает 3′-конец микроРНК полностью открытым и, следовательно, повысит устойчивость хвоста. Действительно, мы наблюдали обширный хвост с помощью нозерн-блоттинга, когда miR-27a коэкспрессировалась с AGO2-ΔPAZ. Мы обнаружили лестницу полос размером около 25–40 нт, используя зонд против зрелой последовательности miR-27a (рис. 3a), но не зонды против пассажирской нити miR-27a или последовательности петли (дополнительный рис. 3a), подтверждая, что эти полосы были зрелыми miR-27a с длинными хвостами.
Рис. 3: TUT4 и TUT7 олигоуридилируют 3′-конец зрелых микроРНК.
a Коэкспрессия конструкций pri-miR-27a и FLAG-AGO2: дикий тип (WT) и делеция домена PAZ (ΔPAZ). Обнаружение miR-27a-3p во входном и FLAG-иммунопреципитате (ИП) методом нозерн-блоттинга. b Нуклеотидный состав олигохвоста miR-27a-3p. Горизонтальная ось указывает абсолютное количество нематричных нуклеотидов U в хвосте, а вертикальная ось указывает кумулятивный процент от самого длинного до самого короткого олигохвоста. c , d Коэкспрессия pri-miR-27a и AGO2-ΔPAZ ( c ) или AGO2-F2L3 ( d ) в HEK293T дикого типа или TUT4/7 DKO и TUT4/7 DKO клетки, спасенные с помощью GFP, TUT4, TUT7 или TUT4 и TUT7. Обнаружение миР-27a-3p с помощью нозерн-блоттинга. Исходные данные предоставляются в виде файла исходных данных.
c , d Коэкспрессия pri-miR-27a и AGO2-ΔPAZ ( c ) или AGO2-F2L3 ( d ) в HEK293T дикого типа или TUT4/7 DKO и TUT4/7 DKO клетки, спасенные с помощью GFP, TUT4, TUT7 или TUT4 и TUT7. Обнаружение миР-27a-3p с помощью нозерн-блоттинга. Исходные данные предоставляются в виде файла исходных данных.
Чтобы дополнительно охарактеризовать эти хвостовые продукты, мы провели глубокое секвенирование малых РНК в выпадающих списках AGO2-ΔPAZ. Несмотря на все усилия, нам не удалось клонировать длиннохвостые isomiR обычными методами.Поэтому мы увеличили время инкубации лигирования 3′-адаптера во время подготовки библиотеки (подробности см. в разделе «Методы»). Эта процедура, которая позволила обнаружить isomiRs с длинными хвостами, также привела к неспецифическим лигированиям между miR-27a и различными фрагментами РНК в клетках, что привело к высокому фону неспецифических последовательностей хвостов. Чтобы отличить изомиР с хвостами от шума, мы сравнили результаты секвенирования AGO2-ΔPAZ-IP с результатами AGO2-WT-IP, где изомиР с длинным хвостом отсутствовали в нозерн-блотах (рис. 3а). Мы пришли к выводу, что хвостовые последовательности, обнаруженные в AGO2-WT-IP, представляют собой фон, тогда как последовательности, обогащенные AGO2-ΔPAZ-IP, происходят из аутентичных хвостов miR-27a. Используя этот метод, мы обнаружили, что U и, в гораздо меньшей степени, A, но не G или C, были обогащены олигохвостами miR-27a (рис. 3b, дополнительная рис. 3b). Тот же эксперимент и анализ, проведенные с miR-134-5p, дали аналогичный результат (дополнительный рисунок 3c), что указывает на то, что изомиР с длинным хвостом в значительной степени являются результатом олигоуридилирования.
3а). Мы пришли к выводу, что хвостовые последовательности, обнаруженные в AGO2-WT-IP, представляют собой фон, тогда как последовательности, обогащенные AGO2-ΔPAZ-IP, происходят из аутентичных хвостов miR-27a. Используя этот метод, мы обнаружили, что U и, в гораздо меньшей степени, A, но не G или C, были обогащены олигохвостами miR-27a (рис. 3b, дополнительная рис. 3b). Тот же эксперимент и анализ, проведенные с miR-134-5p, дали аналогичный результат (дополнительный рисунок 3c), что указывает на то, что изомиР с длинным хвостом в значительной степени являются результатом олигоуридилирования.
TUT4 и TUT7 олигоуридилируют набор пре-миРНК для регуляции их биогенеза 31,32,33 . Мы и др. также показали, что TUT4 и TUT7 могут уридилировать зрелые микроРНК in vitro и in vivo 34,35 . Воспользовавшись ранее установленным двойным нокаутом TUT4 и TUT7 (TUT4/7 DKO) клеточной линии HEK293T 35 , мы проверили, являются ли TUT4 и TUT7 ферментами, ответственными за надежное олигоуридилирование AGO-связанных микроРНК с открытым 3′-концом. Накопление длиннохвостых изомиР миР-27a в результате коэкспрессии AGO2-ΔPAZ устранялось в клетках TUT4/7 DKO (рис.3c «Переулок GFP»). Это было спасено за счет эктопической экспрессии либо TUT4, либо TUT7 (рис. 3c). Олиго-хвост миР-27a, полученный в результате совместной экспрессии AGO2-F2L3, хотя и менее надежный, чем хвост, полученный в результате совместной экспрессии AGO2-ΔPAZ, подвергался воздействию TUT4 и TUT7 аналогичным образом (рис. 3d). Тот же эксперимент, проведенный с miR-23a, дал аналогичный результат (дополнительный рисунок 3d). Вместе эти результаты показывают, что TUT4 и TUT7 являются основными ферментами, олигоуридилирующими AGO-связанные miRNAs, как только их 3′-концы подвергаются воздействию.
Накопление длиннохвостых изомиР миР-27a в результате коэкспрессии AGO2-ΔPAZ устранялось в клетках TUT4/7 DKO (рис.3c «Переулок GFP»). Это было спасено за счет эктопической экспрессии либо TUT4, либо TUT7 (рис. 3c). Олиго-хвост миР-27a, полученный в результате совместной экспрессии AGO2-F2L3, хотя и менее надежный, чем хвост, полученный в результате совместной экспрессии AGO2-ΔPAZ, подвергался воздействию TUT4 и TUT7 аналогичным образом (рис. 3d). Тот же эксперимент, проведенный с miR-23a, дал аналогичный результат (дополнительный рисунок 3d). Вместе эти результаты показывают, что TUT4 и TUT7 являются основными ферментами, олигоуридилирующими AGO-связанные miRNAs, как только их 3′-концы подвергаются воздействию.
TUT7 связывается с белками Argonaute
Несмотря на то, что экспрессия TUT4 или TUT7 восстанавливала олигоуридилирование микроРНК в клетках TUT4/7 DKO, хвосты, опосредованные TUT7, были значительно длиннее (рис. 3c, d, дополнительная рис. 3d), что позволяет предположить, что TUT7 является более надежный.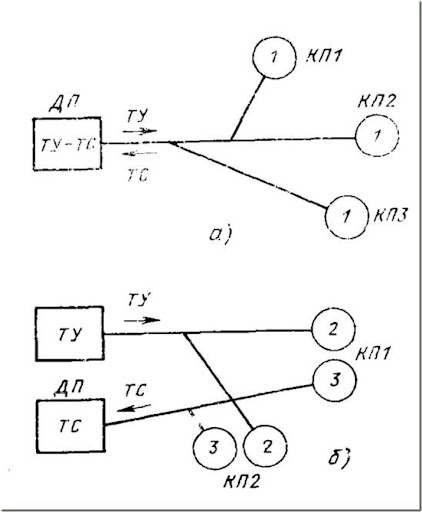 Чтобы проверить это, мы отключили TUT4 и TUT7 по отдельности в клетках HEK293T, подтвердив потерю их экспрессии с помощью вестерн-блоттинга (дополнительная рис. 4a). В то время как нокаут TUT7 уменьшал количество длинных хвостов миР-27a, связанных с AGO2-ΔPAZ, истощение TUT4 оказывало незначительное влияние на олигоуридилирование миР-27a (фиг.4а). Мы наблюдали аналогичную картину с хвостами, индуцированными AGO2-F2L3 (дополнительная рис. 4b), а также олигоуридилирование миР-23a (дополнительная рис. 4c), демонстрируя, что TUT7 более устойчив, чем TUT4, в олигоуридилирующих миРНК с открытым 3′-концом. .
Чтобы проверить это, мы отключили TUT4 и TUT7 по отдельности в клетках HEK293T, подтвердив потерю их экспрессии с помощью вестерн-блоттинга (дополнительная рис. 4a). В то время как нокаут TUT7 уменьшал количество длинных хвостов миР-27a, связанных с AGO2-ΔPAZ, истощение TUT4 оказывало незначительное влияние на олигоуридилирование миР-27a (фиг.4а). Мы наблюдали аналогичную картину с хвостами, индуцированными AGO2-F2L3 (дополнительная рис. 4b), а также олигоуридилирование миР-23a (дополнительная рис. 4c), демонстрируя, что TUT7 более устойчив, чем TUT4, в олигоуридилирующих миРНК с открытым 3′-концом. .
Рис. 4: TUT7 ассоциирует с белками Argonaute.
a Коэкспрессия pri-miR-27a и AGO2-ΔPAZ в клетках дикого типа, TUT4 KO и TUT7 KO со спасением или без него. Обнаружение миР-27a-3p с помощью нозерн-блоттинга. Клетки b HEK293T трансфицировали GFP, AGO2-WT, AGO2-F2L3 или AGO2-ΔPAZ.GFP или AGO2 с меткой FLAG подвергали иммунопреципитации (IP) в присутствии или в отсутствие РНКаз A/T1. Обнаружение TUT4, TUT7 и AGO2 методом вестерн-блоттинга во входном и FLAG-иммунопреципитате. c Эндогенный TUT4 или TUT7 подвергали иммунопреципитации специфическими антителами из клеток HEK293T в присутствии или в отсутствие РНКаз. Обнаружение AGO1, AGO2, TUT4 и TUT7 методом вестерн-блоттинга во вводимом и иммунопреципитате. Исходные данные предоставляются в виде файла исходных данных.
Обнаружение TUT4, TUT7 и AGO2 методом вестерн-блоттинга во входном и FLAG-иммунопреципитате. c Эндогенный TUT4 или TUT7 подвергали иммунопреципитации специфическими антителами из клеток HEK293T в присутствии или в отсутствие РНКаз. Обнаружение AGO1, AGO2, TUT4 и TUT7 методом вестерн-блоттинга во вводимом и иммунопреципитате. Исходные данные предоставляются в виде файла исходных данных.
TUT4 и TUT7 обладают сходной активностью в отношении уридилирования «голой» миРНК in vitro 34 .Также известно, что их олигоуридилирующая активность увеличивается, когда ферменты прикрепляются к субстрату pre-let-7 через мостиковый белок LIN28 36,37 . Поэтому мы предположили, что наблюдаемая превосходная олигоуридилирующая активность TUT7 связана с его более сильной связью с RISC. Действительно, мы обнаружили эндогенный TUT7, но не TUT4 в пулдаунах иммунопреципитации меченых FLAG AGO2-WT, AGO2-F2L3 и AGO2-ΔPAZ, но не в пулдаунах FLAG-GFP с обработкой РНКазой или без нее (рис.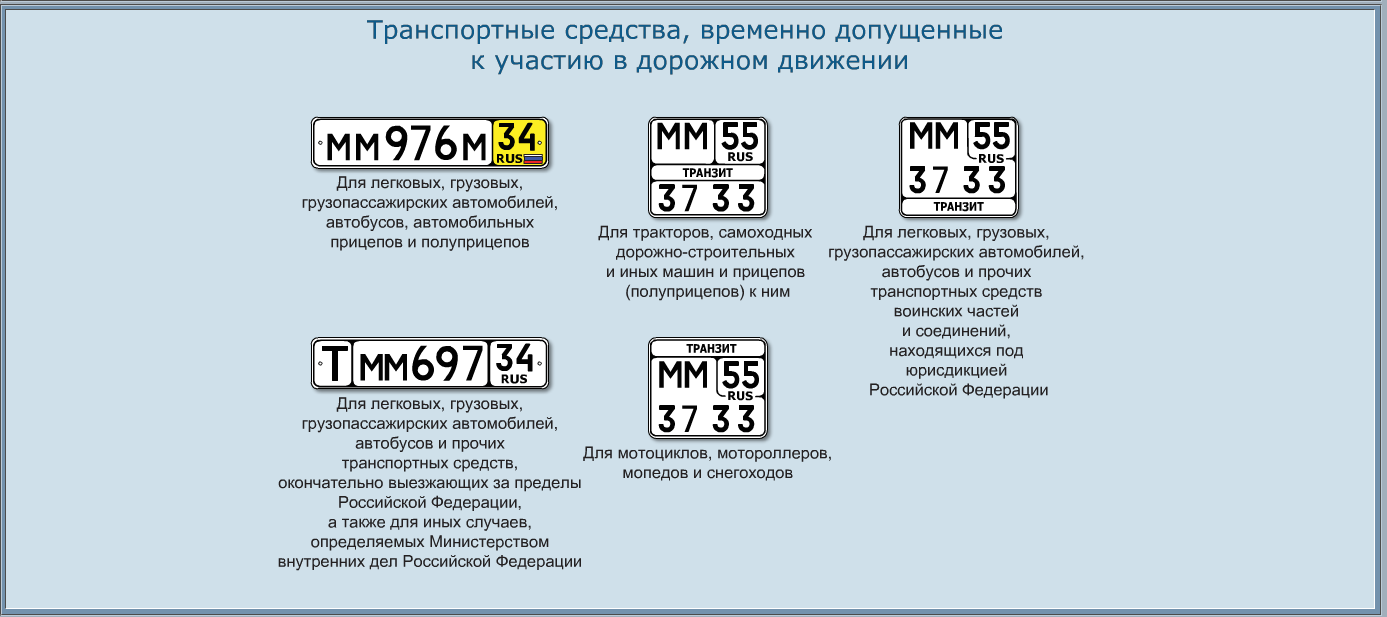 .4b), что указывает на то, что TUT7 взаимодействует с AGO2 РНК-независимым образом. Чтобы подтвердить, что наблюдаемое взаимодействие не было связано со сверхэкспрессией AGO2, мы провели анализ обратной коиммунопреципитации в клетках HEK392T без эктопической экспрессии ни AGO, ни TUT. Подтверждая наш вывод, AGO1 и AGO2 были обнаружены в выпадающих списках TUT7, но не в TUT4 (рис. 4c). Однако, учитывая ограничения чувствительности нашего анализа, мы не можем исключить возможность того, что TUT4 также взаимодействует с AGO в клетках.Только небольшая часть TUT7 и AGO2 находилась в комплексе друг с другом (рис. 4b, c), что ожидается, поскольку TUT7 нацелен на многие другие РНК 22 , и только те микроРНК, связанные с AGO2, с доступными 3′-концами являются мишенями TUT7.
.4b), что указывает на то, что TUT7 взаимодействует с AGO2 РНК-независимым образом. Чтобы подтвердить, что наблюдаемое взаимодействие не было связано со сверхэкспрессией AGO2, мы провели анализ обратной коиммунопреципитации в клетках HEK392T без эктопической экспрессии ни AGO, ни TUT. Подтверждая наш вывод, AGO1 и AGO2 были обнаружены в выпадающих списках TUT7, но не в TUT4 (рис. 4c). Однако, учитывая ограничения чувствительности нашего анализа, мы не можем исключить возможность того, что TUT4 также взаимодействует с AGO в клетках.Только небольшая часть TUT7 и AGO2 находилась в комплексе друг с другом (рис. 4b, c), что ожидается, поскольку TUT7 нацелен на многие другие РНК 22 , и только те микроРНК, связанные с AGO2, с доступными 3′-концами являются мишенями TUT7.
DIS3L2 расщепляет олигоуридилированные зрелые микроРНК
DIS3L2 удаляет пре-миРНК, олигоуридилированные TUT4 и TUT7 38 . Чтобы проверить, играет ли DIS3L2 аналогичную роль в деградации олигоуридилированных зрелых миРНК, мы создали клеточную линию HEK293T DIS3L2 KO с использованием CRISPR-Cas9 и подтвердили потерю экспрессии DIS3L2 с помощью вестерн-блоттинга (дополнительная рис. 5а). При совместной экспрессии miR-27a с AGO2-ΔPAZ в этих клетках накапливались олигоуридилированные формы miR-27a, которые были увеличены по длине и интенсивности по сравнению с клетками WT (рис. 5a). ИзомиР миР-27a с длинными хвостами, которые отсутствовали при совместной экспрессии с AGO2-F2L3 в клетках WT, стали обнаруживаться в клетках DIS3L2-KO (рис. 5a). Анализ глубокого секвенирования подтвердил, что длинные хвосты миР-27a, которые накапливаются при истощении DIS3L2, были вызваны олигоуридилированием (рис. 5b, дополнительная рис. 5b). Вместе эти результаты убедительно свидетельствуют о том, что олигоуридилированная miR-27a была нацелена на деградацию DIS3L2.ИзомиР миР-27a с длинными хвостами отсутствовали как в клетках WT, так и в клетках DIS3L2-KO, когда миР-27a коэкспрессировалась с AGO2-WT (рис. 5a, b, дополнительная рис. 5b), подтверждая, что открытый 3′-конец необходим для олигоуридилирования микроРНК. Те же эксперименты, проведенные с миР-23a-3p и миР-134-5p, дали аналогичные результаты (дополнительная рис.
5а). При совместной экспрессии miR-27a с AGO2-ΔPAZ в этих клетках накапливались олигоуридилированные формы miR-27a, которые были увеличены по длине и интенсивности по сравнению с клетками WT (рис. 5a). ИзомиР миР-27a с длинными хвостами, которые отсутствовали при совместной экспрессии с AGO2-F2L3 в клетках WT, стали обнаруживаться в клетках DIS3L2-KO (рис. 5a). Анализ глубокого секвенирования подтвердил, что длинные хвосты миР-27a, которые накапливаются при истощении DIS3L2, были вызваны олигоуридилированием (рис. 5b, дополнительная рис. 5b). Вместе эти результаты убедительно свидетельствуют о том, что олигоуридилированная miR-27a была нацелена на деградацию DIS3L2.ИзомиР миР-27a с длинными хвостами отсутствовали как в клетках WT, так и в клетках DIS3L2-KO, когда миР-27a коэкспрессировалась с AGO2-WT (рис. 5a, b, дополнительная рис. 5b), подтверждая, что открытый 3′-конец необходим для олигоуридилирования микроРНК. Те же эксперименты, проведенные с миР-23a-3p и миР-134-5p, дали аналогичные результаты (дополнительная рис. 5c, d), что позволяет предположить, что DIS3L2 разрушает олигоуридилированные зрелые миРНК независимо от их последовательности.
5c, d), что позволяет предположить, что DIS3L2 разрушает олигоуридилированные зрелые миРНК независимо от их последовательности.
Рис. 5: DIS3L2 разрушает олигоуридилированные зрелые микроРНК.
a Коэкспрессия конструкций pri-miR-27a и FLAG-AGO2 (WT, F2L3 и ΔPAZ) на фоне HEK293T дикого типа и DIS3L2 KO. Обнаружение miR-27a-3p во входном и FLAG-иммунопреципитате (ИП) методом нозерн-блоттинга. b Состав олиго-хвоста miR-27a-3p, количество нуклеотидов U в хвосте (ось x ) и кумулятивный процент (ось y ), сравнение конструкций AGO2 (WT, F2L3 и ΔPAZ) в фоны дикого типа и DIS3L2 KO. c Совместная экспрессия pri-miR-27a, AGO2-ΔPAZ и каталитически мертвого мутанта mock или DIS3L2 (DIS3L2-CD-mut) в одиночных и двойных клетках KO TUT4 и TUT7. d Состав олиго-хвоста miR-27a-3p, количество нуклеотидов U в хвосте (ось x ) и кумулятивный процент (ось y ), сравнение защиты U-хвоста DIS3L2-CD-mut в TUT7 Ячейки КО и ТУТ4/7 ДКО. e Средневзвешенное количество нуклеотидов олиго-U-хвоста, добавленных к эндогенной миРНК, загруженной в AGO2 (WT, F2L3 и ΔPAZ) на фоне нокаутов дикого типа и DIS3L2 (среднее ± SEM, N = 100 миРНК). Критерий Уилкоксона для парных значений (двусторонний) был использован для расчета p значений.Исходные данные предоставляются в виде файла исходных данных.
e Средневзвешенное количество нуклеотидов олиго-U-хвоста, добавленных к эндогенной миРНК, загруженной в AGO2 (WT, F2L3 и ΔPAZ) на фоне нокаутов дикого типа и DIS3L2 (среднее ± SEM, N = 100 миРНК). Критерий Уилкоксона для парных значений (двусторонний) был использован для расчета p значений.Исходные данные предоставляются в виде файла исходных данных.
Учитывая, что DIS3L2 постоянно удаляет олигоуридилированные микроРНК в клетках, мы пересмотрели характеристики хвостовых ферментов микроРНК без вмешательства DIS3L2. Чтобы избежать нокаута DIS3L2 в различных клеточных линиях TUT KO, мы подавляли активность DIS3L2 путем коэкспрессии его каталитически мертвого мутанта (DIS3L2-CD-mut), который функционирует доминантно-негативным образом 39,40 . Ингибирование DIS3L2 привело к обнаружению длинных U-хвостов на miR-27a в клетках TUT7 KO (фиг.5c, d, дополнительный рисунок 5e), что указывает на то, что ферменты, отличные от TUT7, способствуют олигоуридилированию микроРНК. Дальнейшее истощение TUT4 (по сравнению с TUT7 KO с TUT4/7 DKO) уменьшало олигоуридилирование (рис. 5c, d, дополнительный рис. 5e), демонстрируя вклад TUT4. Тот факт, что олигоуридилированные изомиР миР-27a все еще обнаруживались в клетках TUT4/7 DKO, предполагает, что дополнительные ферменты могут осуществлять олигоуридилирование (рис. 5c), демонстрируя обширную избыточность ферментов, которые связывают AGO-связанные миРНК в клетках.Эти выводы были дополнительно подтверждены экспериментами, проведенными с AGO2-F2L3 (дополнительный рисунок 5f) и miR-23a (дополнительный рисунок 5g).
Дальнейшее истощение TUT4 (по сравнению с TUT7 KO с TUT4/7 DKO) уменьшало олигоуридилирование (рис. 5c, d, дополнительный рис. 5e), демонстрируя вклад TUT4. Тот факт, что олигоуридилированные изомиР миР-27a все еще обнаруживались в клетках TUT4/7 DKO, предполагает, что дополнительные ферменты могут осуществлять олигоуридилирование (рис. 5c), демонстрируя обширную избыточность ферментов, которые связывают AGO-связанные миРНК в клетках.Эти выводы были дополнительно подтверждены экспериментами, проведенными с AGO2-F2L3 (дополнительный рисунок 5f) и miR-23a (дополнительный рисунок 5g).
Чтобы проверить, удаляет ли DIS3L2 олигоуридилированные эндогенные микроРНК, мы трансфицировали AGO2-WT, AGO2-F2L3 и AGO2-ΔPAZ в клетки дикого типа или соответствующие клетки DIS3L2 KO, а затем провели иммунопреципитацию. Мы проанализировали эндогенные микроРНК в выпадающих списках с помощью глубокого секвенирования. В соответствии с идеей о том, что 3′-концы миРНК защищены AGO2-WT и становятся доступными при ассоциации с мутантами AGO2 PAZ, мы наблюдали накопление олиго-U-хвостов у последних, но не у первых, при истощении DIS3L2. (Инжир.5e, дополнительный рис. 5h). Вместе эти результаты подтверждают модель, в которой AGO-связанные miRNAs с открытым 3′-концом олигоуридилируются и впоследствии удаляются с помощью DIS3L2.
(Инжир.5e, дополнительный рис. 5h). Вместе эти результаты подтверждают модель, в которой AGO-связанные miRNAs с открытым 3′-концом олигоуридилируются и впоследствии удаляются с помощью DIS3L2.
Избыточный распад микроРНК за счет независимой от хвоста обрезки 3′
Отмена олигоуридилирования путем истощения TUT4 и TUT7 привела к усилению обрезки (рис. 3c, d, дополнительная рис. 3d). В соответствии с идеей о том, что TUT7 более надежен в отношении хвостовиков зрелых микроРНК, нокаутирования TUT7 самого по себе было достаточно, чтобы вызвать накопление обрезанных isomiR (рис.4a, дополнительный рисунок 4c), и это было спасено экспрессией TUT7 (рис. 3c, d, дополнительный рисунок 3c, d). Эти результаты указывают на то, что хвостовые ферменты конкурируют с триммерным(и) ферментом(ами) за доступ к 3′-концу miRNAs. Истощение DIS3L2 или ингибирование активности DIS3L2 не повлияло на интенсивность этих урезанных isomiR (рис. 5а, дополнительная рис. 5f, g). Эти результаты показывают, что процесс обрезки, вероятно, не зависит от DIS3L2, что согласуется с наблюдением, что DIS3L2 предпочитает олигоуридилированные субстраты 38,41 . Блокирование олигоуридилирования оказало незначительное влияние на уровень микроРНК без 3′-модификаций [см. интенсивность полос микроРНК канонического размера (рис. 3c и 4a, дополнительные рисунки 3d и 4b, c)], подтверждая модель, в которой 3′-олигоуридилирование и 3′-обрезка выполняет избыточную функцию для деградации AGO-связанных miRNAs.
Блокирование олигоуридилирования оказало незначительное влияние на уровень микроРНК без 3′-модификаций [см. интенсивность полос микроРНК канонического размера (рис. 3c и 4a, дополнительные рисунки 3d и 4b, c)], подтверждая модель, в которой 3′-олигоуридилирование и 3′-обрезка выполняет избыточную функцию для деградации AGO-связанных miRNAs.
Затем мы глубоко секвенировали эндогенные микроРНК, связанные с мутантами AGO PAZ в клетках дикого типа и TUT4/7 DKO. Хотя блокирование TUT4 и TUT7 нарушало олигоуридилирование, оно не оказывало заметного влияния на общее олиго-хвост (уридилирование и аденилирование) эндогенных миРНК (дополнительная рис.5i), отчасти из-за того, что DIS3L2 постоянно удаляет олигоуридилированные микроРНК. Это также демонстрирует избыточный вклад других хвостовых ферментов. Тем не менее, отключение TUT4 и TUT7 привело к незначительному увеличению 3′-обрезки (дополнительная рис. 5j). В совокупности эти результаты указывают на то, что, помимо механизма TUT-DIS3L2, независимый от хвоста процесс обрезки функционирует избыточно при деградации AGO-связанных зрелых miRNAs с 3′-конца.
TUT-DIS3L2 участвует, но не требуется для TDMD
Чтобы идентифицировать эндогенные микроРНК, на которые нацелен механизм TUT-DIS3L2, мы секвенировали микроРНК в клетках дикого типа и DIS3L2 KO и сравнили состав хвоста для каждой микроРНК.После истощения DIS3L2 среднее количество U в хвостах увеличилось, среди прочего, для miR-7-5p, miR-222-3p и miR-769-5p (рис. 6a). Дальнейшие анализы подтвердили, что накапливались только олиго-U-хвосты и, в гораздо меньшей степени, олиго-A-хвосты (рис. 6b, дополнительная рис. 6a). Нокаутирование TUT4 и TUT7 оказало незначительное влияние на олигоуридилирование миР-222-3p и миР-769-5p и не оказало заметного влияния на миР-7-5p (рис. 6b), предполагая, что большинство изомиР олигоуридилировано TUT4 и TUT7 отсутствуют в клетках дикого типа, предположительно удалены DIS3L2.Эти результаты были подтверждены Нозерн-блоттингом. Обширные хвостовые изомиРы эндогенных миР-7-5p, миР-222-3p и миР-769-5p накапливались в клетках DIS3L2 KO (рис. 6c). Как и ожидалось, нокаутирование TUT4 и TUT7 вместе с нокаутом DIS3L2 отменяло обширные изомиР с хвостами (рис. 6c), подтверждая, что TUT4 и TUT7 являются основными ферментами, уридилирующими зрелые микроРНК. В качестве контроля miR-21-5p не приобретала U-хвосты при истощении DIS3L2 (рис. 6a, c). Вместе эти результаты подтверждают модель, в которой большинство эндогенных миРНК имеют свои 3′-концы, защищенные AGO, тогда как подмножество миРНК, включая миР-7-5p, миР-222-3p и миР-769-5p, имеют свои 3′-концы. ‘ концы открыты и являются мишенью для механизма TUT-DIS3L2.
Как и ожидалось, нокаутирование TUT4 и TUT7 вместе с нокаутом DIS3L2 отменяло обширные изомиР с хвостами (рис. 6c), подтверждая, что TUT4 и TUT7 являются основными ферментами, уридилирующими зрелые микроРНК. В качестве контроля miR-21-5p не приобретала U-хвосты при истощении DIS3L2 (рис. 6a, c). Вместе эти результаты подтверждают модель, в которой большинство эндогенных миРНК имеют свои 3′-концы, защищенные AGO, тогда как подмножество миРНК, включая миР-7-5p, миР-222-3p и миР-769-5p, имеют свои 3′-концы. ‘ концы открыты и являются мишенью для механизма TUT-DIS3L2.
Рис. 6: TUT-DIS3L2 участвует, но не требуется для TDMD.
a График рассеяния U-показателя (изменение среднего количества олиго-U между DIS3L2 KO и клетками дикого типа, по оси y ) и экспрессии эндогенной миРНК (количеств на миллион, x — ось). Синим цветом выделены миР-7-5p, миР-222-3p, миР-769-5p и миР-21-5p (контрольная миРНК). b Сравнение состава олиго-хвоста (количество U или A в хвосте, ось x ) и кумулятивного процента (ось y ) miR-7-5p, miR-222-3p и миР-769-5p в клетках дикого типа, TUT4/7 DKO и DIS3L2 KO. c Обнаружение хвоста эндогенных миР-7-5p, миР-222-3p и миР-769-5p у дикого типа, TUT4/7 DKO, DIS3L2 KO и TUT4/7/DIS3L2 Triple KO (TKO) по нозерн-блоту. миР-21-5p также была обнаружена в качестве контроля. d Нозерн-блоттинг, выявляющий эндогенные miR-7-5p и miR-21-5p (контрольная miRNA) в клетках HEK293T при нокдауне или сверхэкспрессии CYRANO с помощью siRNA (две независимые последовательности) или плазмид с сайтом связывания miR-7 (CYRANO) или мутантный сайт (CYRANO-mut). e Нозерн-блоттинг, выявляющий эндогенные миР-7-5p и миР-21-5p (контрольная миРНК) в клетках дикого типа, TUT4/7 DKO и DIS3L2 KO, трансфицированных плазмидами, экспрессирующими CYRANO или CYRANO-mut.Исходные данные предоставляются в виде файла исходных данных.
c Обнаружение хвоста эндогенных миР-7-5p, миР-222-3p и миР-769-5p у дикого типа, TUT4/7 DKO, DIS3L2 KO и TUT4/7/DIS3L2 Triple KO (TKO) по нозерн-блоту. миР-21-5p также была обнаружена в качестве контроля. d Нозерн-блоттинг, выявляющий эндогенные miR-7-5p и miR-21-5p (контрольная miRNA) в клетках HEK293T при нокдауне или сверхэкспрессии CYRANO с помощью siRNA (две независимые последовательности) или плазмид с сайтом связывания miR-7 (CYRANO) или мутантный сайт (CYRANO-mut). e Нозерн-блоттинг, выявляющий эндогенные миР-7-5p и миР-21-5p (контрольная миРНК) в клетках дикого типа, TUT4/7 DKO и DIS3L2 KO, трансфицированных плазмидами, экспрессирующими CYRANO или CYRANO-mut.Исходные данные предоставляются в виде файла исходных данных.
Возможно, что миР-7-5p, миР-222-3p и миР-769-5p имеют открытые 3′-концы, поскольку они находятся под активной регуляцией TDMD в клетках HEK293T. Чтобы проверить это, мы стремились идентифицировать потенциальные эндогенные триггеры TDMD. Эти триггеры должны быть относительно многочисленными транскриптами, которые содержат сайты-мишени с потенциалом экстенсивного спаривания оснований с соответствующими miRNA 42 . Мы использовали рассчитанную энергию связывания между миРНК и ее предполагаемым сайтом-мишенью (семенной парой) в качестве индикатора степени спаривания оснований и измерили уровень экспрессии эндогенных транскриптов с помощью РНК-сек.Анализ миР-7-5p идентифицировал известный триггер TDMD — днРНК CYRANO 17 (дополнительная рис. 6b), подтверждая этот подход. В то время как многие потенциальные триггеры TDMD были идентифицированы для miR-222-3p и miR-769-5p, лишь немногие были обнаружены для других высокоэкспрессируемых микроРНК, таких как miR-21-5p, miR-10a-5p и miR-148a-3p (дополнительный Рис. 6б). Это может объяснить, почему miR-7-5p, miR-222-3p и miR-769-5p были нацелены на механизм TUT-DIS3L2 в клетках HEK293T. В соответствии с этой идеей, нокдаун CYRANO с помощью двух независимых миРНК (дополнительный рис.
Эти триггеры должны быть относительно многочисленными транскриптами, которые содержат сайты-мишени с потенциалом экстенсивного спаривания оснований с соответствующими miRNA 42 . Мы использовали рассчитанную энергию связывания между миРНК и ее предполагаемым сайтом-мишенью (семенной парой) в качестве индикатора степени спаривания оснований и измерили уровень экспрессии эндогенных транскриптов с помощью РНК-сек.Анализ миР-7-5p идентифицировал известный триггер TDMD — днРНК CYRANO 17 (дополнительная рис. 6b), подтверждая этот подход. В то время как многие потенциальные триггеры TDMD были идентифицированы для miR-222-3p и miR-769-5p, лишь немногие были обнаружены для других высокоэкспрессируемых микроРНК, таких как miR-21-5p, miR-10a-5p и miR-148a-3p (дополнительный Рис. 6б). Это может объяснить, почему miR-7-5p, miR-222-3p и miR-769-5p были нацелены на механизм TUT-DIS3L2 в клетках HEK293T. В соответствии с этой идеей, нокдаун CYRANO с помощью двух независимых миРНК (дополнительный рис. 6c) приводила к усилению регуляции miR-7 и уменьшению 3′-хвоста и обрезки, тогда как сверхэкспрессия CYRANO, но не CYRANO с мутированным сайтом связывания miR-7 (CYRANO-mut), вызывала противоположное (рис. 6d). Глубокое секвенирование этих образцов подтвердило, что хвосты олиго-U, но не хвосты олиго-C или олиго-G, коррелируют с эффектом TDMD (дополнительная рис. 6d). В соответствии с предыдущим исследованием 17 , олиго-А-хвостые формы миР-7-5p также накапливались во время TDMD (рис. 6b, дополнительная рис. 6d), что позволяет предположить, что ферменты аденилирования также участвуют.В совокупности эти результаты позволяют предположить, что механизм TUT-DIS3L2 является частью пути TDMD.
6c) приводила к усилению регуляции miR-7 и уменьшению 3′-хвоста и обрезки, тогда как сверхэкспрессия CYRANO, но не CYRANO с мутированным сайтом связывания miR-7 (CYRANO-mut), вызывала противоположное (рис. 6d). Глубокое секвенирование этих образцов подтвердило, что хвосты олиго-U, но не хвосты олиго-C или олиго-G, коррелируют с эффектом TDMD (дополнительная рис. 6d). В соответствии с предыдущим исследованием 17 , олиго-А-хвостые формы миР-7-5p также накапливались во время TDMD (рис. 6b, дополнительная рис. 6d), что позволяет предположить, что ферменты аденилирования также участвуют.В совокупности эти результаты позволяют предположить, что механизм TUT-DIS3L2 является частью пути TDMD.
Хотя миР-7-5p является мишенью механизма TUT-DIS3L2 в клетках HEK293T, миР-7-5p не накапливалась в клетках, лишенных TUT4/7 или DIS3L2 (рис. 6c). Ни миР-222-3p, ни миР-769-5p (рис. 6c). Фактически, уровень miR-7-5p снизился в клетках DIS3L2 KO, возможно, из-за примерно трехкратного увеличения уровней CYRANO в клетках DIS3L2 KO (дополнительный рисунок 6e) и/или косвенного эффекта истощения DIS3L2. Подтверждая эту идею, уровни как мяРНК U6, так и Tyr-тРНК также были снижены в клетках DIS3L2 KO (дополнительная рис. 6f). Сверхэкспрессия CYRANO индуцировала аналогичную степень распада миР-7-5p в клетках дикого типа, TUT4/7 DKO и DIS3L2 KO (рис. 6e). Снижение канонической миР-7-5p было несколько ослаблено при истощении TUT4/7 или DIS3L2 на основе количественного определения Нозерн-блоттинга (дополнительная рис. 6g). Тем не менее, эти результаты предполагают, что механизм TUT-DIS3L2 не является существенным для TDMD.
Подтверждая эту идею, уровни как мяРНК U6, так и Tyr-тРНК также были снижены в клетках DIS3L2 KO (дополнительная рис. 6f). Сверхэкспрессия CYRANO индуцировала аналогичную степень распада миР-7-5p в клетках дикого типа, TUT4/7 DKO и DIS3L2 KO (рис. 6e). Снижение канонической миР-7-5p было несколько ослаблено при истощении TUT4/7 или DIS3L2 на основе количественного определения Нозерн-блоттинга (дополнительная рис. 6g). Тем не менее, эти результаты предполагают, что механизм TUT-DIS3L2 не является существенным для TDMD.
Возможно, экзонуклеазы, отличные от DIS3L2, функционируют параллельно во время TDMD посредством процесса обрезки 3′, который не зависит от уридилирования.Чтобы проверить это, мы сбили PARN, экзонуклеазу, специфичную для A-хвоста, или EXOSC3, ключевой компонент цитоплазматического экзосомного комплекса, как в клетках HEK293T, так и в клетках DIS3L2 KO > 90% с помощью siRNAs (дополнительная рис. 6h). В соответствии с предыдущим исследованием 17, нокдаун PARN имел незначительное влияние, если вообще имело место, на уровень miR-7-5p.

 Дж. Биол. Хим. 1972 г., 10 ноября; 247 (21): 7029–7037. [PubMed] [Google Scholar]
Дж. Биол. Хим. 1972 г., 10 ноября; 247 (21): 7029–7037. [PubMed] [Google Scholar] Proc Natl Acad Sci U S A. 1976 Apr; 73(4):1131–1135. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci U S A. 1976 Apr; 73(4):1131–1135. [Статья бесплатно PMC] [PubMed] [Google Scholar] Дж. Биол. Хим. 1980 г., 25 января; 255 (2): 728–734. [PubMed] [Google Scholar]
Дж. Биол. Хим. 1980 г., 25 января; 255 (2): 728–734. [PubMed] [Google Scholar] , Скалка А., Шапиро Л. Реаранжировка последовательностей инвертированных повторов ДНК, связанная с клеточным циклом. Proc Natl Acad Sci U S A. 1979 Dec; 76 (12): 6240–6244. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Скалка А., Шапиро Л. Реаранжировка последовательностей инвертированных повторов ДНК, связанная с клеточным циклом. Proc Natl Acad Sci U S A. 1979 Dec; 76 (12): 6240–6244. [Бесплатная статья PMC] [PubMed] [Google Scholar] Кирромицин, ингибитор биосинтеза белка, который действует на фактор элонгации Tu. Proc Natl Acad Sci U S A. 1974 Dec; 71 (12): 4910–4914. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кирромицин, ингибитор биосинтеза белка, который действует на фактор элонгации Tu. Proc Natl Acad Sci U S A. 1974 Dec; 71 (12): 4910–4914. [Бесплатная статья PMC] [PubMed] [Google Scholar]
 M.J., F.G.-S., C.S.H. и D.A.L. разработанное исследование; А.М.Дж., Ф.Г.-С. и Дж.С. проведенное исследование; A.M.J., F.G.-S., C.S.H. и D.A.L. проанализированные данные; и A.M.J., F.G.-S., C.S.H. и D.A.L. написал бумагу.
M.J., F.G.-S., C.S.H. и D.A.L. разработанное исследование; А.М.Дж., Ф.Г.-С. и Дж.С. проведенное исследование; A.M.J., F.G.-S., C.S.H. и D.A.L. проанализированные данные; и A.M.J., F.G.-S., C.S.H. и D.A.L. написал бумагу.